PRESENTACIÓN DE CASO
Endocarditis infecciosa como causa de shock séptico en paciente joven sin factores de riesgo. Un reporte de caso
Infectious endocarditis as a cause of septic shock in a young patient without risk factors. Case report
Gabriela Michelle Vanegas Contreras1
![]() *, Andrés Felipe Mercado
González1
*, Andrés Felipe Mercado
González1 ![]() *, Diego Xavier Chango Azanza 2,3
*, Diego Xavier Chango Azanza 2,3 ![]() *, Juan Bernardo Flores Siguenza2
*, Juan Bernardo Flores Siguenza2 ![]() *, María del Cisne Vega
Cobos1
*, María del Cisne Vega
Cobos1![]() *, Javier Fernando Pinos Vázquez1,2,3
*, Javier Fernando Pinos Vázquez1,2,3 ![]() *
*
1Universidad Católica de Cuenca. Carrera de Medicina-Campus Cuenca, Cuenca, Ecuador.
2Hospital del Rio. Cuenca, Ecuador.
3Centro Cardiológico del Austro. Cuenca, Ecuador.
Citar como: Vanegas Contreras GM, Mercado González AF, Chango Azanza DX, Flores Siguenza JB, Vega Cobos M del C, Pinos Vázquez JF. Endocarditis infecciosa como causa de shock séptico en paciente joven sin factores de riesgo. Un reporte de caso. Salud Cienc. Tecnol. 2022; 2:191. https://doi.org/10.56294/saludcyt2022191
Enviado: 04-11-2022 Revisado: 19-11-2022 Aceptado: 02-12-2022 Publicado: 03-12-2022
Editor: Dr.
William Castillo-González ![]()
RESUMEN
La endocarditis infecciosa es una patología que suele estar asociada a diversos factores de riesgo, entre ellos las cirugías previas de corazón o cardiopatías congénitas. Esta enfermedad se presenta generalmente con varias complicaciones clínicas debido a un diagnóstico tardío alcanzando una tasa de mortalidad alrededor del 24 %. Se presenta el caso de un paciente masculino de 17 años sin antecedentes patológicos, con fiebre de origen desconocido y síncope. Un adecuado enfoque diagnóstico permitió el reconocimiento de una endocarditis infecciosa, con desarrollo de complicaciones que fueron motivo de procedimientos como reemplazo de la válvula aórtica, reconstrucción del anillo aórtico, pericardiotomía y múltiples drenajes de colecciones infecciosas. A pesar de las complicaciones y alta mortalidad de esta patología, el paciente tuvo un pronóstico favorable.
Palabras clave: Adolescente; Choque Séptico; Endocarditis.
ABSTRACT
Infective endocarditis is a pathology that is usually associated with various risk factors, including previous heart surgeries or congenital heart disease. This disease generally presents with various clinical complications due to late diagnosis, reaching a mortality rate of around 24 %. A clinical case of a 17-year-old male patient with no pathological history is presented, with fever of unknown origin plus syncope. An adequate diagnostic approach allowed the discovery of infective endocarditis, although with the development of complications that were the reason for procedures such as aortic valvuloplasty, aortic valve replacement, reconstruction of the aortic annulus, pericardiotomy, and multiple drainages of infectious collections. Despite the complications and high mortality of this pathology, the patient had a favorable prognosis.
Keywords: Adolescent; Septic Shock; Endocarditis.
INTRODUCCIÓN
La endocarditis infecciosa (EI), es una entidad que, si bien fue descrita a mediados del siglo XVI por primera vez, no fue sino hasta 1885 cuando Osler estableció aspectos clínicos más puntuales que con el tiempo han cambiado debido a los nuevos hallazgos de esta enfermedad.(1) Tiene una alta tasa de morbilidad, y una mortalidad de alrededor del 24 %.(2) Su incidencia general es de 4/100 000/año y hospitalaria de 1,27/1000 ingresos.(2) Es común que esté asociada a uno o varios factores de riesgo para su desarrollo.(3,4)
Esta es una entidad con alto porcentaje de complicaciones, siendo necesaria cirugía en hasta el 50 % de casos.(5) El riesgo aumenta conforme evoluciona la endocarditis por lo que el diagnóstico y manejo debe ser precoz.(6) La mejor opción terapéutica depende de cada caso en específico, de su presentación, evolución y complicaciones.(6,7)
Existen diversos factores predisponentes y opciones terapéuticas. El shock séptico (SS) secundario a EI es un estado muy raro y con un porcentaje alto de mortalidad.(8) El shock cardiogénico (SC) se ve solo en un 5 % de casos y más de la mitad de los pacientes fallecen durante el ingreso, siendo esta cifra aún mayor en pacientes con SS.(9) La demora en el diagnóstico, el desarrollo de complicaciones y un adecuado tratamiento son aspectos claves en el pronóstico de la enfermedad.(9,10)
CASO CLÍNICO
Paciente masculino de 17 años, sin antecedentes patológicos, con historia de un mes de evolución, que inició con un trauma en dedo medio de mano izquierda; posterior a esto presentó fiebre intermitente, astenia y pérdida de peso no cuantificada. Presentó además dolor en región posterior de pierna derecha y síncope por lo que acudió al servicio de emergencias. Durante la valoración, sobresalió una frecuencia cardiaca de 140 latidos por minuto y dolor a la palpación en región posterior de la pierna derecha.
Una tomografía axial computarizada (TAC) de tórax mostró un derrame pericárdico moderado. En la paraclínica sanguínea se observó una leucocitosis con neutrofilia, marcadores inflamatorios positivos y alteración de la función renal (24940, neutrófilos 81 %, plaquetas 395 000, creatinina 1,4 mg/dl, PCR 94 mg/dl y CKD EPI 73). Con sospecha diagnóstica de sepsis, se inició antibiótico terapia basada en ceftriaxona y vancomicina. Posteriormente, el paciente evolucionó a shock séptico.
Se realizó un ecocardiograma transtorácico, que mostró una válvula aórtica bicúspide con presencia masas móviles adheridas al borde libre de la válvula y la presencia de una neocavidad en la pared anterior de la aorta con flujo en su interior y expansión sistólica en relación con un pseudoaneurisma de la aorta, con derrame pericárdico sin signos de taponamiento y derrame pleural derecho (Figura 1).
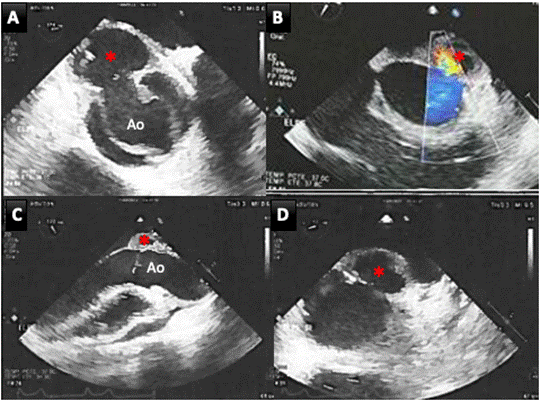
Figura 1. Hallazgos del ecocardiograma transesofágico. Se observa una válvula aórtica bicúspide sin rafe con vegetaciones adheridas al borde libre de sus valvas (A) y la presencia de una gran cavidad en la pared anterior de la aorta con presencia de expansión sistólica y flujo en su interior en relación con un pseudoaneurisma complicado (asterisco rojo). Ao: Aorta.
En relación con una endocarditis complicada de la válvula aórtica nativa más un pseudoaneurisma de la pared se decide enviar al paciente a cirugía de urgencia, confirmándose la presencia de un pseudoaneurisma de la pared de la aorta de aproximadamente 1 cm de diámetro debajo del anillo aórtico y vegetaciones en la región inferior de los velos de válvula. Se realizó reemplazo de válvula aórtica con prótesis mecánica bidisco y reparación de la pared de la aorta con parche (Figura 2). Los hemocultivos fueron positivos para Streptococcus sanguinis.
El post operatorio inmediato no fue favorable, con uso de vasopresores y hemodiálisis continua y por falla renal aguda y anuria. Se realizó drenaje pleural y mantuvo tratamiento a base de Ceftriaxona, Vancomicina y Gentamicina.
Posteriormente el paciente evolucionó a neumotórax por lo que se realizó toracotomía. Los cultivos de líquido pericárdico y vegetaciones fueron negativos, con persistencia de leucocitosis y neutrofilia. Se continuó medicación a base de Ceftriaxona y Gentamicina.
Días después, el paciente presentó dolor y edema de extremidad inferior derecha. Una resonancia magnética (RM) puso en manifiesto un absceso de pantorrilla derecha con hemocultivo positivo para Streptococcus sanguinis y S. piomiositis que comprometía el tibial posterior, flexor largo del hallux y unión miotendinosa de los tendones peroneos con presencia de edema fibrilar en la unión miotendinosa de los músculos extensor largo del hallux y extensor común de los dedos con realce mediante gadolinio (Figura 3).
Se realizó posteriormente drenaje quirúrgico y antibioticoterapia de amplio espectro: metronidazol, ceftriaxona, gentamicina y vancomicina. Finalmente, el paciente evolucionó de forma favorable con alta hospitalaria a los 29 días de internación.

Figura 2. Ecocardiograma transtorácico postoperatorio. A y B: Eje largo paraesternal izquierdo mostrando la presencia de una prótesis mecánica bidisco en posición aórtica (flecha naranja) con reparación de la pared de la aorta en el lugar del pseudoaneurisma sin flujo residual (flecha azul). C: Pared de la aorta reparada con parche sin presencia de flujo residual (flechas azules). D: Doppler continuo transprotésico mostrando gradientes normales, sin presencia de leaks significativos. Ao: aorta; VI: ventrículo izquierdo; AI: aurícula izquierda; VD: ventrículo derecho.
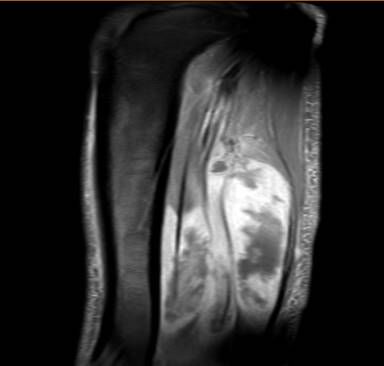
Figura 3. RM de extremidad inferior derecha.
DISCUSIÓN
Vincent et al.(8), mencionan que la EI, presenta un diagnóstico tardío o ni siquiera llega a realizarse. La mortalidad a 30 días es del 2,6 % al 20,7 %.(1,11)
Los estudios sobre esta enfermedad están más enfocados en adultos mayores, recién nacidos, lactantes por causas genéticas o enfermedades concomitantes.(10) Se menciona que personas entre 18-37 años a pesar de ser el segundo rango de edad con mayor mortalidad a los 30, no son una población muy estudiada.(11)
En las directrices de la Sociedad Europea de Cardiología del 2015 se menciona un incremento en las complicaciones por factores como aumento de bacterias con resistencia antibiótica, nuevas manifestaciones clínicas y cambios constantes de su profilaxis.(6,12)
El patógeno etiológico más frecuente es el Staphylococcus aureus (SA).(1,11) Cresti A, refiere que el SA es el más prevalente con 25 %(1), a comparación de Fowler V. con un 31,4 %(13). El Streptococcus sanguinis de la familia de Streptococcus viridans, es un microorganismo poco frecuente.(14)
En el caso descrito, por las complicaciones mencionadas, el paciente tenía una mortalidad alrededor de 40 %.(9) Los pacientes con EI acompañada y SS, tienen tasas más elevadas de trasplantes y enfermedad renal crónica; presentando con más frecuencia endocarditis infecciosa tricuspídea y siendo el Staphylococcus aureus el patógeno más frecuentemente encontrado. El SS se relaciona con embolias mayores y una bacteriemia persistente, con mayor necesidad de cirugías de emergencia.(9)
Pericas et al.(9), mencionan que factores de riesgo para shock cardiogénico ante la presencia de EI son las taquiarritmias, insuficiencia renal aguda, bloqueo cardiaco, insuficiencia valvular grave, embolias, fracción de eyección del ventrículo izquierdo reducida, sexo femenino y etiología no estreptocócica.
CONCLUSIones
La endocarditis infecciosa es una causa reconocida de fiebre de origen desconocido. Su mortalidad es elevada, especialmente si se acompaña de shock séptico. Debido a su sintomatología inespecífica, puede pasar mucho tiempo sin ser diagnosticada. Las complicaciones, como las embolias distales, pueden ser el síntoma debutante en estos pacientes. La sospecha diagnóstica, un rápido inicio en el tratamiento y una vigilancia cercana, son factores que mejoran el pronóstico de esta enfermedad.
REFERENCIAS BIBLIOGRÁFICAS
1. Cresti A, Chiavarelli M, Scalese M, Nencioni C, Valentini S, Guerrini F,;Aiello I, Picchi A, De Sensi F Habib G. Epidemiological and mortality trends in infective endocarditis, a 17-year population-based prospective study. Cardiovasc Diagn Ther. 2017;7(1):27-35. https://doi.org/10.21037%2Fcdt.2016.08.09
2. Osler W. The Gulstonian Lectures on Malignant Endocarditis. Br Med J. 1885 Mar 7;1(1262):467-70. https://doi.org/10.1136%2Fbmj.1.1263.522
3. Mahony M, Lean D, Pham L, Horvath R, Suna J, Ward C, Veerappan S, Versluis K, Nourse C. Infective Endocarditis in Children in Queensland, Australia: Epidemiology, Clinical Features and Outcome. Pediatr Infect Dis J. 2021;1;40(7):617-22. https://doi.org/10.1097/inf.0000000000003110.
4. Eleyan L, Khan AA, Musollari G, Chandiramani AS, Shaikh S, Salha A, Tarmahomed A, Harky A. Infective endocarditis in paediatric population. Eur J Pediatr. 2021;180(10):3089-100. https://doi.org/10.1007/s00431-021-04062-7.
5. Hoen B, Alla F, Selton-Suty C, Béguinot I, Bouvet A, Briançon S, Casalta JP, Danchin N, Delahaye F, Etienne J, Le Moing V, Leport C, Mainardi JL, Ruimy R, Vandenesch F; Association pour l'Etude et la Prévention de l'Endocardite Infectieuse (AEPEI) Study Group. Changing profile of infective endocarditis: results of a 1-year survey in France. JAMA. 2002;3;288(1):75-81. https://doi.org/10.1001/jama.288.1.75.
6. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2015;21;36(44):3075-128. https://doi.org/10.1093/eurheartj/ehv319.
7. Habib G Tribouilloy C Thuny F Giorgi R Brahim A Amazouz M Remadi JP Nadji G Casalta JP Coviaux F Avierinos JF Lescure X Riberi A Weiller PJ Metras D Raoult D. Prosthetic valve endocarditis: who needs surgery? A multicentre study of 104 cases. Heart. 2005;91:954–9. https://doi.org/10.1136/hrt.2004.046177.
8. Vincent L, Otto C. Infective Endocarditis: Update on Epidemiology, Outcomes, and Management. Curr Cardiol Rep. 2018;16;20(10):86. https://doi.org/10.1007/s11886-018-1043-2.
9. Pericàs JM, Hernández-Meneses M, Muñoz P, Martínez-Sellés M, Álvarez-Uria A, de Alarcón A, et al. Spanish Collaboration on Endocarditis—Grupo de Apoyo al Manejo de la Endocarditis Infecciosa en España (GAMES). Characteristics and Outcome of Acute Heart Failure in Infective Endocarditis: Focus on Cardiogenic Shock. Clin Infect Dis. 2021;7;73(5):765-74. https://doi.org/10.1093/cid/ciab098.
10. Baltimore RS, Gewitz M, Baddour LM, Beerman LB, Jackson MA, Lockhart PB, et al. American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young and the Council on Cardiovascular and Stroke Nursing. Infective Endocarditis in Childhood: 2015 Update: A Scientific Statement From the American Heart Association. Circulation. 2015;13;132(15):1487-515. https://doi.org/10.1161/cir.0000000000000298.
11. Mostaghim AS, Lo HYA, Khardori N. A retrospective epidemiologic study to define risk factors, microbiology, and clinical outcomes of infective endocarditis in a large tertiary-care teaching hospital. SAGE Open Med. 2017;13,5:2050312117741772. https://doi.org/10.1177/2050312117741772.
12. Baddour, L. M., Wilson, W. R., Bayer, A. S., Vance G. Fowler, J., Bolger, A. F., Levison, M. E., & et al. Infective Endocarditis. Circulation. 2005;111-23. https://doi.org/10.1161/circulationaha.105.165564.
13. Fowler V, Miro J, Hoen B, Cabell C, Abrutyn E, Rubinstein E, et al. Staphylococcus aureus endocarditis: a consequence of medical progress. JAMA. 2005;293(24):3012-21. https://doi.org/10.1001/jama.293.24.3012.
14. Zhu B, Macleod LC, Kitten T, Xu P. Streptococcus sanguinis biofilm formation & interaction with oral pathogens. Future Microbiol. 2018;1,13(8):915-32. https://doi.org/10.2217/fmb-2018-0043.
FINANCIACIÓN
No existe financiación para el presente trabajo
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de interés
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Gabriela Michelle Vanegas Contreras , Andrés Felipe Mercado González, Diego Xavier Chango Azanza, Juan Bernardo Flores Siguenza, María del Cisne Vega Cobos, Javier Fernando Pinos Vázquez.
Investigación: Gabriela Michelle Vanegas Contreras , Andrés Felipe Mercado González, Diego Xavier Chango Azanza, Juan Bernardo Flores Siguenza, María del Cisne Vega Cobos, Javier Fernando Pinos Vázquez.
Metodología: Gabriela Michelle Vanegas Contreras , Andrés Felipe Mercado González, Diego Xavier Chango Azanza, Juan Bernardo Flores Siguenza, María del Cisne Vega Cobos, Javier Fernando Pinos Vázquez.
Administración del proyecto: Gabriela Michelle Vanegas Contreras , Andrés Felipe Mercado González, Diego Xavier Chango Azanza, Juan Bernardo Flores Siguenza, María del Cisne Vega Cobos, Javier Fernando Pinos Vázquez.
Redacción-borrador original: Gabriela Michelle Vanegas Contreras , Andrés Felipe Mercado González, Diego Xavier Chango Azanza, Juan Bernardo Flores Siguenza, María del Cisne Vega Cobos, Javier Fernando Pinos Vázquez.
Redacción- revisión y edición: Gabriela Michelle Vanegas Contreras , Andrés Felipe Mercado González, Diego Xavier Chango Azanza, Juan Bernardo Flores Siguenza, María del Cisne Vega Cobos, Javier Fernando Pinos Vázquez.