REVISIÓN
Analysis of the therapeutic basis of cannabis and its application in medicine
Análisis de las bases terapéuticas del cannabis y su aplicación en medicina
María
Ilusión Solís Sánchez1 ![]() *,
Shirley Carolina Flores Guillen1
*,
Shirley Carolina Flores Guillen1 ![]() *,
Matías Josué Luna Mena1
*,
Matías Josué Luna Mena1 ![]() *,
Eliana Camila Puedmag Altamirano1
*,
Eliana Camila Puedmag Altamirano1 ![]() *
*
1Universidad Regional Autónoma de los Andes, Uniandes Ambato, Ecuador.
Citar como: Solís Sánchez MI, Flores Guillen SC, Luna Mena MJ, Puedmag Altamirano EC. Analysis of the therapeutic basis of cannabis and its application in medicine. Salud, Ciencia y Tecnología. 2024; 4:937. https://doi.org/10.56294/saludcyt2024937
Enviado: 31-12-2023 Revisado: 03-03-2024 Aceptado: 03-04-2024 Publicado: 04-04-2024
Editor: Prof.
Dr. William Castillo-González ![]()
ABSTRACT
This review compiles information on the therapeutic applications of cannabinoids as a basis for their application in medicine as a treatment strategy. The main objective of this review was to analyze the therapeutic benefits of cannabinoids such as: pain relief, antitumor effect, cell cycle regulation and immune stimulation. Information was compiled from various scientific databases, such as PubMed, BioCell, Scielo, Elsevier, Redalyc, MDPI, PLOS, JAFC, BJPS and Medicinal Chemistry Research, searching by keywords and selecting according to the inclusion criteria. It was possible to identify the therapeutic potential of those that endorse their interaction in receptors, thus the remarkable antitumor effect, pain relief and immune stimulation. However, the effectiveness of cannabis products varies according to the stage of the disease and dosage. It was concluded that the endocannabinoid system (ECS) offers important therapeutic activities for some diseases, whose molecular mechanisms of action have been assessed in different experimental models. The clinical applications of cannabis have been documented in several pathologies such as: cancer, epilepsy, glaucoma, arthritis, asthma, Alzheimer, Crohn, sclerosis, insomnia and Parkinson, the current legislation has opened the way for its industrial production and therapeutic use under the control of regulatory entities.
Keywords: Cannabinoids; Endocannabinoid System; Cannabis; Antitumor Effect; Immune Stimulation.
RESUMEN
En esta revisión se compila información de las aplicaciones terapéuticas de los cannabinoides como fundamento para su aplicación en medicina como estrategia de tratamiento. El objetivo principal de esta revisión fue analizar los beneficios terapéuticos de los cannabinoides como es: alivio del dolor, efecto antitumoral, regulación del ciclo celular y estimulación inmunológica. Se compiló información de diversas bases de datos científicas, como PubMed, BioCell, Scielo, Elsevier, Redalyc, MDPI, PLOS, JAFC, BJPS y Medicinal Chemistry Research, buscando por palabras claves y seleccionando acorde a los criterios de inclusión. Se pudo identificar el potencial terapéutico de los que avalan su interacción en receptores, por ello el notable efecto antitumoral, alivio del dolor y estimulación inmunológica. Sin embargo, la efectividad de los productos del cannabis varía según el estadio de la enfermedad y dosis. Se concluyó que el sistema endocannabinoide (ECS) ofrece importantes actividades terapéuticas para algunas enfermedades, cuyos mecanismos moleculares de acción han sido valorados en diferentes modelos experimentales. Se ha documentado las aplicaciones clínicas del cannabis en diversas patologías como: Cáncer, epilepsia, glaucoma, artritis, asma, Alzheimer, Crohn, esclerosis, insomnio y Parkinson, la legislación actual ha dado apertura para su producción industrial y uso terapéutico bajo el control de entidades regulatorias.
Palabras clave: Cannabinoides; Sistema Endocannabinoide; Cannabis; Efecto Antitumoral; Estimulación Inmunológica.
INTRODUCCIÓN
La justificación de este estudio de revisión bibliográfica sobre el análisis de las bases terapéuticas del cannabis y su aplicación en medicina se sustenta en varios pilares fundamentales que resaltan la relevancia, oportunidad, y necesidad de profundizar en este campo de investigación. La proliferación del uso medicinal del cannabis, respaldado por evidencias emergentes, pero aún en proceso de consolidación, hace imperativa una revisión sistemática y rigurosa de la literatura existente para esclarecer aspectos cruciales sobre su eficacia, seguridad, mecanismos de acción, y potenciales aplicaciones terapéuticas.
Dada la justificación que se menciona, la pregunta de investigación pertinente es: "¿Cuál es la eficacia y seguridad del uso terapéutico del cannabis en el tratamiento de condiciones médicas específicas en comparación con tratamientos convencionales, basado en la evidencia científica disponible hasta la fecha?"
Esta pregunta de investigación enfoca el estudio hacia la evaluación crítica de la eficacia y seguridad del cannabis, comparándolo con terapias estándar para diversas condiciones, permitiendo no solo entender su potencial terapéutico sino también sus limitaciones y riesgos. Este enfoque contribuye a la generación de un marco de evidencia científica robusto que puede informar tanto a la práctica clínica como a la elaboración de políticas públicas.
A través de esta revisión se busca establecer los mecanismos de acción y bases moleculares de los fitocannabinoides del cannabis medicinal y avalar su potencial terapéutico. A través de la interacción del sistema endocannabinoide (ECS), receptores y enzimas ejercen una importante actividad metabólica en diferentes procesos patológicos situación que altera o modula el desarrollo o progresión de enfermedades, es importante también considerar la legislación en la regulación de los fitocannanbinoides en terapéutica.(1)
Se ha evidenciado que la actividad anticancerígena está en relación con la biogénesis del cáncer, ubicación y la dosis administrada de cannabinoides, las investigaciones revisadas desvelan que los fitocananbinoides intervienen en procesos celulares proliferación, apoptosis, por ello su potencial terapéutico.(2)
El objetivo principal de esta revisión es analizar los beneficios terapéuticos de los cannabinoides como es: alivio del dolor, efecto antitumoral, regulación del ciclo celular y estimulación inmunológica.
MÉTODOS
El estudio realizado se enfocó en una exploración bibliográfica, utilizando un método hermenéutico por parte de los investigadores para analizar de manera interpretativa la revisión sistemática efectuada.
La naturaleza de la investigación fue de tipo observacional y descriptiva, abarcando un período de tiempo preferiblemente enmarcado en los últimos 5 años y revisando datos de eventos pasados.
Esta revisión tuvo como criterios de inclusión la recopilación de información de diferentes bases de datos como: PubMed, BioCell, Scielo, Elsevier, Redalyc, MDPI (Instituto Multidisciplinario de Publicaciones Digitales), PLOS (Public Library of Science), JAFC (Journal of Health Sciences). BJPS (Brazilian Journal of Pharmaceutical Sciences),) y Medicinal Chemistry Research, las publicaciones recopiladas fueron seleccionadas alineadas con la palabra clave CANNABIS y otros términos de su entorno, propuesto para esta investigación. Se excluyeron los artículos que no estuviesen fundamentalmente en los idiomas español e inglés.
RESULTADOS
Antecedentes
En la medicina ayurvédica india tradicional, el cannabis se usaba para tratar enfermedades.(3) Con respecto a la concentración de cannabinoides algunas variedades han sido reconocidas por sus mayores efectos psicoactivos, lo cual se correlaciona con el mayor contenido de canabinoides y en especial el delta-9-THC. Se describen en la literatura cerca de 60 canabinoides diferentes presentes en el material vegetal.(4) Los cannabinoides son compuestos que producen sus efectos interactuando con sitios llamados receptores cannabinoides, los más estudiados, el cannabidiol (CBD) y el delta-9-tetrahidrocannabinol (THC).(5)
El delta-9 tetrahidrocannabinol (THC) el más abundante, que tiene una alta afinidad tanto con CB1 como con CB2,(6,7) también hay cannabinoides sintéticos que pueden clasificarse generalmente como acciones duales de los receptores CB1/CB2 (no selectivas), acciones selectivas de CB1 y acciones selectivas de CB2. WIN 55,212-2 y CP 55,940, con cannabinoides sintéticos comunes que no muestran selectividad sobre los receptores CB1 y CB2. La araquidonil-2′-cloroetilamida (ACEA), el éter de noladina y la araquidonilciclopropilamida muestran una mayor afinidad por CB1 que por CB2, mientras que AM 1241, JWH-133 y HU-308 muestran una mayor selectividad por CB2 que por CB1.(8)
Control en la división celular y proliferación
En los últimos años, se ha estudiado el papel de los cannabinoides en la división y proliferación celular, especialmente en el cáncer, los endocannabinoides y cannabinoides, pueden actuar como neurotransmisores, afectando áreas del cerebro que influyen en el placer, la memoria, el pensamiento, la atención, el movimiento, la coordinación y la percepción del tiempo y el espacio. Puede unirse a moléculas llamadas receptores cannabinoides en las neuronas de estas áreas del cerebro y activarlas, alterando diversas funciones físicas y mentales.(9,10)
En estudios sobre el cáncer de mama, se descubrió que los cannabinoides ralentizan la progresión del tumor, inducen la apoptosis en células cultivadas, particularmente en células precursoras gliales, un efecto, asociado con la estimulación de la producción de ceramidas y la expresión de genes de respuesta rápida, también se ha documentado el posible uso de cannabinoides en el tratamiento de tumores poco diferenciados Glioma o cáncer de mama.(9,11)
Rol en el control del envejecimiento celular
Los cannabinoides tienen una actividad inmunomoduladora, efectos neuroprotectores y antioxidantes, lo que los convierte en herramientas potenciales para el antienvejecimiento y la longevidad. Se ha demostrado que el cannabinoide CBD actúa como una barrera contra la pérdida de humedad de la piel, lo que lleva al uso de CBD en muchos productos para el cuidado de la piel.(9,12) Se descubrió que el cannabidiol (CBN), un compuesto menos conocido que el THC y el CBD, protege las células nerviosas del daño oxidativo, una de las principales vías de muerte celular menos, preservando la función mitocondrial y previniendo el daño oxidativo a las células, lo que algún día podría conducir al desarrollo de nuevos tratamientos para enfermedades neurodegenerativas como el Alzheimer y el Parkinson (National Institute on Drug Abuse. 2019).
Los cannabinoides no psicoactivos, como el cannabidiol, pueden tener efectos antioxidantes y antiinflamatorios que pueden ayudar a prevenir el daño celular relacionado con el envejecimiento. Aunque se necesita más investigación para comprender completamente los mecanismos subyacentes, los hallazgos actuales sugieren que los cannabinoides pueden ser herramientas útiles para controlar el envejecimiento celular.(13)
Actividad anticancerígena
Los cannabinoides se dirigen al sistema endocannabinoide (SCE), influyen algunos procesos importantes en la función celular como son las vías de señalización que desempeñan un papel fundamental en el desarrollo de tumores, a respecto se ha reportado actividad en la detención del ciclo celular por ello estimular la apoptosis, reducir la proliferación, migración y la formación de nuevos vasos sanguíneos (angiogénesis) en las células cancerosas.(14) Los efectos de los cannabinoides no solo se asocian con los receptores CB (receptores CB1 y CB2), también pueden actuar con independencia a través de otros receptores TRPV1, 5-hidroxitriptamina [5-HT]3 o el receptor nicotínico de acetilcolina [nAChR], entre otros.(15,16)
Al respecto se estable que los mecanismos moleculares subyacentes a la acción antitumoral de los cannabinoides son más complejos de lo que se pensaba inicialmente, al respecto toda nueva investigación aportará importantes datos sobre futuras nuevas dianas moleculares de los cannabinoides.(17) La capacidad de los cannabinoides, tanto los naturales de las plantas como los sintéticos, para controlar el crecimiento, la invasión y la muerte de las células cancerosas se ha demostrado en líneas celulares de cáncer y modelos de ratones genéticamente modificados, sin embargo, los diferentes tipos de cannabinoides pueden tener distintos modos de acción.(2,15) El fitocannabinoide THC se caracteriza por ser un inductor de la apoptosis a través de los receptores CB, mientras que el CBD puede ejercer este efecto independientemente de los receptores CB1/CB2, posiblemente involucrando la activación del receptor TRPV2.(18) Algunos agonistas de los receptores CB, aun cuando son más afines por los receptores CB que el THC, pueden ser menos eficaces en la inducción de la muerte celular como es el caso del agonista sintético de los receptores CB WIN-55,212-2. Una comprensión más profunda de la oligomerización de los receptores CB, sus interacciones con las balsas lipídicas y los mecanismos de acoplamiento selectivo de las proteínas G podría ayudar a aclarar estas diferencias.(2,15)
Es importante tener en cuenta que los cambios moleculares en el cáncer tienen especificidad por cada tipo de tumor, lo que significa que los efectos antitumorales mediados por los receptores CB dependen en gran medida del tipo de cáncer en estudio, así como de las características específicas de la línea celular tumoral utilizada, como el origen del tumor, las características del donante y la respuesta hormonal.(17,19) En la tabla 1 se muestra el efecto antitumoral de los cannabinoides.
|
Tabla 1. Efecto antitumoral de los cannabinoides |
|||
|
Tipo de cáncer |
Regulación |
Mecanismo de acción |
Referencia |
|
Cáncer de mama |
Expresión elevada del receptor CB en tumores de mama HER2+. |
HER2 induce CB, expresión que activa ELKI (cascada ERK/MAPK), señalización prooncogenica activada a través de tirosina quinasa c-Src. |
(20,21) |
|
|
PresenciaTRPV1 en la línea celular del adenocarcinoma de mama humano (MCF-7). |
Los antagonistas de TRPV1 inducen una inhibición significativa del crecimiento de las células MCF-7 |
(22) |
|
|
CB elevado, expresión del receptor. |
Se propuso la activación de la vía de señalización de Akt. Los niveles elevados de CB y FAAH se correlacionan con la gravedad de la enfermedad. |
(23,24) |
|
Cáncer de próstata |
Expresión del receptor CB y CB significativamente mayor en el cáncer de próstata humano. |
Además: Presencia de TRPV1 y TRPA1 en todas las células de cancer de próstata (excepto las células LNCaP), TRPV2 solo en las células DU-145 y PC-3 TRPM8 en líneas celulares de próstata dependientes de AR por ejemplo: LNCaP |
(25,26,27) |
|
Expresión del receptor CB y CB significativamente mayor en el cáncer de próstata humano. |
Expresión de GPR55, se ha informado líneas celulares PC-3 y DU-145 que median los efectos de LPI. |
(27) |
|
|
Carcinoma hepatocelular inducido |
Regulación positiva de los receptores CB. |
Cáncer de hígado inducido por dietilnitrosamina. |
(28,29) |
|
Hepatocelular carcinoma |
Sobreexpresión de receptores CB Y CB. |
La sobreexpresión de los receptores CB Y CB se asocia con un mejor pronostico. |
(30) |
|
Cáncer de pulmón de células no pequeñas |
Sobreexpresión de receptores CB Y CB. |
Activación de la vía de señalización de Akt, expresión y actividad de MMP9. |
(31,32) (33,34) |
|
Leucemia linfocítica crónica |
Sobreexpresión de receptores CB Y CB. |
CB expresión del receptor correlacionada con marcadores de alto riesgo. |
(35,36) |
|
Cáncer de páncreas |
CB1 y CB receptores expresados en células de cáncer de páncreas normales y mayor expresión de CB. |
Los cannabinoides inducen la apoptosis a través del receptor CB (vía dependiente de ceramidas) |
(37,38) |
|
Melanoma |
CB está sobre expresado en tejidos y líneas celulares de melanoma humano. |
No reportado |
(37,38) |
|
Fuente: Adaptado de Barbara Dariš, M. T. (2019). Cannabinoids in cancer treatment: Therapeutic potential and legislation. PubMed Central, 14-23. |
|||
Ligandos y receptores de cannabinoides
Considerando que los cannabinoides interactúan químicamente con los receptores cannabinoides en el cuerpo, por ello desempeñan un papel crucial en la regulación de diversas funciones fisiológicas. Aquí te presento algunos ejemplos de ligandos (moléculas que se unen a los receptores) y receptores cannabinoides:
Receptor Cannabinoide 1 (CB1R)
Ligandos Endógenos: Los endocannabinoides son ligandos naturales que se producen en el cuerpo humano y se unen a los receptores CB1R. Ejemplos de endocannabinoides incluyen la anandamida y el 2-araquidonilglicerol (2-AG).
Ligandos Exógenos: El tetrahidrocannabinol (THC), el principal compuesto psicoactivo de la marihuana, es un ligando exógeno que se une a los receptores CB1R, lo que causa efectos psicoactivos.(1)
Receptor Cannabinoide 2 (CB2R)
Ligandos Endógenos: Los endocannabinoides también se unen a los receptores CB2R, aunque en menor medida que a los receptores CB1R. Los mismos endocannabinoides mencionados anteriormente, como la anandamida y el 2-AG, pueden interactuar con los receptores CB2R.
Ligandos Exógenos: Algunos cannabinoides exógenos, como el cannabidiol (CBD), también pueden unirse a los receptores CB2R. El CBD no produce efectos psicoactivos y a menudo se utiliza por sus posibles propiedades antiinflamatorias y analgésicas.(13,42)
Es importante destacar que el sistema endocannabinoide es un sistema de señalización complejo que involucra una variedad de receptores, ligandos y enzimas que regulan la síntesis y degradación de los endocannabinoides.(43) Los cannabinoides exógenos, como el THC y el CBD, pueden tener una variedad de efectos en el cuerpo debido a su interacción con estos receptores y a sus diferencias en cuanto a afinidad y actividad.(38,44)
En la tabla 2 se relacionan los receptores cannabinoides con el efecto terapéutico.
|
Tabla 2. Relación de los receptores cannabinoides con el efecto terapéutico |
||
|
Efecto terapéutico |
Receptor |
Descripción |
|
Efectos Secundarios |
Receptor CB1 y el receptor CB2. |
Los cannabinoides son liposolubles por ello su liberación se da a través del torrente sanguíneo y una sola dosis puede permanecer en el cuerpo hasta 30 días. En situaciones de anestesia general, la combinación de marihuana con efectos inhalados potentes puede resultar en una mayor depresión del corazón (18) puede dar lugar a una depresión significativa del corazón, especialmente cuando se utilizan medicamentos que aumentan la frecuencia cardíaca, como la ketamina, pancuronio, atropina y epinefrina.(41,45) |
|
Efectos Cardiovasculares |
Receptor CB1 |
Puede causar un aumento en la frecuencia cardíaca, la presión arterial alta y contracciones prematuras del ventrículo, especialmente cuando se consume en dosis altas.(45) Es evidente la asociación con problemas del corazón, como el latido auricular irregular, la fibrilación auricular, el ritmo cardíaco lento y el bloqueo entre las aurículas y ventrículos del corazón.(46) También se menciona que el cannabis puede aumentar los niveles de carboxihemoglobina en la sangre debido a una mayor demanda de oxígeno por parte del corazón, lo que puede resultar en la acumulación de plaquetas y un mayor riesgo de enfermedades cardiovasculares.(47) |
|
Efectos Neurológicos |
Receptor CB1 |
Los estudios de neuroimagen en consumidores crónicos han detectado reducciones volumétricas del hipocampo y disfunciones del metabolismo de la corteza prefrontal medial y lateral, las neuroadaptaciones se asociadas con déficits neuropsicológicos de aprendizaje y memoria, control cognitivo y toma de decisiones y con la intensidad de los síntomas psicóticos subclínicos.(48) |
|
Fuente: Adaptado de Covarrubias-Torres, N. (2019). Uso medicinal de la Marihuana. Scielo. |
||
Los CNBS tienen cierto efecto analgésico, especialmente para el dolor crónico. Esto es consecuencia de la presencia de receptores CB1 en las regiones que participan en el control de la nocicepción, tanto a nivel espinal como a nivel supraespinal. Existe además una intensa interacción entre la transmisión endocannabinoide y la opioérgica, incluso se han demostrado efectos sinérgicos, lo que ha llevado a sugerir que los CNBS podrían ser utilizados para reducir las dosis de morfina en tratamientos de dolor crónico, sin merma del efecto analgésico, pero con una reducción del potencial adictivo del opiáceo.(49)
La figura 1 sintetiza a los Cannabis y cannabinoides utilizados con fines médicos.
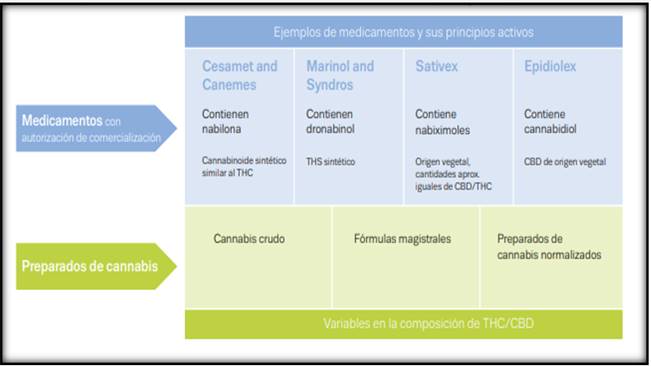
Figura 1. Cannabis y cannabinoides utilizados con fines médicos
Fuente: Adaptado de Observatorio Europeo et al., 2019), disponible en línea: https://www.emcdda.europa.eu/system/files/publications/10171/20185584_TD0618186ESN_PDF.pdf, consultado el 28-03-2023.(1)
Se ha autorizado la comercialización de varios medicamentos que contienen cannabinoides; los más mencionados son los mostrados en la tabla 3.(1)
|
Tabla 3. Medicamentos comercializados que contienen cannabinoides |
|||
|
Medicamento |
Principio activo |
Forma farmacéutica |
Función |
|
Marinol y Syndros |
Dronabinol |
cápsulas orales o solución oral con THC sintético |
El Dronabinol está indicado para la anorexia asociada a la pérdida de peso en pacientes con síndrome de inmunodeficiencia adquirida (SIDA) y la solución oral para las náuseas y los vómitos asociados a la quimioterapia contra el cáncer, generalmente después del fracaso de los tratamientos previos |
|
Cesamet y Canemes |
Nabilona |
cápsulas orales que contienen un cannabinoide sintético similar al THC |
La indicación principal son las náuseas y los vómitos asociados a la quimioterapia, habitualmente después del fracaso de los tratamientos previos |
|
Sativex |
Nabiximol) |
Polvo |
Medicamento que contiene cantidades aproximadamente iguales de THC y CBD a partir de dos extractos de cannabis. Este producto, que se pulveriza en el interior de la mejilla o debajo de la lengua, está autorizado para el tratamiento de la espasticidad muscular secundaria a la esclerosis múltiple. |
|
Epidiolex |
CBD |
solución oral de CBD de origen vegetal |
Indicada para el tratamiento de las crisis asociadas al síndrome de Lennox-Gastaut o al síndrome de Dravet en pacientes de 2 años o más. |
|
Fuente: Adaptado de Observatorio Europeo et al.(1), 2019. |
|||
El extracto de cannabis oral (OCE) es eficaz, y los Nabiximols y el tetrahidrocannabinol (THC) son probablemente eficaces, para reducir las medidas centradas en el paciente; es posible que tanto la OCE como el THC sean efectivos para reducir las medidas objetivas y centradas en el paciente al cabo de 1 año.(50) Es probable que OCE sea ineficaz para tratar las discinesias inducidas por levodopa en pacientes con enfermedad de Parkinson.(51)
Los extractos orales de cannabis son eficaces para tratar: el dolor central o espasmos, dolor relacionado con la espasticidad, exceptuando el dolor neuropático.(52)
En caso de disfunción urinaria: los nabiximols probablemente sean efectivos para reducir las evacuaciones vesicales por día; El THC y la OCE son probablemente ineficaces para reducir los problemas de vejiga, temblor: THC y OCE son probablemente ineficaces; nabiximols es posiblemente ineficaz.(53)
Farmacocinética
En la farmacocinética que se refiere a la forma en que se comportan en el organismo las preparaciones que contienen cannabinoides y los efectos que puedan surgir que son dependientes de la formulación y la vía de administración utilizada (Vargas, 2020), también influye la parte de la planta utilizada y su forma de preparación, así como la manera en que se consumen. (Rodríguez D. C., 2017). Cuando se inhala, el THC y sus metabolitos acceden al torrente sanguíneo de forma rápida a través de los pulmones siendo de 6 a 10 minutos sus máximos niveles, desde la circulación llegan al cerebro y varios órganos.(54) Los productos de cannabis actuales no abordan algunas características asociadas con los cannabinoides, como la baja solubilidad, la escasa biodisponibilidad y la falta de especificidad, lo cual puede contribuir a un bajo efecto terapéutico.(55)
Estudios recientes sugieren que el fármaco anandamida tiene la capacidad de unirse al TRPV1, lo que podría implicar que este receptor se convierte en un nuevo tipo de receptor cannabinoide efectivo.(56,57) El estudio de la farmacocinética de Δ9-THC y anandamida en ratones knockout simples (CB1) y dobles (CB1/CB2) evidenció la activación de GPR55, que es otro receptor acoplado a proteína G, diferente a los receptores CB1 y CB2, GPR55 está vinculado a la proteína Gα13 en lugar de las proteínas Gαi y Gαo. La activación de Gα13 conlleva a la activación de RhoA y al desplazamiento celular, y se ha comprobado que el cannabidiol actúa como un antagonista de GPR55.(58,59)
La biodisponibilidad del THC inhalado es del 10 % al 35 %. Una vez absorbido el THC, viaja al hígado, donde la mayor parte se elimina o metaboliza a 11-OH-THC o 11-COOH-THC. El THC restante y sus metabolitos ingresan a la circulación.(54)
Vías de administración
Las personas que consumen cannabis la vía inhalatoria es la más comúnmente utilizada por con diferentes fines puede ser mediante cigarrillos o vaporización, a través de esta vía se logran niveles muy altos de biodisponibilidad.(60,61) La administración oral, que es la opción más favorable para los seres humanos, sin embargo, en el proceso de manufactura se encuentra con diversas dificultades, especialmente al tratar de formular fármacos liposolubles en formas sólidas debido a que deben ser realizados para permitir una absorción efectiva a través de esta vía, pero puede ser efectivo en pacientes que necesitan un tratamiento de larga duración.(62) A pesar de la limitada cantidad de estudios preclínicos realizados hasta ahora, existe también la administración a través de la piel (vía transdérmica) la cual muestra un potencial prometedor.(62,63)
Metabolismo de los fitocannabinoides
Las rutas metabólicas de los fitocannabioides están asociadas con las vías de administración, así como las variaciones naturales en la actividad de todas las enzimas metabólicas, en estudios con ratas, la metabolización del THC en machos produjo varios metabolitos, mientras que en las hembras solo se generó tan solo un metabolito, el 11-OH-THC, se observa que los niveles cerebrales del metabolito 11-OH-THC eran más elevados en las ratas hembra expuestas al THC en comparación con las ratas macho.(64) En seres humanos, la exposición al THC resulta en niveles más altos de THC en el plasma sanguíneo de las mujeres, hallazgos deben ser fundamentales y tomar en consideración al momento de administrar cannabis.(64,65) En algunos casos las vías de degradación y enzimas conducen a moléculas que pueden interactuar con otros receptores, algunas de las enzimas metabólicas pueden participar en la modificación química de moléculas que tienen muy poco que ver con objetivos endocannabinoides y cannabinoides.(66)
Oxicocinética del cannabis
Como ya se mencionó, se denomina fase toxicocinética de una sustancia al conjunto de procesos que se suceden en un organismo vivo, y que regulan la concentración y biodisponibilidad de la sustancia dentro del mismo, desde que se absorbe hasta su eliminación. La fase toxicocinética comprende los procesos de absorción, distribución, biotransformación, acumulación y eliminación.(4)
Bibliografía científica confiable muestra gran cantidad de reportes de eventos adversos, varios de ellos graves e irreversibles. Entre estos, podemos nombrar paro cardiorrespiratorio, linfadenopatías, trombocitopenias, vértigo, diabetes, náuseas, vómitos, dolor abdominal, cáncer, hepatotoxicidad, reacciones anafilácticas, anorexia, somnolencia, convulsiones, accidentes cerebrovasculares, falla renal aguda, tendencia suicida y suicidio. Quizá una parte considerable de ellos se deban al THC, principal sustancia psicoactiva del cannabis, aunque todos estos efectos seguramente no pueden atribuirse solo a este compuesto.(5)
Cuando se ingiere por vía oral, los efectos clínicos pueden iniciarse desde los 15 a 90 minutos, pero tiene una duración superior a las cuatro horas, debido a una absorción continúa desde el intestino delgado, lo anterior por una baja biodisponibilidad debido al metabolismo de primer paso por el hígado, que resulta en una concentración en sangre el 25 % de lo que se obtiene si se fuma. Los efectos cognitivos y psicomotores pueden estar presentes aun 24 horas después de su administración, independientemente de la vía de administración 6. Los CBNS son altamente solubles en lípidos. Esto conduce a una liberación lenta en el torrente sanguíneo con una dosis única no se elimina por completo hasta por 30 días. Durante la anestesia general, el efecto aditivo de la marihuana y los efectos inhalados potentes puede resultar en una depresión mayor del miocardio.(49)
Efectos adversos del cannabis
Cuando la marihuana se fuma, el THC y otros CNBS se absorben rápidamente a través de los pulmones, produciendo efectos clínicos en máximos 15 minutos. Estos efectos pueden persistir durante varias horas, pero es dosis dependiente. Sin embargo, cuando se ingiere por vía oral, los efectos clínicos pueden iniciarse desde los 15 a 90 minutos, pero tiene una duración superior a las cuatro horas, debido a una absorción continúa desde el intestino delgado, lo anterior por una baja biodisponibilidad debido al metabolismo de primer paso por el hígado, que resulta en una concentración en sangre el 25 % de lo que se obtiene si se fuma. Los efectos cognitivos y psicomotores pueden estar presentes aun 24 horas después de su administración, independientemente de la vía de administración.(49)
Uno de los efectos fuertemente asociados con el uso de productos de cannabis por vía inhalada es la tos y bronquitis crónicas. Mientras esta asociación fue conclusiva, no se pudo dilucidar si el fumar cannabis acarrea un mayor riesgo de otros problemas respiratorios, como asma, enfermedad pulmonar crónica o disminución de la función pulmonar.(51) De la misma manera, el reporte concluyó que el fumar cannabis no aumenta el riesgo de cáncer de pulmón o cáncer de cabeza y cuello en adultos, que en general se asocian con fumar cigarrillos de tabaco. Los efectos del uso de cannabis durante el embarazo también fueron estudiados, y los autores del reporte llegaron a la conclusión de que fumar cannabis durante el embarazo se asociaba con infantes con bajo peso al nacer. A pesar de este hallazgo, recientes estudios han resaltado que el número de mujeres que fuman cannabis durante el embarazo ha aumentado, algunas con el fin de controlar las náuseas.(67)
DISCUSIÓN
Los autores del presente estudio consideran que el mismo es importante dado que la regulación legal del uso medicinal del cannabis ha experimentado cambios significativos en diversas jurisdicciones a nivel mundial. Estos cambios, junto a la transformación en la percepción social sobre el cannabis, impulsan la necesidad de una comprensión científica sólida que guíe tanto la política pública como las prácticas clínicas.
Además, este estudio tiene potencial terapéutico frente a desafíos clínicos actuales, pues las investigaciones preliminares sugieren que el cannabis posee propiedades terapéuticas prometedoras para tratar diversas condiciones, como el dolor crónico, la epilepsia refractaria, y algunos trastornos de ansiedad y depresión, entre otros. Sin embargo, la variabilidad en los resultados y la calidad metodológica de los estudios subraya la urgencia de realizar análisis exhaustivos, como el presente, que consoliden el conocimiento actual.
Este estudio es relevante por la complejidad del cannabis como producto natural, pues contiene más de 100 cannabinoides, con el tetrahidrocannabinol (THC) y el cannabidiol (CBD) como los más estudiados. La complejidad de su composición química y la interacción entre sus componentes requieren de estudios detallados para entender sus efectos sinérgicos y su impacto en la salud.
Igualmente, se evidencia una brecha entre la práctica clínica y el conocimiento científico, dado que la creciente aceptación del uso medicinal del cannabis contrasta con las lagunas en el conocimiento científico disponible para los profesionales de la salud. Esto resalta la necesidad de sintetizar la evidencia científica que pueda servir de base para guías clínicas, políticas de salud pública, y decisiones informadas por parte de los pacientes y proveedores de salud.
Los preparados de cannabis pueden tener una composición muy variable, dependiendo, por ejemplo, de la variedad de cannabis, de las condiciones de cultivo y de cómo se almacenan los preparados. Esto significa que puede ser complicado evaluar su eficacia en ensayos clínicos.(1) Es importante destacar que gran parte de la investigación sobre cannabinoides y cáncer se ha realizado en modelos preclínicos y en estudios en animales, y se necesita más investigación clínica en humanos para comprender completamente los efectos y la seguridad de los cannabinoides en pacientes con cáncer.
Consideraciones legales del uso del cannabis
Actualmente hay controversia respecto al uso y autorización de medicamentos con principios activos del Cannabis ya que Investigaciones recientes afirman, que los efectos secundarios provocados por los derivados cannabinoides son producidos por la interacción de éstos con el receptor CB1, no teniendo apenas efectos secundarios la interacción con el CB2.(48)
Cuando se analiza el estatus legal relacionado con la producción de cannabis medicinal en algunos países, diversas resoluciones oficiales permiten la producción de compuestos basados en cannabis a individuos particulares o a grupos (por ejemplo, ONG). Así, el Estado establece reglas básicas de producción y control de calidad, aunque diferentes de las que son exigidas a la industria farmacéutica (pública o privada) cuando esta produce un medicamento. Por ello, la autoridad regulatoria puede establecer que los derivados de los cannabis resultantes de esta práctica de cultivo, a los fines de su autorización, no constituyen un medicamento (aunque, paradójicamente, en la práctica sean usados con fines medicinales).(5)
Canadá se considera un país pionero en la legislación que permite el uso de cannabis con fines médicos. En 2001 el Gobierno canadiense emitió las primeras normas que regían el uso del cannabis con fines médicos, que permitía a pacientes con enfermedades terminales o condiciones graves acceder a la planta seca cuando ellos mismos la cultivaban. La legislación tuvo varios cambios durante los años, y en 2016 se creó el Access to Cannabis for Medical Purposes Regulations (ACMPR), que expandió el número de licencias otorgadas a compañías para cultivar, procesar y comercializar flor seca y aceites con cannabinoides.(67)
Finalmente, los autores del presente estudio señalan la necesidad de llevar a cabo investigaciones futuras que exploren la prevalencia del consumo de cannabis durante la pandemia de COVID-19 en Ecuador. A pesar de que la pandemia ha sido ampliamente estudiada por diversos investigadores ecuatorianos, con aportes significativos,(68,69,70) se identifica una notable brecha en la literatura específica sobre el consumo de cannabis en este contexto. Esta recomendación subraya la importancia de entender las dinámicas del consumo de sustancias en periodos de crisis sanitaria y cómo estos comportamientos pueden estar influenciados por las condiciones únicas impuestas por la pandemia.
CONCLUSIONES
Entre las actividades terapéuticas el efecto analgésico, antiemético han sido descriptas y estudiadas en estudio preclínicos y clínicos con importantes actividades para contrarrestar efectos adversos y secundarios en cuidados paliativos. También se menciona actividades en enfermedades neurodegenerativas para tratar sintomatología y frenar el proceso de neurodegeneración. También la posibilidad de actuar como sustancia anticancerosa, por ello su importante aplicación en preparados terapéuticos, tema que ha abarcado importantes investigaciones en éstos últimos años.
La interacción de los cannabinoides con los componentes ECS, le da versatilidad de intervenir en los mecanismos de acción de algunas enfermedades como es el cáncer, cuidados paliativos, alivio del dolor, náuseas.
Los modelos de cáncer in vitro e in vivo muestran que los cannabinoides pueden modular eficazmente el crecimiento tumoral; sin embargo, los efectos antitumorales parecen depender en gran medida del tipo de cáncer y la dosis/concentración del fármaco.
Entre las patologías que pueden ser tratadas con la marihuana están: el glaucoma, artritis reumatoide, VIH, Alzheimer, asma, cáncer, dolores crónicos de difícil control, enfermedad de Crohn, epilepsia, esclerosis múltiple, insomnio y Parkinson.
Actualmente hay discrepancias respecto a posibles efectos adversos e interacción con otros fármacos en pacientes polimedicados por múltiples implicaciones clínicas.
REFERENCIAS BIBLIOGRÁFICAS
1. Observatorio Europeo de la drogas y toxicología. Uso médico del cannabis y los cannabinoides [Internet]. 1st ed. Oficina de Publicaciones de la Unión Europea L, editor. Vol. 1. Lisboa: https://www.emcdda.europa.eu/system/files/publications/10171/20185584_TD0618186ESN_PDF.pdf; 2019 [cited 2023 Mar 27]. 1–52 p. Available from: https://www.emcdda.europa.eu/system/files/publications/10171/20185584_TD0618186ESN_PDF.pdf
2. Dariš B, Tancer Verboten M, Knez Ž, Ferk P. Cannabinoids in cancer treatment: Therapeutic potential and legislation. Bosn J Basic Med Sci. 2019 Feb 12;19(1):14–23.
3. De Janon Quevedo L. Cannabis y medicina tradicional: libertad, sociabilidad y subsidiariedad de este tipo de fitoterapia. In: Bioética UCA Argentina. 2015. p. 1–19.
4. Mosquera J. MARIHUANA - CANNABIS ASPECTOS TOXICOLÓGICOS, CLÍNICOS, SOCIALES Y POTENCIALES USOS TERAPÉUTICOS. Bogotá - Colombia; 2000. 362 p.
5. Cáceres Guido P. Cannabis medicinal: más allá del mito, solo otra droga (vegetal). Salud Colect. 2022 May 6;18:e4078.
6. Onaivi ES. Cannabinoid Receptors in Brain. In 2009 [cited 2023 Mar 8]. p. 335–69. Available from: https://pubmed.ncbi.nlm.nih.gov/19897083/
7. FREUND TF, KATONA I, PIOMELLI D. Role of Endogenous Cannabinoids in Synaptic Signaling. Physiol Rev. 2003 Jul;83(3):1017–66.
8. Tang X, Liu Z, Li X, Wang J, Li L. Cannabinoid Receptors in Myocardial Injury: A Brother Born to Rival. Int J Mol Sci. 2021 Jun 26;22(13):6886.
9. National Institute on drug abuse. página web. 2019. p. 1–10 National Institutes of Health.
10. Romero-Torres BM, Alvarado-Ramírez YA, Duran-Alonzo SR, Ruiz-Contreras AE, Herrera-Solis A, Amancio-Belmont O, et al. A potential role of hippocampus on impulsivity and alcohol consumption through CB1R. Pharmacol Biochem Behav. 2023 Apr;225:173558.
11. Gould J. Cannabis: 4 big questions. Nature. 2015 Sep 23;525(7570):S18–S18.
12. ElSohly MA, Radwan MM, Gul W, Chandra S, Galal A. Phytochemistry of Cannabis sativa L. In 2017. p. 1–36.
13. Sociedad Española del Dolor. Cannabis en el tratamiento del dolor: consideraciones clínicas y de investigación. Scielo. 2017 Feb 1;1(24).
14. Herrero Trujillano M. Medical cannabis and cancer: benefits for cancer pain and other related symptoms. Revista de la Sociedad Española del Dolor. 2022;29:14–9.
15. Abrams DI. Cannabis, Cannabinoids and Cannabis-Based Medicines in Cancer Care. Integr Cancer Ther. 2022 Jan 26;21:153473542210817.
16. Tajik T, Baghaei K, Moghadam VE, Farrokhi N, Salami SA. Extracellular vesicles of cannabis with high CBD content induce anticancer signaling in human hepatocellular carcinoma. Biomedicine & Pharmacotherapy. 2022 Aug;152:113209.
17. Zuñiga Mario; López Alberto. Terapia antitumoral con el uso de cannabinoides, un descubrimiento que podría cambiar la evolución del cáncer. Elseiver [Internet]. 2014 [cited 2023 Oct 14];13(4):244–51. Available from: https://www.elsevier.es/es-revista-gaceta-mexicana-oncologia-305-articulo-terapia-antitumoral-con-el-uso-X1665920114579076
18. Avello MPEFPCP. Potencial uso terapéutico de cannabis. Rev Médica Chile [Internet]. 2017 Aug 26 [cited 2023 Oct 11];1:360–7. Available from: https://scielo.conicyt.cl/pdf/rmc/v145n3/art10.pdf
19. Guggisberg J, Schumacher M, Gilmore G, Zylla DM. Cannabis as an Anticancer Agent: A Review of Clinical Data and Assessment of Case Reports. Cannabis Cannabinoid Res. 2022 Feb 1;7(1):24–33.
20. Kikiowo B, Ogunleye AJ, Iwaloye O, Ijatuyi TT, Adelakun NS, Alashe WO. Induced Fit Docking and Automated QSAR Studies Reveal the ER-α Inhibitory Activity of Cannabis sativa in Breast Cancer. Recent Pat Anticancer Drug Discov. 2021 May;16(2):273–84.
21. Tomko AM, Whynot EG, O’Leary LF, Dupré DJ. Anti-cancer potential of cannabis terpenes in a Taxol-resistant model of breast cancer. Can J Physiol Pharmacol. 2022 Aug 1;100(8):806–17.
22. BIMONTE S, PALMA G, CASCELLA M, CUOMO A. Phytocannabinoids in Triple Negative Breast Cancer Treatment: Current Knowledge and Future Insights. Anticancer Res. 2023 Mar 28;43(3):993–1000.
23. R. Mokoena D, P. George B, Abrahamse H. Enhancing Breast Cancer Treatment Using a Combination of Cannabidiol and Gold Nanoparticles for Photodynamic Therapy. Int J Mol Sci. 2019 Sep 26;20(19):4771.
24. Schoeman R, de la Harpe A, Beukes N, Frost CL. Cannabis with breast cancer treatment: propitious or pernicious? 3 Biotech. 2022 Feb 1;12(2):54.
25. Singh K, Nassar N, Bachari A, Schanknecht E, Telukutla S, Zomer R, et al. The Pathophysiology and the Therapeutic Potential of Cannabinoids in Prostate Cancer. Cancers (Basel). 2021 Aug 15;13(16):4107.
26. Singh K, Jamshidi N, Zomer R, Piva TJ, Mantri N. Cannabinoids and Prostate Cancer: A Systematic Review of Animal Studies. Int J Mol Sci. 2020 Aug 29;21(17):6265.
27. Mousa A, Petrovic M, Fleshner NE. Prevalence and predictors of cannabis use among men receiving androgen-deprivation therapy for advanced prostate cancer. Canadian Urological Association Journal. 2019 Apr 5;14(1).
28. Barré T, Pol S, Ramier C, Di Beo V, Carrat F, Bureau M, et al. Cannabis Use Is Inversely Associated with Overweight and Obesity in Hepatitis B Virus-Infected Patients (ANRS CO22 Hepather Cohort). Cannabis Cannabinoid Res. 2022 Oct 1;7(5):677–89.
29. Reece AS, Hulse GK. Epidemiological overview of multidimensional chromosomal and genome toxicity of cannabis exposure in congenital anomalies and cancer development. Sci Rep. 2021 Jul 6;11(1):13892.
30. ElTelbany A, Khoudari G, Al-Khadra Y, McCullough A, Alkhouri N. Lower Rates of Hepatocellular Carcinoma Observed Among Cannabis Users: A Population-Based Study. Cureus. 2022 Apr 28;
31. Ghasemiesfe M, Barrow B, Leonard S, Keyhani S, Korenstein D. Association Between Marijuana Use and Risk of Cancer. JAMA Netw Open. 2019 Nov 27;2(11):e1916318.
32. Häuser W, Welsch P, Radbruch L, Fisher E, Bell RF, Moore RA. Cannabis-based medicines and medical cannabis for adults with cancer pain. Cochrane Database of Systematic Reviews. 2023 Jun 5;2023(6).
33. Jett J, Stone E, Warren G, Cummings KM. Cannabis Use, Lung Cancer, and Related Issues. Journal of Thoracic Oncology. 2018 Apr;13(4):480–7.
34. Baumeister SE, Baurecht H, Nolde M, Alayash Z, Gläser S, Johansson M, et al. Cannabis Use, Pulmonary Function, and Lung Cancer Susceptibility: A Mendelian Randomization Study. Journal of Thoracic Oncology. 2021 Jul;16(7):1127–35.
35. BOUABOULA M, RINALDI M, CARAYON P, CARILLON C, DELPECH B, SHIRE D, et al. Cannabinoid-receptor expression in human leukocytes. Eur J Biochem. 1993 May;214(1):173–80.
36. Besser E, Gelfand A, Lewitus GM, Novak‐Kotzer H, Procaccia S, Berman P, et al. Antitumoral effects of cannabis in Notch1 ‐mutated T‐cell acute lymphoblastic leukemia. Cancer Commun. 2023 Jun 21;43(6):711–5.
37. Emhemmed F, Zhao M, Yorulmaz S, Steyer D, Leitao C, Alignan M, et al. Cannabis sativa Extract Induces Apoptosis in Human Pancreatic 3D Cancer Models: Importance of Major Antioxidant Molecules Present Therein. Molecules. 2022 Feb 11;27(4):1214.
38. Sharafi G, He H, Nikfarjam M. Potential Use of Cannabinoids for the Treatment of Pancreatic Cancer. J Pancreat Cancer. 2019 Jan 1;5(1):1–7.
39. chanknecht E, Bachari A, Nassar N, Piva T, Mantri N. Phytochemical Constituents and Derivatives of Cannabis sativa; Bridging the Gap in Melanoma Treatment. Int J Mol Sci. 2023 Jan 3;24(1):859.
40. Naderi J, Dana N, Javanmard S, Amooheidari A, Yahay M, Vaseghi G. Effects of standardized Cannabis sativa extract and ionizing radiation in melanoma cells in vitro. J Cancer Res Ther. 2020;16(6):1495.
41. Bravo Ávalos M, Elizalde Marin Letty, Morales Noriega Adriana. El cannabis como agente terapéutico en Ecuador, repercusión económica contables [Internet]. 2023. Available from: https://orcid.org/0000-0002-3442-0017
42. Wei TT, Chandy M, Nishiga M, Zhang A, Kumar KK, Thomas D, et al. Cannabinoid receptor 1 antagonist genistein attenuates marijuana-induced vascular inflammation. Cell. 2022 May;185(10):1676-1693.e23.
43. Mayorga-Niño F, Torres-Vidales G. Canabinoides y endocanabinoides como herramienta para el desarrollo de posibles antineoplásicos en caninos. Una revisión. Vol. 18. 2014.
44. Muller C, Morales P, Reggio PH. Cannabinoid Ligands Targeting TRP Channels. Front Mol Neurosci. 2019 Jan 15;11.
45. Rojas-Jara C, Polanco-Carrasco R, Cisterna A, Hernández V, Miranda F, Moreno A, et al. Uso medicinal de cannabis: una revisión de la evidencia Medicinal use of cannabis: a review of the evidence. TERAPIA PSICOLÓGICA 2019. 2019;37:166–80.
46. Anaya HJM, Ortiz MPT, Valencia DHF, Ribero OFG. Efficacy of cannabinoids in fibromyalgia: A literature review. Vol. 49, Colombian Journal of Anesthesiology. Sociedad Colombiana de Anestesiología y Reanimación; 2021.
47. Aguado MÁA, Recio EG, de Santiago Moraga J, Nicolás MS. Is medical cannabis useful for the treatment of fibromyalgia? Revista de la Sociedad Española del Dolor. 2022;29:27–31.
48. García Carlos Suero, Banderas Lucia Martín, Holgado María de los Ángeles. Efecto neuroprotector de los cannabinoides en las enfermedades neurodegenerativas. Ars Pharmaceutica [Internet]. 2015 Mar 15 [cited 2023 Oct 14];56(2):77–87. Available from: https://scielo.isciii.es/pdf/ars/v56n2/revision2.pdf
49. Torres C. Uso medicinal de la Marihuana. Scielo. 2019;31(2):10.
50. Chang-Douglass S, Mulvihill C, Pilling S. Cannabis-based medicinal products: summary of NICE guidance. BMJ. 2020 Apr 21;m1108.
51. Koppel BS, Brust JCM, Fife T, Bronstein J, Youssof S, Gronseth G, et al. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2014 Apr 29;82(17):1556–63.
52. Krcevski‐Skvarc N, Wells C, Häuser W. Availability and approval of cannabis‐based medicines for chronic pain management and palliative/supportive care in Europe: A survey of the status in the chapters of the European Pain Federation. European Journal of Pain. 2018 Mar 13;22(3):440–54.
53. Koppel BS, Brust JCM, Fife T, Bronstein J, Youssof S, Gronseth G, et al. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology. 2014 Apr 29;82(17):1556–63.
54. Chayasirisobhon S. Mechanisms of Action and Pharmacokinetics of Cannabis. Perm J. 2021 Mar;25(1):1–3.
55. Kebede L, Masoomi Dezfooli S, Seyfoddin A. Medicinal cannabis pharmacokinetics and potential methods of delivery. Pharm Dev Technol. 2022 Feb 7;27(2):202–14.
56. Moss DA, Hawks MK, Snyder MJ, Crawford PF. Integrative Medicine: Cannabis and Cannabis-Related Drugs. FP Essent. 2021 Jun;505:28–34.
57. Koltai H, Poulin P, Namdar D. Promoting cannabis products to pharmaceutical drugs. European Journal of Pharmaceutical Sciences. 2019 Apr;132:118–20.
58. Maule WJ. Medical uses of marijuana (Cannabis sativa): fact or fallacy? Br J Biomed Sci. 2015 Jan 4;72(2):85–91.
59. Schmelz M, Häuser W, Hoch E, Petzke F, Sommer C. Cannabisbasierte Arzneimittel. Der Schmerz. 2019 Apr 4;33(2):97–9.
60. Swift W, Coffey C, Degenhardt L, Carlin JB, Romaniuk H, Patton GC. Cannabis and progression to other substance use in young adults: findings from a 13-year prospective population-based study. J Epidemiol Community Health (1978). 2012 Jul;66(7):e26–e26.
61. Poyatos L, Pérez-Acevedo AP, Papaseit E, Pérez-Mañá C, Martin S, Hladun O, et al. Oral Administration of Cannabis and Δ-9-tetrahydrocannabinol (THC) Preparations: A Systematic Review. Medicina (B Aires). 2020 Jun 23;56(6):309.
62. Lucas CJ, Galettis P, Schneider J. The pharmacokinetics and the pharmacodynamics of cannabinoids. Br J Clin Pharmacol. 2018 Nov 7;84(11):2477–82.
63. Amin MR, Ali DW. Pharmacology of Medical Cannabis. Adv Exp Med Biol. 2019;1162:151–65.
64. Lucas CJ, Galettis P, Schneider J. The pharmacokinetics and the pharmacodynamics of cannabinoids. Br J Clin Pharmacol. 2018 Nov 7;84(11):2477–82.
65. Grotenhermen F. Pharmacokinetics and Pharmacodynamics of Cannabinoids. Clin Pharmacokinet. 2003;42(4):327–60.
66. Di Marzo V, Piscitelli F. The Endocannabinoid System and its Modulation by Phytocannabinoids. Neurotherapeutics. 2015 Oct 14;12(4):692–8.
67. Cubillos Sánchez PA. Cannabis for medical and scientific purposes: the Colombian landscape. Colombian Journal of Anesthesiology. 2020 Nov 29;49(2).
68. Llerena Cepeda M de L, Sailema López LK, Zúñiga Cárdenas GA. Variantes de COVID-19 predominates en Ecuador y sus síntomas asociados. Universidad y Sociedad [Internet]. 9jun.2022 [citado 11sep.2023];14(S3):93-04. Available from: https://rus.ucf.edu.cu/index.php/rus/article/view/2939
69. Zúñiga Cárdenas GA, Sailema López LK, Alfonso González I. Pacientes de COVID-19 en cuidados intensivos y sus lesiones cutáneas. Universidad y Sociedad [Internet]. 9jun.2022 [citado 19sep.2023];14(S3):105-17. Available from: https://rus.ucf.edu.cu/index.php/rus/article/view/2940
70. Ramos Serpa G, Gómez Armijos CE, López Falcón A. Aspectos de éticas sobre la vacunación contra el COVID-19. Universidad y Sociedad [Internet]. 9jun.2022 [citado 19sep.2023];14(S3):60-1. Available from: https://rus.ucf.edu.cu/index.php/rus/article/view/2935
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: María Ilusión Solís Sánchez, Shirley Carolina Flores Guillen, Matías Josué Luna Mena, Eliana Camila Puedmag Altamirano.
Investigación: María Ilusión Solís Sánchez, Shirley Carolina Flores Guillen, Matías Josué Luna Mena, Eliana Camila Puedmag Altamirano.
Metodología: María Ilusión Solís Sánchez, Shirley Carolina Flores Guillen, Matías Josué Luna Mena, Eliana Camila Puedmag Altamirano.
Redacción – borrador original: María Ilusión Solís Sánchez, Shirley Carolina Flores Guillen, Matías Josué Luna Mena, Eliana Camila Puedmag Altamirano.
Redacción – revisión y edición: María Ilusión Solís Sánchez, Shirley Carolina Flores Guillen, Matías Josué Luna Mena, Eliana Camila Puedmag Altamirano.