doi: 10.56294/saludcyt20241103
REVISIÓN BIBLIOGRÁFICA
Diagnostic biomarkers in mastocytosis
Biomarcadores de diagnóstico en mastocitosis
Viviana Estephania Núñez Reyes1 ![]() *, María Elizabeth Proaño Pérez1,2
*, María Elizabeth Proaño Pérez1,2 ![]() *
*
1Universidad Técnica de Ambato, Facultad de Ciencias de la Salud, Ambato, Ecuador.
2Grupo de investigación NUTRIGENX, Facultad de Ciencias de la Salud, Ambato, Ecuador.
Citar como: Núñez Reyes VE, Proaño Pérez ME. Diagnostic biomarkers in mastocytosis. Salud, Ciencia y Tecnología. 2024; 4:1103. https://doi.org/10.56294/saludcyt20241103
Enviado: 09-01-2024 Revisado: 03-04-2024 Aceptado: 19-06-2024 Publicado:20-06-2024
Editor: Dr.
William Castillo-González ![]()
ABSTRACT
Introduction: mastocytosis is a rare disease triggered by the KIT D816V mutation that increases the proliferation and survival of mast cells in several organs. Mast cells have crucial receptors such as KIT, TLR, complement (C5aR, C3aR), MHCI, MHCII, MRGPRX, and FcεRI that allow them to activate and degranulate in innate and adaptive immune responses. The prevalence of mastocytosis is 10 cases per 10,000 individuals worldwide and is classified into cutaneous and systemic mastocytosis, affecting both children and adults.
Objective: characterize the specific biomarkers crucial for the prognosis, diagnosis, and monitoring of Mastocytosis.
Method: a bibliographic review was conducted by searching information in databases such as Pubmed, ScienceDirect, and Google Scholar from March to May 2024, including a total of 35 English articles published in the last 10 years and several published before 2019 that contributed relevant information to the topic.
Results: it has been determined that prognostic biomarkers help identify severe forms of the disease. Meanwhile, diagnostic and follow-up biomarkers are utilized to confirm the disease and evaluate its progression and treatment effectiveness. Additionally, it has been demonstrated that biomarkers can determine the risk of anaphylaxis, as well as the subtypes of mastocytosis.
Conclusion: biomarkers for the prognosis of mastocytosis, such as basal serum tryptase (BST) and hereditary α-tryptasemia (HαT) were characterized. In addition, diagnostic and monitoring biomarkers such as the KID D816V mutation, analysis of extracellular vesicles (EVs), CD25+/CD2+/CD30+, MITF, miRNAs, LBP, CXCL7, TGF-β1, PDGFRβ, IL-6, leukotrienes, prostaglandin, histamine, and IgE.
Keywords: Biomarkers; Diagnosis; Kit D816V; Mast Cells; Mutation; Mastocytosis.
RESUMEN
Introducción: la mastocitosis es una enfermedad rara, desencadenada por la mutación KIT D816V que aumenta la proliferación y supervivencia de los mastocitos en varios órganos. Los mastocitos tienen receptores importantes como: KIT, TLR, de complemento (C5aR, C3aR), MHCI, MHCII, MRGPRX y FcεRI que les permiten activarse y degranular en las respuestas de la inmunidad innata y adaptativa. La prevalencia de mastocitosis es de 10 casos por 10 000 habitantes a nivel mundial y se clasifica en mastocitosis cutánea y sistémica afectando tanto a niños como adultos.
Objetivo: caracterizar los biomarcadores utilizados en el pronóstico, diagnóstico y seguimiento de Mastocitosis.
Método: se realizó una revisión bibliográfica mediante la búsqueda de información en las bases de datos como Pubmed, SciencieDirect y Google Académico, durante el periodo marzo-mayo del 2024, incluyendo un total de 35 artículos en inglés, publicados en los últimos 5 años y varios publicados antes del 2019 que aportaron con información relevante al tema.
Resultados: se estableció que los biomarcadores de pronóstico permiten identificar las formas graves de la enfermedad, mientras que los de diagnóstico y seguimiento se utilizan para confirmar la enfermedad, evaluar progresión, eficacia del tratamiento, identificar el riesgo de anafilaxia y los subtipos de mastocitosis.
Conclusión: se caracterizaron biomarcadores para el pronóstico de mastocitosis como la triptasa sérica basal (BST) y α-triptasemia hereditaria (HαT). Además, biomarcadores de diagnóstico y seguimiento como: la mutación KID D816V, análisis de vesículas extracelulares (EVs), CD25+/CD2+/CD30+, MITF, miARNs, LBP, CXCL7, TGF-β1, PDGFRβ, IL-6, leucotrienos, prostaglandina, histamina e IgE.
Palabras Clave: Biomarcadores; Diagnóstico; Kit D816V; Mastocitos; Mutación; Mastocitosis.
INTRODUCCIÓN
La mastocitosis es una enfermedad poco común caracterizada por la expansión y acumulación clonal de mastocitos en varios órganos, como la médula ósea (MO), piel, hígado, bazo, ganglios linfáticos y tracto gastrointestinal.(1) Los mastocitos son células inmunitarias que inician y modulan reacciones inflamatorias y anafilácticas, mediante la vasodilatación y reclutamiento celular.(2) Cumplen funciones importantes, en la inmunidad innata al responder rápidamente a antígenos extraños y liberar sustancias para combatir infecciones; (3) en la adaptativa procesan y presentan antígenos por el complejo mayor de histocompatibilidad I-II (MHCI - MHCII)(4) y participan en la hipersensibilidad tipo I, tras la unión del alérgeno con la IgE que interacciona con del receptor de alta afinidad para IgE (FcεRI) produciendo reacciones alérgicas.(2)
La mastocitosis fue descrita por primera vez a principios del siglo XX e identificaron que más del 90 % de los pacientes presentan la mutación D816V en el receptor de tirosina quinasa KIT, que aumentan la supervivencia y proliferación de los mastocitos.(5) Según, investigaciones a nivel mundial, su prevalencia en el 2023 fue de 10 casos por cada 100 000, cifra que ha incrementado a 20 por cada 100 000, debido a la aplicación de nuevos métodos diagnósticos. En Latinoamérica, su prevalencia es menor con un número aproximado de 2 pacientes por año, sin embargo, en Ecuador no existe registros que confirmen el diagnóstico de casos.(6,7)
La Organización Mundial de la Salud (OMS) ha clasificado la mastocitosis en, mastocitosis cutánea (CM), que se desarrolla principalmente en niños y se identifica por la presencia de lesiones cutáneas con infiltraciones de mastocitos atípicos, (5,1) y en mastocitosis sistémica (SM), que afecta a adultos y se caracteriza por la expansión clonal y acumulación de mastocitos neoplásicos en MO y órganos viscerales.(5,8) Los síntomas y manifestaciones clínicas varían según la ubicación y cantidad de mastocitos presentes.(9,10)
En los últimos años, debido a los avances significativos de los métodos de diagnóstico han permitido confirmar con mayor precisión los casos de la mastocitosis, es por ello que el objetivo de este estudio es caracterizar los biomarcadores que son utilizados en el pronóstico, diagnóstico y seguimiento de la enfermedad, ya que ofrecen información sobre la progresión, confirmación y evaluación de los tratamientos en mastocitosis para prevenir complicaciones en la salud de estos pacientes.
MÉTODO
Se realizó una revisión bibliográfica utilizando varias bases de datos como Pubmed, SciencieDirect y Google Académico en el periodo marzo-mayo del 2024, donde se incluyeron artículos de revisión bibliográfica y originales en inglés, de gran impacto, publicados en los últimos 5 años y varios publicados antes del 2019, de los cuales se extrajo un total de 35 artículos que acotaron con información relevante del tema. Las palabras claves que se utilizaron en los filtros de búsqueda fueron: biomarcadores, diagnóstico, KIT D816V, mastocitos y mastocitosis.
RESULTADOS
Los mastocitos, se originan de la célula madre hematopoyética multipotencial en la MO y migran hacia los tejidos para culminar su maduración, la cual está regulada por factores transcripcionales (GATA-1, GATA-2 y PU-1), MITF, factor de crecimiento endotelial vascular (VEGF), factor derivado de las plaquetas (PDGF), factor de crecimiento nervioso (NGF), TGF-β e interleucinas IL-3 e IL-4. (3,18)
Los mastocitos además, presentan en su estructura receptores importantes como, el de tipo tirosina quinasa KIT, que al unirse con el factor de células madre (SCF) promueve la proliferación y supervivencia de los mastocitos.(19,8) Receptores que participan en la inmunidad innata, como los de tipo Toll (TLR), de histamina (H1R-2,3,4), del complemento (CR1-5, C5aR, C3aR), el miembro X2 del receptor acoplado a proteína G con MAS (MRGPRX) y de prostaglandina E2 (PGE2); en la inmunidad adaptativa están los receptores de moléculas coestimuladoras (OX40L, CD40L), MHCI, MHCII y FcεRI. (2,3,20)
Por otro lado, los gránulos de los mastocitos se clasifican en pre-almacenados y sintetizados de novo que son liberados en situaciones de defensa y procesos inflamatorios. Los primeros incluyen: serotonina, histamina, heparina, TNF-α, triptasa, quimasa, proteasas, proteoglicanos, carboxipeptidasa y fosfolipasa; y en los gránulos de novo están: mediadores lipídicos (prostagladinas, leucotrienos, PAF), interleucinas, (IL-5, IL-8, IL-10) y factores de crecimiento (PDGF, VEGF, FGF, TGF-β).(2)
Los mastocitos se activan independientemente de IgE, por receptores tipo Toll (TLR1-7) y tipo NOD (NLR) que al interactuar con patrones moleculares asociados a patógenos liberan mediadores inflamatorios.(21) La activación por H1R, libera histamina y promueve la producción de IL-4, IL-13, relacionadas con alergias.(2) El receptor MRGPRX2 estimulado por la sustancia P, y péptidos para la protección contra infecciones bacterianas (HDP), libera sustancias pro-inflamatorias, provocando prurito, urticaria, inhibición bacteriana y reacciones inflamatorias.(3)
Además, el MHCI y MHCII interactúan con el receptor de células T induciendo su expansión clonal.(2,21) La interacción de MHCII y OX40L con células TCD4+ aumenta la proliferación y secreción de citoquinas (IL-22 y IFN- γ). Finalmente, C3aR y C5aR, interaccionan con CR3 y CR5 para inducir a la degranulación y secreción de citocinas quimiotácticas (CCL2 y CCL5).(18, 2,21)
La activación dependiente de IgE, se produce al unirse el alérgeno a la IgE que interaccionan con FcεRI en mastocitos,(2) desencadenando la fosforilación de los “motivos de activación basados en tirosina” (ITAM) por Lyn y Syk, y fosforilando TRAP y NTAL. En TRAP se unen SH2, Grb2 y PLCγ. PLCγ cataliza la hidrólisis de fosfatidil inositol 4,5-bisfosfato, formando, diacilglicérido e inositol 1,4,5-trifosfato.(10,2) Estos se unen a sus receptores en el retículo endoplasmático liberando calcio. Posteriormente, la interacción de la molécula estromal del sensor de calcio 1 (STIM1) con la proteína de membrana ORAI-1 activan los canales CRAC, permitiendo la entrada de calcio para desencadenar más eventos de señalización y degranulación celular.(22,2)
La unión de SCF a KIT, produce la dimerización y fosforilación del receptor para reclutar moléculas de señalización (Src, PI3K, PLCγ). En la vía PI3/AKT, fosfatidilinositol 3-quinasa (PI3K) activa a AKT. La vía Ras-Raf Map quinasa (MAPK), que se activa por medio de intercambio de nucleótidos de guanina (SOS), PI3K y PLCγ permitiendo la entrada de Ca2+ necesario para la activar los mastocitos y la vía JAK/STAT, donde JAK2 se activa y fosforila a los reguladores transcripcionales STAT. Estas vías desencadenan la proliferación, supervivencia y migración mastocitaria.(2,19, 24)
Regulación: la proteína LYN, regula la activación mastocitaria dependiente de IgE por medio de la proteína inhibitoria SHIP-1.(23) La proteína citoplasmática adaptadora SH3 (3BP2) promueve la señalización de KIT, y su silenciamiento disminuye PI3K, ERK1/2, MITF e induce la apoptosis.(25) MITF, regula la expresión y actividad de KIT(11) y su silenciamiento reduce la viabilidad y ciclo celular, así como la disminución de la degranulación dependiente de IgE en células humanas mastocitarias HMC-1.(26)
Fisiopatología de la mastocitosis
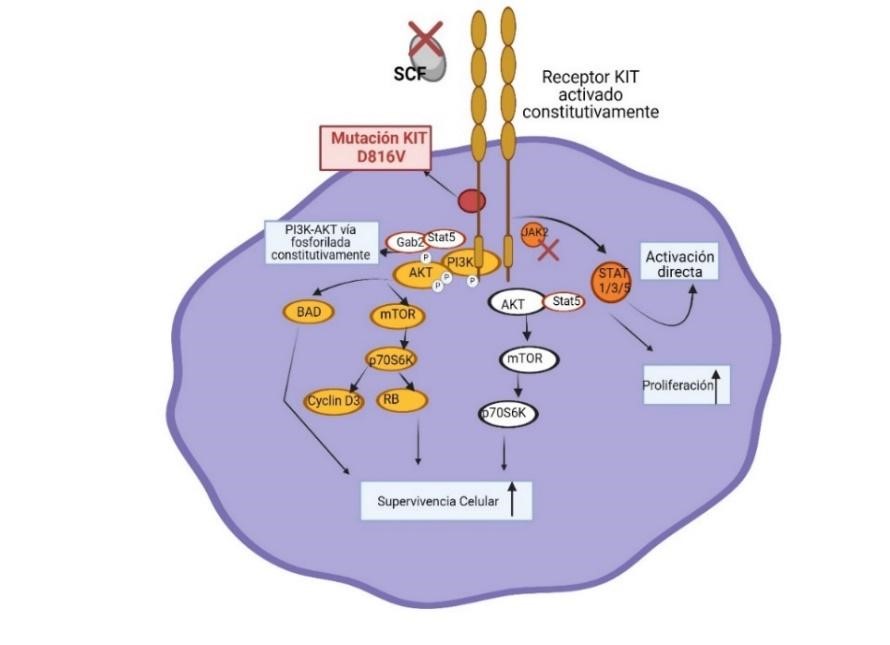
La mutación puntual de KIT D816V resultante de la sustitución del ácido aspártico en la posición 816 por valina, provoca una ganancia de función en el receptor tirosina quinasa, desregulando la vía de señalización JAK2/STAT5, tras activar directamente STAT5 sin la activación previa de JAK y en la vía PI3K/AKT, AKT permanece constantemente fosforilada. Estas alteraciones inducen a la proliferación descontrolada y a una mayor supervivencia de los mastocitos, desencadenando así la mastocitosis.(5,19,24) Por otro lado, la mutación KIT D816V produce la fosforilación de la proteína adaptadora NTAL/LAT2, activando la degranulación dependiente de IgE, ya que esta proteína se puede activar por la vía FcεRI y KIT(23) (Material suplementario 1).(19,24)
Clasificación
· Mastocitosis cutánea (CM): se caracteriza por la presencia de lesiones localizadas o diseminadas, marrones o rojas y con signo de Darier positivo (enrojecimiento al aplicar presión en una lesión), por la liberación de mediadores mastocitarios.(28) Subclasificación:
§ Mastocitosis maculopapular o urticaria pigmentosa.
§ Mastocitoma.
§ Mastocitosis cutánea difusa y localizada en piel.(1)
· Mastocitosis sistémica (SM): caracterizada por la acumulación y expansión clonal de mastocitos, con o sin afectación cutánea y presencia de la mutación KIT D816V,(8) u otras mutaciones menos frecuentes: V560G, D815K, D816Y, insVI815-816, D816F, D816H, D820G, TET2 y N-RA.(17) Subclasificación:
§ No avanzada: mastocitosis sistémica indolente (ISM), mastocitosis de médula ósea (BMM) y SM latente (SSM).(6)
§ Avanzada: mastocitosis sistémica asociada a neoplasias hematológicas (SM-AHN), mastocitosis sistémica agresiva (ASM), leucemia de mastocitos (MCL) y tumores de mastocitos agresivos localizados; sarcoma de mastocitos (SQM).(6)
Diagnóstico
Es necesario aplicar varios algoritmos y combinar estudios de inmunofenotipado, inmunohistoquímica, citometría de flujo y exámenes moleculares para el diagnóstico de mastocitosis (Material suplementario 2).(1,9,17)
Biomarcadores
Mutación kit D816V
La mutación KIT D816V se detecta en muestras de MO por PCR mediada por ácido nucleico peptídico (PNA-PCR) y PCR digital (dPCR) y en sangre por la técnica de reacción en cadena de polimerasa cuantitativa específica de alelo ASO-QPCR,(14,29) de estás, dPCR resulta ser más sensible para detectar la mutación D816V facilitando el diagnóstico de SM.(29)
Triptasa Sérica
La triptasa sérica es una sustancia pre-almacenada de los mastocitos, se libera constitutivamente en su forma pro beta-triptasa y se asocia a la degranulación mastocitaria.(13) En anafilaxia y mastocitosis, los niveles aumentan temporalmente e indican la activación de los mastocitos. Sus concentraciones son medidas en sangre mediante inmunoensayo basado en Fluoroinmunoenzima y ELISA, se consideran normales aquellos valores ≤ 5ng/ml, 10 – 15 ng/ml e incluso ≤ 15 ng/ml.(30) Mientras que, en SM los niveles están >20 ng/ml, en SM avanzada, ASM, SM-NHA MCL los valores son >200 ng/ml, y en ISM varían según la masa total de mastocitos.(17)
α-triptasemia hereditaria (HαT)
La triptasa está codificada por cuatro genes: TPSG1 (γ-triptasa), TPSB2 (β-triptasa), TPSAB1 (α-β triptasa) y TPSD1 (δ-triptasa). La variante TPSAB1 codifica a α-triptasemia hereditaria (HαT), donde la ganancia en el número de copias de TPSAB1 se asocia con niveles altos de triptasa sérica, con síntomas como hipersensibilidad inmediata, enrojecimiento, prurito, problemas gastrointestinales y con un mayor riesgo de anafilaxia en pacientes con SM. Se analiza en muestras de sangre o MO, mediante la técnica de reacción en cadena de la polimerasa digital en gota (ddPCR) (droplet digital PCR) con sondas para α y β triptasa.(13)
Inmunofenotipos
Los inmunofenotipos CD25+, CD2+ y CD30+ expresados en mastocitos neoplásicos han sido detectados en muestras de MO por medio de inmunohistoquímica y en sangre mediante citometría de flujo en pacientes con SM, ASM, MCL e ISM, que además se correlacionan con niveles de triptasa sérica ≥ 50 ng/ml en aproximadamente 80 % de estos pacientes.(1,17)
Histamina
La histamina es una amina sintetizada a partir de la L-histidina en los mastocitos y sus niveles se relacionan con la carga total mastocitaria en MO u otros órganos. En el caso de SM, las concentraciones altas de histamina indican mayor acúmulo de mastocitos y se asocian con síntomas como prurito y urticaria. Su detección se realiza mediante espectrometría de masas y cromatografía en muestras de MO y sangre, revelando niveles por encima del rango normal de 20 - 200 ng/ml.(31) Mientras que, al ser metabolizada se convierte en ácido M-metilimidazol acético (MIAA), cuantificada en orina de 24 horas, con valores normales de 30 – 200 ug/g Cr y en mastocitosis >400 Ug/g Cr.(15)
Exosomas
Las vesículas extracelulares (EVs) o exosomas (40-150 nm de diámetro) y microvesículas (50-1000 nm) son estructuras redondas de membrana secretadas por todas las células, como por mastocitos. Las EVs contienen moléculas bioactivas, lípidos, ARN, ADN, microARN, triptasa, FcεRI, MRGPRX2 y KIT.(32) En pacientes con SM, las EVs presentan proteínas específicas de mastocitos neoplásicos, como KIT fosforilado asociado con la presencia de KIT D816. Los valores aproximados de EVs (30x1011 partículas/mL) se relacionan con niveles altos de triptasa (100 ng/ml - 110 ng/ml) en SM.(32,16)
Además, después de la degranulación mediada por IgE, los mastocitos liberan exosomas que contienen IgE y citoquinas. Estas EVs han sido detectadas en muestras de plasma de pacientes con mastocitosis, por métodos de Exo Quick-ULTRA, (ultracentrifugación). (32,16)
MITF y microARN
MITF se encuentra altamente expresado en mastocitos neoplásicos, en muestras de MO en pacientes con SM, determinado por técnicas de inmunohistoquímica con el uso de anticuerpos c5 para la tinción de mitf. además, se observó la expresión de ciertos microANRs en los exosomas de mastocitos en las muestras de mo en sm: hsa-mir-451, hsa-mir-503, mirplus_27560, mirplus_2843, mirplus_27564, hsa- mir-583, mirplus_1795, mirplus_17890, hsa-mir-663 y hsa-mir-30b.(11)
IL-6
La IL-6, actúa como estimulador de crecimiento autocrino, activador celular y promotor inflamatorio. Sus niveles normales son hasta 1,8 pg/ml, puede ser medido en suero y MO mediante ELISA o citometría de flujo. Mientras que, en SM los valores se encuentran sobre el rango referencial y se relacionan con la expresión D816V y triptasa. Además, es utilizado para evaluar la gravedad y progresión de la enfermedad.(33)
Prostaglandinas y leucotrienos
La prostaglandina D2 liberada por los mastocitos, es metaboliza por la vía del anillo J (15 desoxiD12,14-PDJ2), D (tetranor PGDM) y F (11b-PGF2a; 2,3 dinor-11b-PGF2a), donde PGF2a, es detectada en orina y sus niveles normales son <1000 ng/24h Cr, pero en SM >3500 ng/24h Cr. El leucotrieno E4 es un mediador inflamatorio, sus valores normales son <104 pg/mg Cr en orina, sin embargo, en SM y anafilaxia están sobre el rango referencial. Estos marcadores se miden por cromatografía líquida y espectrometría de masas, en orina y sangre.(15)
CXCL7, LBP, TGF-β1 y PDGFRβ
En la mastocitosis la quimiocina CXCL7, atrae neutrófilos a sitios de inflamación y se asocia con anafilaxia; el TGF-β1 produce un impacto negativo en la proliferación y activación de los mastocitos y tiene efectos pleiotrópicos que dependen del microambiente celular; el PDGFRβ, al unirse al ligando PDGF desencadena la proliferación y migración mastocitaria y el LBP es importante en las respuestas de los mastocitos frente a los lipopolisacáridos bacterianos; estos biomarcadores han sido identificados y cuantificadas en concentraciones altas en pacientes con SM mediante espectrometría de masas (SWATH-MS) y ELISA en muestras sanguíneas.(12)
IgE
Los pacientes con mastocitosis tienen mayor riesgo de desarrollar anafilaxia y reacciones alérgicas graves, por lo que es importante su cuantificación en sangre, los niveles normales en sangre van de 0-100 unidades internacionales por mililitro (UI/mL) en adultos y de 0-85 UI/mL en niños. Además, es necesario realizar la detección de IgE específica de alérgenos en sangre, donde valores <0,3 unidades estandarizadas de chip de alérgenos en fase sólida (ISU), indica concentraciones debajo del límite; >0,3 a <1 ISU, bajo; ≥1 a <10 ISU, de moderado a alto y >10 ISU, muy alto. Se recomienda realizar esta última prueba, ya que la serológica puede generar resultados falsos negativos por las administraciones de medicamentos antialérgicos. (34,35)
|
Tabla 1. Grupos de biomarcadores utilizados en el pronóstico, diagnóstico y seguimiento de la mastocitosis |
||||
|
Biomarcador |
Técnicas |
Pronóstico /Diagnóstico |
Valores Referenciales |
Bibliografía |
|
Biomarcadores de pronóstico |
||||
|
-Triptasa sérica |
ELISA |
Mastocitosis y subtipos |
-Normal: <15 ng/ml -MC: < 20 ng/ml -SM: >20 ng/ml -Mastocitosis avanzada: >200 ng/ml -ISM: bajo o alto, en relación a la masa total de mastocitos. |
(13) (17) (30) |
|
α-triptasemia hereditaria |
PCR digital en gotas. |
Mastocitosis sistémica Riesgo de anafilaxia |
-SM: ganancia en el número de copias de TPSAB1 |
(13) |
|
Biomarcadores de diagnóstico y seguimiento |
||||
|
-Mutación KIT D816V |
PNA-PCR ASO-QPCR PCR digital |
Mastocitosis sistémica |
-Negativo: mutación D816V -Positivo: mutación D816V |
(14) (29) |
|
-CD 25+ -CD 2+ -CD 30+ |
Citometría de flujo Inmunohistoquímica |
Mastocitosis sistémica |
-Normal: ausente -SM: presente |
(1) (17) |
|
-Histamina |
Espectrometría de masas Cromatografía |
Mastocitosis sistémica |
-Normal: 20 a 200 ng/ml -SM: sobre los valores referenciales |
(31) |
|
-Exosomas |
Exo Quick-ULTRA |
Mastocitosis sistémica |
-SM: aproximadamente 30x1011 partículas/mL |
(16) (32) |
|
-MicroARN |
Microarrays |
Mastocitosis sistémica |
SM: presencia hsa-miR-451, hsa-miR-503, miRPlus_27560, miRPlus_2843, miRPlus_27564, hsa- miR-583, miRPlus_1795, miRPlus_17890, hsa-miR-663 y hsa-miR-30b |
(11) |
|
-MITF |
Inmunohistoquímica |
-Mastocitosis sistémica |
SM: alta expresión |
(11) |
|
-IL-6 |
ELISA Citometría de flujo |
Gravedad y progresión de SM |
Valor referencial: 1,8 pg/ml SM: sobre valores referenciales |
(33) |
|
-PGF2a -Leucotrieno E4 -N-MH-metil histamina |
Cromatografía líquida Espectrometría de masas |
Seguimiento de SM
|
Valores normales -PGF2a: < 1000 ng/24h (Cr) -N-MH-metil histamina: 30 – 200 ug/g creatinina (Cr) -LTE4: < 104 pg/mg (Cr) Valores en mastocitosis -PGF2a: >3500 ng/24h (Cr) -N-MH-metil histamina: >400 ug/g (Cr) -LTE4: sobre los valores referenciales. |
(15)
|
|
-LBP - PDGFRβ -CXCL7 - TGF-β1 |
Espectrometría de masas ELISA |
Mastocitosis sistémica |
Valores normales aproximado -LBP: 1ug/ml -TGF-β1: 2ng/ml -CXCL7: 500 ng/ml - PDGFRβ: 1 ng/ml Valores en SM -LBP: 4ug/ml -TGF-β1: 12ng/ml -CXCL7: 1100 ng/ml - PDGFRβ: 2,2 ng/ml |
(12) |
|
-IgE |
Microarrays de IgE IgE |
Riesgo de anafilaxia Alergia |
Valor referencial de IgE: 0-100 UI/mL adultos 0-85 UI/mL niños Rangos en microarrays: <0,3 ISU, por debajo del límite >0,3 a <1 ISU, bajo ≥1 a <10 ISU, de moderado a alto >10 ISU, muy alto. Mastocitosis: sobre los valores referenciales |
(34) (35) |
Según los resultados mencionados, los biomarcadores se han dividido en dos grupos. En el primero se describen los biomarcadores, usados para el pronóstico de la mastocitosis, como la cuantificación de triptasa sérica basal (BST) ampliamente utilizada en sospecha de SM, ya que aquellos pacientes que tienen valores >20 ng/ml tienen alta probabilidad de desarrollarla. Además, resulta útil en el seguimiento y evaluación de la respuesta al tratamiento de SM.(30) No obstante, Sprinz, indica que la medición de BST sería válida en casos de mastocitosis sin neoplasias hematológicas asociadas (AHN), ya que en presencia de estas patologías se encuentra >200ng/m.(13)
La presencia de HαT, detectada por la expresión del gen α-β triptasa 1 (TPSAB1) en muestras sanguíneas y MO en pacientes con SM por medio de ddPCR, se relaciona con los niveles elevados de BST y con síntomas como prurito, enrojecimiento y problemas gastrointestinales.(13) Además, la sobre-expresión de α-β triptasa 1 permite detectar el riesgo de anafilaxia en estos pacientes.(1)
En el segundo grupo se aborda los biomarcadores para el diagnóstico y seguimiento de mastocitosis; la mutación KIT D816V, desencadenante de la proliferación y supervivencia de los mastocitos, es el biomarcador más importante para el diagnóstico de SM, ya que ha sido identificada mediante técnicas moleculares altamente sensibles como la PCR digital, en más del 91 % de los pacientes con SM, en muestras de MO y sangre periférica.(1,14,29)
Los inmunofenotipos CD25 y/o CD2 identificados en muestras de sangre o MO, por citometría de flujo e inmunohistoquímica están presentes en mastocitos neoplásicos, sin embargo, la expresión de CD2 es variable en SM, mientras que CD25 es más confiable.(17) Además Valent, sugiere a CD30 como nuevo biomarcador al tener una alta expresión en mastocitos neoplásicos en SM.(1)
La medición de histamina es esencial, porque indica la funcionalidad fisiológica y patológica de las células, sus altas concentraciones en suero y MO medidas por cromatografía, se asocia con mayor cantidad de mastocitos y con los síntomas en MC. Sin embargo, estas alteraciones también se presentan en otras enfermedades hematológicas, por lo que no es sensible para el diagnóstico de SM.(31)
Por otro lado, la medición de intercelucinas y proteínas son importantes para el diagnóstico de mastocitosis. Tobio, menciona que, los pacientes con la mutación D816V tienen niveles elevados de IL-6 en sangre y MO, valores que se relacionan con la progresión y gravedad de la enfermedad, indicando así que la IL-6 es esencial para comprender la fisiopatología mastocitaria. Sin embargo, los individuos con neoplasias malignas también presentan niveles altos de IL-6 e indica resultados clínicos desfavorables.(33)
La metil histamina es un mediador pre-almacenado de los mastocitos, mientras que los leucotrienos y prostaglandinas provienen de la síntesis de novo(2) y se encuentran en niveles elevados en SM.(21) Aunque aún no son validados como biomarcadores sanguíneos y urinarios en el diagnóstico, se utilizan para dar seguimiento al tratamiento de SM.(15) Así también, en un análisis proteómico en el plasma de pacientes con SM se identificó concentraciones elevadas de TGF-β1, PDGFRβ, CXCL7 y LBP (tabla 1), sugiriendo a estas variaciones la presencia de disfunción inmune, ya que son proteínas implicadas en respuestas inmunitarias.(12)
Por otro lado, la medición de IgE también es sustancial, ya que los mastocitos suelen activarse por la vía dependiente de IgE, liberando sus mediadores preformados y desencadenando eventos inflamatorios como anafilaxia y shock.(22) Pues, una investigación ha evidenciado que los pacientes con mastocitosis con niveles altos de IgE tienen un mayor riesgo de desarrollar reacciones alérgicas graves.(34)
Las vesículas extracelulares (Evs), contienen componentes característicos de los mastocitos, como triptasa, receptor KIT fosforilado, MRGPRX2 y FcεRI, y se encuentran en concentraciones elevadas en muestras de suero de pacientes con SM (Tabla 1).(16,32) Además, los exosomas presentes en MO en SM contienen microARNs (hsa-miR-451, hsa-miR-503, miRPlus_27560, miRPlus_2843, miRPlus_27564, hsa-miR-583, miRPlus_1795, miRPlus_17890, hsa-miR-663 y hsa-miR-30b), relacionados con el desarrollo y regulación del ciclo celular.(11,32)
Finalmente, MITF es esencial en la función de los mastocitos y está relacionada con la regulación y expresión de KIT. Estudios indicaron que MITF se encuentra altamente expresado en los mastocitos neoplásicos en biopsias de MO de pacientes con SM.(11,26)
CONCLUSIONES
De acuerdo con lo expuesto, se han caracterizado biomarcadores claves en el pronóstico de la mastocitosis. La cuantificación de BTS es esencial para evaluar las formas graves de la enfermedad. El gen TPSAB1 de la HαT, predice SM y su sobre-expresión se relaciona el riesgo de anafilaxia. En cuanto a los biomarcadores utilizados en el diagnóstico y seguimiento de SM, son: la determinación de la mutación KIT D816V, que confirma la SM; la expresión de CD25, CD2, CD30 y de MITF indican la presencia de mastocitos neoplásicos en SM. Para evaluar la progresión y gravedad de la enfermedad se analiza la IL-6, mientras que para identificar el riesgo de anafilaxia se cuantifica la IgE. Los leucotrienos y prostaglandinas contribuyen al seguimiento de SM. La caracterización de los exosomas que contienen KIT fosforilado, IgE, MRGPRX2 y microARNs permiten un diagnóstico preciso de SM. Finalmente, LBP, PDGFRβ, CXCL7, TGF-β1 y la histamina también contribuyen en el diagnóstico de SM.
REFERENCIAS BIBLIOGRAFICAS
1. Valent P, Akin C, Hartmann K, Alvarez-Twose I, Brockow K, Hermine O, et al. Updated Diagnostic Criteria and Classification of Mast Cell Disorders: A Consensus Proposal. HemaSphere [Internet]. 2021 Nov 13 [cited 2024 Feb 2];5(11):E646. Available from: /pmc/articles/PMC8659997/
2. Elieh Ali Komi D, Wöhrl S, Bielory L. Mast Cell Biology at Molecular Level: a Comprehensive Review. Clin Rev Allergy Immunol [Internet]. 2020 Jun 1 [cited 2024 Mar 29];58(3):342–65. Available from: https://link.springer.com/article/10.1007/s12016-019-08769-2
3. Zmorzynski S, Kimicka-Szajwaj A, Szajwaj A, Czerwik-Marcinkowska J, Wojcierowski J. Genetic Changes in Mastocytes and Their Significance in Mast Cell Tumor Prognosis and Treatment. Genes 2024, Vol 15, Page 137 [Internet]. 2024 Jan 22 [cited 2024 Feb 6];15(1):137. Available from: https://www.mdpi.com/2073-4425/15/1/137/htm
4. Krystel-Whittemore M, Dileepan KN, Wood JG. Mast Cell: A Multi-Functional Master Cell. Front Immunol [Internet]. 2016 [cited 2024 Mar 11];6(JAN). Available from: https://pubmed.ncbi.nlm.nih.gov/26779180/
5. Chatterjee A, Ghosh J, Kapur R. Mastocytosis: a mutated KIT receptor induced myeloproliferative disorder. Oncotarget [Internet]. 2015 Jul 7 [cited 2024 Mar 13];6(21):18250. Available from: /pmc/articles/PMC4621888/
6. Pyatilova P, Bernstein JA, Aulenbacher F, Borges MS, Dimitrijević S, Hoehn G, et al. The diagnostic workup for systemic mastocytosis differs from consensus recommendations: Results of a worldwide survey. World Allergy Organ J. 2023 Nov 1;16(11):100838. [cited 2024 Feb 22];11. Available from: 10.1016/j.waojou.2023.100838
7. Azaña JM, Torrelo A, Matito A. Update on Mastocytosis (Part 1): Pathophysiology, Clinical Features, and Diagnosis. Actas Dermosifiliogr. 2016 Jan 1;107(1):5–14. [cited 2024 Feb 15];482(1):99–112. Available from: 10.1016/j.ad.2015.09.007
8. Piris-Villaespesa M, Alvarez-Twose I. Systemic Mastocytosis: Following the Tyrosine Kinase Inhibition Roadmap. Front Pharmacol [Internet]. 2020 Apr 14 [cited 2024 Feb 22];11. Available from: /pmc/articles/PMC7171446/
9. Leguit RJ, Wang SA, George TI, Tzankov A, Orazi A. The international consensus classification of mastocytosis and related entities. Virchows Arch [Internet]. 2023 Jan 1 [cited 2024 Feb 15];482(1):99–112. Available from: https://link.springer.com/article/10.1007/s00428-022-03423-3
10. Zanotti R, Tanasi I, Bernardelli A, Orsolini G, Bonadonna P. Bone Marrow Mastocytosis: A Diagnostic Challenge. J Clin Med 2021, Vol 10, Page 1420 [Internet]. 2021 Apr 1 [cited 2024 Apr 7];10(7):1420. Available from: https://www.mdpi.com/2077-0383/10/7/1420/htm
11. Reszka E, Jabłońska E, Wieczorek E, Valent P, Arock M, Nilsson G, et al. Epigenetic Changes in Neoplastic Mast Cells and Potential Impact in Mastocytosis. Int J Mol Sci 2021, Vol 22, Page 2964 [Internet]. 2021 Mar 15 [cited 2024 Mar 15];22(6):2964. Available from: https://www.mdpi.com/1422-0067/22/6/2964/htm
12. Graham RLJ, McMullen AA, Moore G, Dempsey-Hibbert NC, Myers B, Graham C. SWATH-MS identification of CXCL7, LBP, TGFβ1 and PDGFRβ as novel biomarkers in human systemic mastocytosis. Sci Reports 2022 121 [Internet]. 2022 Mar 24 [cited 2024 Mar 19];12(1):1–10. Available from: https://www.nature.com/articles/s41598-022-08345-3
13. Sprinzl B, Greiner G, Uyanik G, Arock M, Haferlach T, Sperr WR, et al. Genetic Regulation of Tryptase Production and Clinical Impact: Hereditary Alpha Tryptasemia, Mastocytosis and Beyond. Int J Mol Sci [Internet]. 2021 Mar 1 [cited 2024 Mar 15];22(5):1–22. Available from: https://pubmed.ncbi.nlm.nih.gov/33671092/
14. Greiner G, Gurbisz M, Ratzinger F, Witzeneder N, Class SV, Eisenwort G, et al. Molecular quantification of tissue disease burden is a new biomarker and independent predictor of survival in mastocytosis. Haematologica [Internet]. 2020 Jan 31 [cited 2024 Feb 26];105(2):366. Available from: /pmc/articles/PMC7012478/
15. Butterfield JH. Nontryptase Urinary and Hematologic Biomarkers of Mast Cell Expansion and Mast Cell Activation: Status 2022. J allergy Clin Immunol Pract [Internet]. 2022 Aug 1 [cited 2024 Mar 25];10(8):1974–84. Available from: https://pubmed.ncbi.nlm.nih.gov/35346887/
16. Shefler I, Salamon P, Mekori YA. Extracellular Vesicles as Emerging Players in Intercellular Communication: Relevance in Mast Cell-Mediated Pathophysiology. Int J Mol Sci [Internet]. 2021 Sep 1 [cited 2024 Mar 25];22(17). Available from: /pmc/articles/PMC8431297/
17. Pardanani A. Systemic mastocytosis in adults: 2021 Update on diagnosis, risk stratification and management. Am J Hematol [Internet]. 2021 Apr 1 [cited 2024 Feb 19];96(4):508–25. Available from: https://onlinelibrary.wiley.com/doi/full/10.1002/ajh.26118
18. Sobiepanek A, Kuryk Ł, Garofalo M, Kumar S, Baran J, Musolf P, et al. The Multifaceted Roles of Mast Cells in Immune Homeostasis, Infections and Cancers. Int J Mol Sci [Internet]. 2022 Feb 1 [cited 2024 Feb 7];23(4). Available from: https://pubmed.ncbi.nlm.nih.gov/35216365/
19. Komi DEA, Rambasek T, Wöhrl S. Mastocytosis: from a Molecular Point of View. Clin Rev Allergy Immunol [Internet]. 2018 Jun 1 [cited 2024 Mar 13];54(3):397. Available from: /pmc/articles/PMC6002427/
20. Pastwińska J, Żelechowska P, Walczak-Drzewiecka A, Brzezińska-Błaszczyk E, Dastych J. The Art of Mast Cell Adhesion. Cells 2020, Vol 9, Page 2664 [Internet]. 2020 Dec 11 [cited 2024 Feb 7];9(12):2664. Available from: https://www.mdpi.com/2073-4409/9/12/2664/htm
21. da Silva EZM, Jamur MC, Oliver C. Mast Cell Function: A New Vision of an Old Cell. J Histochem Cytochem [Internet]. 2014 Oct 11 [cited 2024 Mar 13];62(10):698. Available from: /pmc/articles/PMC4230976/
22. Jackson CW, Pratt CM, Rupprecht CP, Pattanaik D, Krishnaswamy G. Mastocytosis and Mast Cell Activation Disorders: Clearing the Air. Int J Mol Sci 2021, Vol 22, Page 11270 [Internet]. 2021 Oct 19 [cited 2024 Mar 11];22(20):11270. Available from: https://www.mdpi.com/1422-0067/22/20/11270/htm
23. Voisset E, Brenet F, Lopez S, de Sepulveda P. SRC-Family Kinases in Acute Myeloid Leukaemia and Mastocytosis. Cancers 2020, Vol 12, Page 1996 [Internet]. 2020 Jul 21 [cited 2024 Apr 10];12(7):1996. Available from: https://www.mdpi.com/2072-6694/12/7/1996/htm
24. Bibi S, Arslanhan MD, Langenfeld F, Jeanningros S, Cerny-Reiterer S, Hadzijusufovic E, et al. Co-operating STAT5 and AKT signaling pathways in chronic myeloid leukemia and mastocytosis: possible new targets of therapy. Haematologica [Internet]. 2014 Mar 1 [cited 2024 Mar 26];99(3):417–29. Available from: https://haematologica.org/article/view/6957
25. Ainsua-Enrich E, Serrano-Candelas E, Álvarez-Errico D, Picado C, Sayós J, Rivera J, et al. The Adaptor 3BP2 Is Required for KIT Receptor Expression and Human Mast Cell Survival. J Immunol [Internet]. 2015 May 1 [cited 2024 May 7];194(9):4309–18. Available from: https://dx.doi.org/10.4049/jimmunol.1402887
26. Proaño-Pérez E, Ollé L, Guo Y, Aparicio C, Guerrero M, Muñoz-Cano R, et al. MITF Downregulation Induces Death in Human Mast Cell Leukemia Cells and Impairs IgE-Dependent Degranulation. Int J Mol Sci [Internet]. 2023 Feb 1 [cited 2024 Jan 24];24(4):3515. Available from: https://www.mdpi.com/1422-0067/24/4/3515/htm
28. Hartmann K, Escribano L, Grattan C, Brockow K, Carter MC, Alvarez-Twose I, et al. Cutaneous manifestations in patients with mastocytosis: Consensus report of the European Competence Network on Mastocytosis; The American Academy of Allergy, Asthma & Immunology; And the European Academy of Allergology and Clinical Immunology. J Allergy Clin Immunol [Internet]. 2016 Jan 1 [cited 2024 Feb 4];137(1):35–45. Available from: http://www.jacionline.org/article/S0091674915012580/fulltext
29. Navarro-Navarro P, Álvarez-Twose I, Pérez-Pons A, Henriques A, Mayado A, García-Montero AC, et al. KITD816V mutation in blood for the diagnostic screening of systemic mastocytosis and mast cell activation syndromes. Allergy [Internet]. 2023 May 1 [cited 2024 Mar 23];78(5):1347–59. Available from: https://onlinelibrary.wiley.com/doi/full/10.1111/all.15584
30. Valent P, Sperr WR, Sotlar K, Reiter A, Akin C, Gotlib J, et al. The serum tryptase test: an emerging robust biomarker in clinical hematology. Expert Rev Hematol [Internet]. 2014 Oct 1 [cited 2024 Mar 15];7(5):683–90. Available from: https://pubmed.ncbi.nlm.nih.gov/25169217/
31. Janus T, Korbal U, Żukowski M, Lewosiuk A, Koper K, Żukowska A, et al. Histamine and Serotonin Levels in Bone Marrow Stem Cells Niche as Potential Biomarkers of Systemic Mastocytosis and Myeloproliferative Disorders. Stem Cell Rev Reports [Internet]. 2023 Apr 1 [cited 2024 Apr 8];19(3):807. Available from: /pmc/articles/PMC10070308/
32. Kim DK, Cho YE, Komarow HD, Bandara G, Song BJ, Olivera A, et al. Mastocytosis-derived extracellular vesicles exhibit a mast cell signature, transfer KIT to stellate cells, and promote their activation. Proc Natl Acad Sci U S A [Internet]. 2018 Nov 6 [cited 2024 Mar 25];115(45):E10692–701. Available from: /pmc/articles/PMC6233074/
33. Tobío A, Bandara G, Morris DA, Kim DK, O’Connell MP, Komarow HD, et al. Oncogenic D816V-KIT signaling in mast cells causes persistent IL-6 production. Haematologica [Internet]. 2020 [cited 2024 Apr 3];105(1):124. Available from: /pmc/articles/PMC6939509/
34. Smiljkovic D, Kiss R, Lupinek C, Hoermann G, Greiner G, Witzeneder N, et al. Microarray-Based Detection of Allergen-Reactive IgE in Patients with Mastocytosis. J allergy Clin Immunol Pract [Internet]. 2020 Sep 1 [cited 2024 Apr 4];8(8):2761-2768.e16. Available from: https://pubmed.ncbi.nlm.nih.gov/32348913/
35. Pagana KD, Pagana TJ, Pagana TN. Gu a de Pruebas Diagn sticas Y de Laboratorio. 13a ed. Elsevier; 2017.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Viviana Núñez.
Curación de datos: Elizabeth Proaño.
Análisis formal: Elizabeth Proaño.
Adquisición de fondos: Viviana Núñez.
Investigación: Viviana Núñez.
Metodología: Elizabeth Proaño.
Administración del proyecto: Elizabeth Proaño.
Recursos: Viviana Núñez.
Software: Viviana Núñez.
Supervisión: Elizabeth Proaño.
Validación: Elizabeth Proaño.
Visualización: Elizabeth Proaño.
Redacción – borrador original: Viviana Núñez.
Redacción – revisión y edición: Elizabeth Proaño.
MATERIAL SUPLEMENTARIO 1
Fuente: imagen adaptada de Komi(19) y Bibi(24)
MATERIAL SUPLEMENTARIO 2
|
Tabla 2. Diagnóstico de mastocitosis sistémica |
|
|
Criterios |
|
|
Mayores |
≥15 agregados de mastocitos en biopsia de MO. |
|
Menores |
>25 % de CM atípicos en MO y órganos extracutáneos. |
|
Mutación D816V en KIT, en sangre, MO y órganos extracutáneos. |
|
|
Expresión de CD25 en mastocitos con o sin CD2 en muestras de MO, órganos extracutáneos y sangre. |
|
|
Niveles elevados de triptasa sérica total > 20 ng/ml. |
|
|
Hallazgos |
|
|
B |
>30 % infiltraciones mastocitarias en MO y niveles séricos de triptasa >200 ng/ml. |
|
Signos de displasia o mieloproliferación en linajes de mastocitos, pocos criterios para diagnóstico definitivo de neoplasia hematológica asociada, y recuentos sanguíneos normales o ligeramente alterados. |
|
|
Hepatomegalia sin afectación hepática, esplenomegalia palpable sin hiperesplenismo y linfadenopatía en palpación o imágenes. |
|
|
C |
Disfunción de la MO por la infiltración neoplásica de mastocitos, ≥1 citopenia(s) (RAN <1,0 × 109 /L, hemoglobina <10 g/dl y/o recuento de plaquetas <100 × 109 /L). |
|
Hepatomegalia palpable, disfunción hepática, ascitis y/o hipertensión portal. |
|
|
Daño óseo con lesiones osteolíticas, con o sin fracturas patológicas. |
|
|
Fracturas patológicas por osteoporosis no incluyen como hallazgo “C”. |
|
|
Malabsorción con pérdida de peso por infiltrados de mastocitos gastrointestinales. |
|
|
Subclasificación |
|
|
Mastocitosis sistémica indolente |
-Cumple con los criterios de SM -Sin hallazgos “C” ni neoplasia hematológica asociada - <2 hallazgos B |
|
Mastocitosis aislada en médula ósea |
-Similar a ISM -Afectación en MO -Sin afectación de piel -Sin hallazgos B |
|
Mastocitosis sistémica agresiva |
-Cumple con los criterios de SM -Uno o más hallazgos “C” -Sin leucemia de mastocitos |
|
Mastocitosis sistémica con neoplasia hematológica asociada |
-Cumple con los criterios de SM y diferentes criterios de AHN distinta según a la de OMS |
|
Mastocitosis sistémica latente |
-Similar ISM -Dos hallazgos “B” -Sin hallazgos “C” -Alta carga de mastocitos |
|
Leucemia de mastocitos |
- Criterios de SM -Infiltrados difusos de mastocitos atípicos e inmaduros en MO -≥20 % de mastocitos en frotis de aspirado de MO -≥10 % de mastocitos en sangre periférica Variante aleucémica de MCL (<10 % de mastocitos) |
|
Sarcoma de mastocitos |
-Sin detección de SM, citología de alto grado |
El diagnóstico de mastocitosis sistémica se establece cuando se cumple al menos 1 criterio mayor y 1 o 3 criterios menores. Los hallazgos “B” indican SM sin daño en los órganos, mientras que los “C” señalan daños orgánicos inducido por SM, sin que sea causado por neoplasias hematológicas asociadas, infecciones o terapias. También, es importante indicar que en BMM sin hallazgos “B” se refiere a la baja carga de mastocitos. Tanto los criterios como los hallazgos permiten subclasificar la SM. Fuente: Valent(1) Leguit(9) y Pardanani.(17)