REVISIÓN BIBLIOGRÁFICA
Alteraciones hematológicas asociadas a terapia antirretroviral en pacientes infectados por el virus de inmunodeficiencia humana
Hematological alterations associated with antiretroviral therapy in patients with human immunodeficiency virus
Carla María Taimal Sárez1 ![]() *, Esteban Adrián Reiban
Espinoza1
*, Esteban Adrián Reiban
Espinoza1 ![]() *,
Giselle Marina Flores Siranaula1
*,
Giselle Marina Flores Siranaula1 ![]() *,
Paul Alexis Chuquitarco Marín1 *
*,
Paul Alexis Chuquitarco Marín1 * ![]()
1Universidad Católica de Cuenca. Carrera de Medicina-Campus Cuenca. Cuenca, Ecuador.
Citar como: Taimal Sárez CM, Reiban Espinoza EA, Flores Siranaula GM, Chuquitarco Marín PA. Alteraciones hematológicas asociadas a terapia antirretroviral en pacientes infectados por el virus de inmunodeficiencia humana. Salud Cienc. Tecnol. 2022; 2(S1):208. https://doi.org/10.56294/saludcyt2022208
Recibido: 03-12-2022 Revisado: 24-12-2022 Aceptado: 30-12-2022 Publicado: 31-12-2022
Editor: William
Castillo-González ![]()
RESUMEN
Introducción: las alteraciones hematológicas son muy frecuentes y de origen multifactorial, se han relacionado con un aumento en el riesgo de progresión de la patología y morbimortalidad en los pacientes infectados por el virus de inmunodeficiencia humana. A pesar de que existe una amplia variedad de estudios científicos sobre la prevalencia y patogénesis de estas alteraciones en pacientes HIV positivos, son escasos las investigaciones en nuestro medio que informen sobre el efecto positivo o negativo en la administración de medicamentos antirretrovirales.
Objetivo: determinar las principales alteraciones hematológicas asociadas a terapia antirretroviral en pacientes infectados por el virus de inmunodeficiencia humana.
Método: revisión bibliográfica de tipo narrativa. Para la investigación se utilizaron las siguientes bases de datos, como: PubMed, Cochrane y Scopus.
Resultados: la prevalencia de al menos una alteración hematológica fue del 1,1-58,6 % entre los pacientes infectados por HIV que reciben TAR. La citopenia más frecuente fue la anemia seguida de leucopenia y trombocitopenia. Entre los factores de riesgo más significativos, se identificaron pacientes mayores a 50 años, sexo femenino, esquema antirretroviral basado en zidovudina, IMC y recuento de células T CD4 bajo, carga viral elevada, estadio avanzado e infecciones oportunistas.
Conclusiones: la toxicidad de los medicamentos antirretrovirales y las condiciones clínicas del paciente HIV positivo, dan como resultado una hematopoyesis alterada afectando a las tres líneas celulares, los pacientes pueden presentar anemia, leucopenia, trombocitopenia y/o pancitopenia. La falta de vigilancia e identificación de estos trastornos repercute gravemente en la historia natural de la enfermedad en el paciente.
Palabras clave: Anemia; HIV; Leucopenia; Trombocitopenia; Terapia Antirretroviral.
ABSTRACT
Introduction: hematological alterations are very frequent and of multifactorial origin, they have been related to an increased risk of pathology progression and morbimortality in patients infected by the human immunodeficiency virus. Although there is a wide variety of scientific studies on the prevalence and pathogenesis of these alterations in HIV-positive patients, there are few investigations in our environment that report on the positive or negative effect of the administration of antiretroviral drugs.
Objective: to determine the main hematologic alterations associated with antiretroviral therapy in patients infected by the human immunodeficiency virus.
Method: narrative bibliographic review. The following databases were used for the research: PubMed, Cochrane and Scopus.
Results: the prevalence of at least one hematological alteration was 1,1-58,6 % among HIV-infected patients receiving ART. The most frequent cytopenia was anemia followed by leukopenia and thrombocytopenia. Among the most significant risk factors, patients older than 50 years, female sex, zidovudine-based antiretroviral regimen, low BMI and CD4 T-cell count, high viral load, advanced stage and opportunistic infections were identified.
Conclusions: the toxicity of antiretroviral drugs and the clinical conditions of the HIV-positive patient result in altered hematopoiesis affecting all three cell lines, patients may present with anemia, leukopenia, thrombocytopenia and/or pancytopenia. Failure to monitor and identify these disorders has a serious impact on the natural history of the disease in the patient.
Keywords: Anemia; HIV; Leukopenia; Thrombocytopenia; Antiretroviral Therapy.
INTRODUCCIÓN
Hasta el año 2021 a nivel mundial se registró 38,4 millones de personas infectadas con el virus de la inmunodeficiencia humana (VIH). La proporción de casos registrados en los últimos años ha sufrido una meseta gracias a la implementación de la terapia antirretroviral (TAR) de forma masiva. (1)
Los medicamentos antirretrovirales suprimen la replicación viral, con lo que se mantiene niveles bajos de carga viral y un ascenso progresivo de la inmunidad de los pacientes infectados, produciendo que la esperanza de vida de los pacientes portadores del HIV sea casi similar a los pacientes no infectados. Además es necesario recalcar que estos antirretrovirales como toda droga pueden causar efectos adversos que repercuten en las tasas de morbimortalidad de los pacientes infectados con VIH.(2)
La complicación más frecuente de la infección por HIV con terapia antirretroviral son las alteraciones hematológicas, siendo la anemia la más común sobre todo en pacientes en fase profunda de la enfermedad.(3)
La terapia antirretroviral actúa disminuyendo los niveles de citocinas como IL-1, factor de necrosis tumoral (TNF) e interferón, produciendo un deterioro en la respuesta de la eritropoyetina al reducir la concentración de progenitores de médula y colonias eritroides.(4) Como consecuencia de la terapia con zidovudina (ZDV), se ha demostrado el desarrollo de hipoplasia, aplasia y maduración megaloblástica eritroide, esto puede repercutir con bajo peso, recuperación inmune más lenta, baja calidad de vida, hospitalización y muerte.(5)
La trombocitopenia se relaciona con un mayor riesgo de morbimortalidad,(6) los esquemas de TAR con Zidovudina tiene 9 veces más probabilidad de desarrollar trombocitopenia en comparación con otros fármacos, esto se debe a la destrucción tanto de los megacariotipos como de las plaquetas mediante una reacción inmunomediada.(7)
En los últimos años, varios estudios han evaluado la prevalencia de las citopenias y los posibles factores asociados entre los pacientes que reciben terapia antirretroviral; sin embargo, existe una amplia variación en la prevalencia de las anomalías hematológicas, como en el caso de la anemia con rangos desde el 1,3 % al 95 % en distintos entornos clínicos a nivel mundial.(8)
Las posibles explicaciones de estas variaciones pueden ser por los diferentes criterios clínicos que se utilizan, la progresión de la enfermedad y la terapia antirretroviral empleada en cada estudio. Por ejemplo, en Etiopía la prevalencia oscila entre 11,7 %-26,8 % para anemia, 10 % - 85% para leucopenia, y del 7 % - 21 % para trombocitopenia.(9)
En cambio, un estudio realizado en Colombia reportó cifras del 83,3 % para anemia, 50 % para leucopenia y trombocitopenia respectivamente.(10)
La zidovudina, inhibidor de la transcriptasa inversa, forma parte de las 3 combinaciones más utilizadas como tratamiento inicial.(11) Su uso se ha relacionado con la aparición de anemia macrocítica, la evidencia científica reporta que genera un descenso de 1 gramo de hemoglobina durante el primer año de su uso.(3)
MÉTODO
Estudio no experimental, de revisión bibliográfica. Para la investigación se utilizaron los siguientes buscadores académicos, como: Frontiers, SciELO, Pubmed, Elsevier, y Cochrane, delimitando la información publicada desde 2012 a 2022, en los idiomas inglés y español. La búsqueda de estas publicaciones se basó en el empleo de palabras claves y términos MeSH como: VIH, anemia, leucopenia, plaquetas y terapia antirretroviral. De igual forma, se asoció estas palabras mediante la aplicación de operadores booleanos, como: “AND”, “OR” y “NOT”.
RESULTADOS
Luego de la búsqueda de información, los artículos identificados en la base de datos relacionados con el objetivo de estudio fueron 51. La mayoría de los artículos se obtuvieron de la base de datos Pubmed, de los cuales 3 artículos estaban registrados como duplicados. Se seleccionaron 48 artículos para ser evaluados, se excluyeron 20 por no cumplir con los criterios de palabras clave al revisar el título y resumen.
Luego del análisis y situación, 28 artículos fueron revisados en su totalidad, 14 fueron excluidos tras no cumplir los criterios de selección (Figura 1).
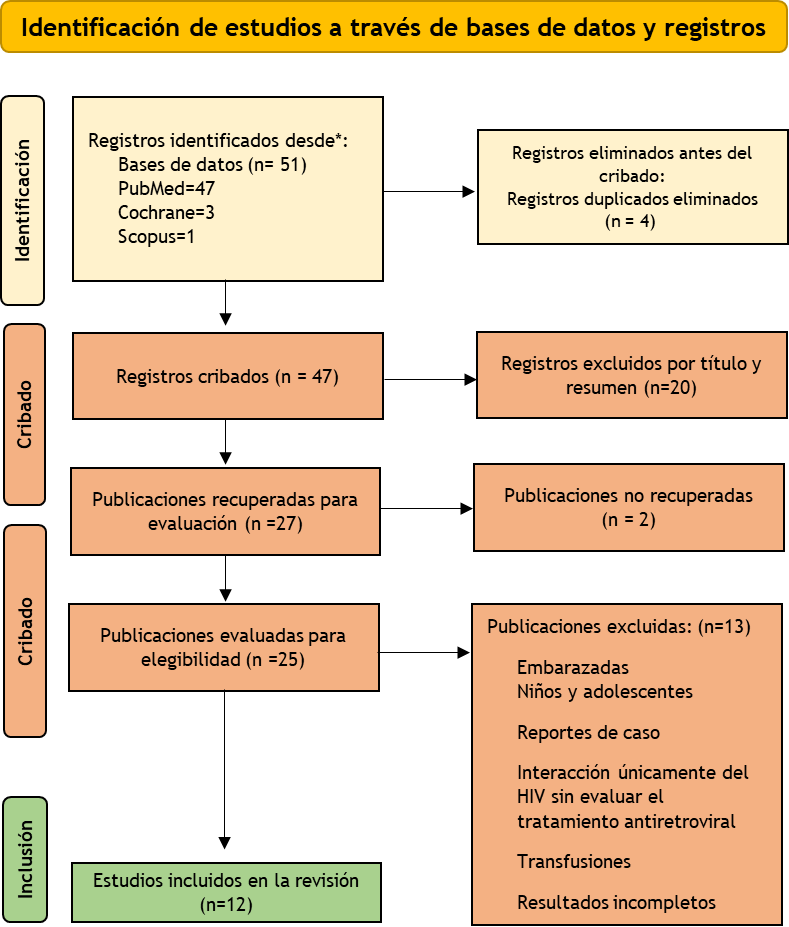
Figura 1. Flujograma de PRISMA para la selección de artículos.
Finalmente, 12 artículos fueron incluidos en la revisión para la elaboración del presente trabajo (Tabla 1).
|
Tabla 1. Principales tipos de citopenias asociadas a pacientes infectados con HIV en tratamiento con antirretrovirales |
||||||
|
Autor, Año, Lugar |
Tipo de estudio |
Muestra |
Antirretrovirales |
Trastornos Hematológicos |
IC 95% |
(%) |
|
Ogar et al.(12) 2019, Nigeria |
Retrospectivo |
11 222 |
Zidovudina, lamivudina, nevirapina |
Anemia |
- |
10 |
|
Khan et al.(13) 2015, Malasia |
Observacional transversal retrospectivo |
997 |
Inhibidores de la transcriptasa inversa nucleósidos (Zidovudina) |
Anemia |
- |
17,4 |
|
Rather et al.(14) 2013, India |
Retrospectivo |
99 |
Régimen: 3TC+NVP+ZDV |
Anemia |
- |
58,7 |
|
Neutropenia |
- |
9,7 |
||||
|
Régimen: 3TC+NVP+d4T |
Anemia |
- |
59,1 |
|||
|
Neutropenia |
- |
12,4 |
||||
|
Zenebe et al.(15) 2018, Etiopía |
Transversal |
422 |
Régimen: TDF-3TC-EFV |
Anemia |
- |
80 |
|
Mengistu et al.(16) 2020, Etiopía |
Transversal |
401 |
Zidovudina |
Anemia |
1,9–7,3 |
- |
|
Leroi et al.(17) 2017, África
|
Cohorte retrospectivo |
9 426 |
Régimen inicial de TAR que contiene ZDV |
Neutropenia grave |
9,5–11,2 |
- |
|
ZDV/3TC/EFV |
10,3–13,1 |
- |
||||
|
ZDV/3TC/NV |
8,7–11,2 |
- |
||||
|
D4T/3TC/EFV |
8,4–12,8 |
- |
||||
|
D4T/3TC/NVP |
7,4–10,5 |
- |
||||
|
Régimen basado en TDF |
4,5–6,8 |
- |
||||
|
Woldeamanuel G.(6) 2018, Etiopía |
Transversal |
176 |
Régimen basado en TDF |
Trombocitopenia |
0,22–3,38 |
4,8 |
|
Régimen basado en AZT |
1 |
7,8 |
||||
En la Tabla 2, se describen en principales factores de riesgo asociados a citopenias en pacientes con HIV en tratamiento con antirretrovirales.
|
Tabla 2. Principales factores de riesgo asociados a citopenias en pacientes con HIV en tratamiento con antirretrovirales |
|||||||
|
Autor, Año, Lugar |
Tipo de estudio |
Muestra |
Variables |
|
OR |
IC 95% |
(%) |
|
Mengistu et al.(16) 2020, Etiopía |
Transversal |
401 |
Sexo |
Femenino |
2.1 |
1.02-4.2 |
- |
|
IMC |
<18,5 kg/m2 |
2,28 |
1,09-4,78 |
- |
|||
|
Terapia antiretroviral |
Con ZDV |
3,71 |
1,9-7,26 |
- |
|||
|
Infecciones oportunistas |
Presente |
5,46 |
1,67-17,7 |
- |
|||
|
Estadío clínico |
Avanzado (III y IV) |
5,71 |
2,68-12,14 |
- |
|||
|
Talargia et al.(18) 2021, Etiopía |
Transversal |
272 |
Sexo |
Masculino |
0.7 |
- |
24,5 |
|
Femenino |
1 |
- |
17,9 |
||||
|
Edad |
>50 años |
1 |
- |
21,6 |
|||
|
Recuento de CD4 de células/μL |
<200 |
0.6 |
- |
23,1 |
|||
|
Régimen de TAR |
Basado en ZDV |
0.4 |
- |
30,2 |
|||
|
Leroi et al.(17) 2017, África |
Cohorte retrospectivo |
9 426 |
Exposición a ZDV |
0-6 meses |
2,15 |
1,81–2,56 |
- |
|
6-12 meses |
2,09 |
1,60–2,72 |
- |
||||
|
>12 meses |
1,62 |
1.18–2.22 |
- |
||||
|
Inicio de TAR entre: |
2009-2011 |
0,73 |
0,60–0,91 |
- |
|||
|
2012-2014 |
0,55 |
0,44–0,69 |
- |
||||
|
Estadio clínico |
Avanzado al inicio de TAR |
1,21 |
1,02–1,44 |
- |
|||
|
Recuento de CD4 de células/μL |
<350 |
1,26 |
1,07–1,49 |
- |
|||
|
Woldeamanuel G.(6) 2018, Etiopía |
Transversal |
176 |
Sexo |
Masculino |
3,45 |
- |
- |
|
Femenino |
1 |
- |
- |
||||
|
Edad |
>50 años |
1 |
- |
- |
|||
|
Régimen de TAR |
Basado en ZDV |
1 |
- |
- |
|||
|
Recuento de CD4 de células/ μL |
<200 |
3,39 |
- |
- |
|||
|
Taiwo et al.(19) 2013 |
Observacional |
3470 |
Sexo |
Femenino |
- |
0,26-2,92 |
- |
|
Raza |
Afroamericana |
- |
0,25-4,52 |
- |
|||
|
Coinfección |
Hepatitis B |
- |
0,09-9,18 |
- |
|||
|
Hipertensión Arterial |
|
- |
0,62-5,59 |
- |
|||
|
Uso de inhibidores de la proteasa reforzados |
|
- |
1,20–2,56 |
- |
|||
|
Régimen de TAR |
Basado en ZDV |
- |
0,24-2,66 |
- |
|||
|
Recuento de CD4 de células/μL |
|
- |
0,54-1,23 |
- |
|||
|
Zenebe et al.(15) 2018, Etiopía |
Transversal |
422 |
Tipo de régimen |
1b, 1a y 1c |
3,45 |
- |
- |
|
1d |
3,1 |
- |
- |
||||
|
1e |
3,4 |
- |
- |
||||
|
INH administrado |
Sí |
1,8 |
- |
- |
|||
|
Infección oportunista |
Sí |
1,99 |
- |
- |
|||
|
Estado funcional |
Postrado en cama |
23,8 |
- |
- |
|||
|
IMC |
Desnutrido |
5,1 |
- |
- |
|||
|
Adherencia |
Buena |
1,8 |
- |
- |
|||
|
Kyeyune et al.(20) 2014, Uganda |
Retrospectivo |
400 |
Sexo |
Femenino |
- |
1,01-1,43 |
- |
|
IMC |
Bajo |
- |
0,52-1,19 |
- |
|||
|
Recuento de CD4 de células/μL |
>350 |
- |
1 |
- |
|||
|
Presencia de candidiasis oral |
Sí |
- |
1,04-1,4 |
- |
|||
|
Régimen de TAR |
Basado en ZDV |
- |
0,68-1,42 |
- |
|||
|
Edad |
>41 años |
- |
0,82-1,24 |
- |
|||
|
Fiebre |
Sí |
- |
0,90-1,21 |
- |
|||
En el estudio acerca de los predictores de la interrupción de la terapia antirretroviral de primera línea debido a eventos adversos relacionados con el medicamento en pacientes infectados por el HIV, demostró que los eventos adversos más representativos fueron los síntomas gastrointestinales (28,5 %), hematológicos (13,2 %) o metabólicos (11,3 %) toxicidades y reacciones de hipersensibilidad (9,3 %). Los fármacos que se asociaron con un mayor riesgo de toxicidad son: zidovudina, estavudina, zalcitabina, didanosina, dosis completa de ritonavir, indinavir y efavirenz, que se recomiendan para los regímenes de primera línea.(21)
En cambio, un estudio retrospectivo de 99 pacientes el efecto adverso más frecuente fue la anemia, que se observó en el 58,6 % de los pacientes. Aunque solo se administró zidovudina al 20 % de los pacientes, se reportó una mayor prevalencia de anemia en el régimen sin zidovudina. Otros factores como la infección oportunista concomitante y la mala calidad de vida podrían estar relacionados con el riesgo de presentar anemia.(14)
En un estudio de cohorte prospectivo de 154 pacientes, la prevalencia de anemia después de dos semanas de terapia antirretroviral fue del 39,2 %. Presentando un descenso de 0,5 g/dl de hemoglobina media desde el inicio hasta el final de la segunda semana de seguimiento. También se experimentó un aumento en los niveles medios de hemoglobina en pacientes que reciben regímenes sin zidovudina y después de un uso a largo plazo de combinaciones de tratamiento exitosas con o sin zidovudina.(22)
DISCUSIÓN
En el año 2015 el Programa Conjunto de las Naciones Unidas sobre el VIH/Sida (ONUSIDA) establece los nuevos Objetivos de Desarrollo Sostenible hacia el 2030, proyectados a que todos los pacientes reciban terapia antirretroviral de alta efectividad, la cual se basa en combinar 2 o 3 fármacos entre los cuales, se tiene al menos 1 inhibidor de la transcriptasa, la mayoría de veces Zidovudina.(9)
Damtie et al.(11) indica que dependientemente de la formulación del fármaco antirretroviral que se utilice, la administración de la terapia antirretroviral puede tener un efecto positivo o negativo sobre los parámetros hematológicos. Si bien muchos medicamentos utilizados para tratar los trastornos relacionados con el HIV son mielosupresores, el uso de zidovudina es la causa más común de citopenia grave.
Las alteraciones hematológicas son manifestaciones frecuentes en los pacientes con infección por HIV, la mayoría de los autores señalan que dentro de las principales anomalías sanguíneas en pacientes con HIV que reciben terapia antirretroviral, la anemia es la más frecuente con una prevalencia que oscila entre 10-58,6 %, seguida de leucopenia con 11,1-32,2 % y trombocitopenia del 5,5-11,1 %.(6,12,13,14,15,16,17,18,20,22)
La incidencia de las diversas citopenias se correlaciona con el grado de inmunosupresión de algunos fármacos antirretrovirales y de anomalías aisladas asociadas al mismo HIV.(23) Varios estudios han demostrado que las alteraciones hematológicas asociadas a la terapia antirretroviral en pacientes retrovirus positivos tienen como órgano diana la médula ósea, además es importante mencionar que estos trastornos no solo están asociados al TAR, también pueden estar presentes debido a mecanismos inmunitarios, infecciones oportunistas con su terapia y del propio virus.(9)
La mayoría de los autores establecen que el sexo femenino, IMC bajo <18 kg/m2, terapia antirretroviral con ZDV, infecciones oportunistas, estadio clínico avanzado III y IV y recuento de CD4 de células/μL <350, son factores de riesgo que incrementan la probabilidad de que el paciente pueda presentar alteraciones hematológicas durante la administración de la terapia.(12,13,14,15,16,17,18,19,20,21,22)
Woldeamanuel et al.(6) encontró una alta prevalencia de estas alteraciones en pacientes de edad avanzada (edad > 50 años), considerándolo como un factor de riesgo de trombocitopenia, esto podría deberse a una mayor incidencia de mielodisplasia en pacientes mayores.
Similar a estos hallazgos, Ngongondo et al.(24) encontró una alta prevalencia de anemia en pacientes que recibían terapia antirretroviral de segunda línea, asociada a factores de riesgo como sexo femenino y un recuento de CD4 <200 células/ul. En cambio, un IMC ≥30 kg/m2 y utilizar TAR durante más de 10 años se relación con un bajo riesgo de presentar anemia.
Zenebe et al.(15) en su estudio realizado en 422 pacientes, comprobó que un gran número de pacientes tenían anemia (34,8 %), la mayoría de ellos presentó anemia moderada. Aquellos pacientes que tenían un estado funcional encamado eran 5,5 veces más anémicos en comparación con los pacientes que realizaban sus actividades de la vida diaria. Además, los pacientes que utilizaron profilaxis con isoniacida (INH) fueron 1,8 veces más anémicos, estableciendo que ambos factores son considerados como determinantes de la anemia. En el caso de la insoniacida, este fármaco provoca una deficiencia de vitB6 produciendo anemia debido a la malabsorción de nutrientes (tabla 1).
Marchionatti et al.(4) y Ezeamama et al.(5) dentro de sus investigaciones determinaron que el desarrollo de anemia macrocítica es inversamente proporcional con la administración de TAR que contiene efavirenz, sugiriendo la presencia de variaciones en el régimen antirretroviral con respecto a la producción de macrocitosis. El estado nutricional del paciente es un factor protector frente a la aparición de macrocitosis. Esta correlación, puede indicar que las diferencias en la calidad nutricional relacionadas con el estado socioeconómico, especialmente, en dietas bajas de vitamina B12 y folato, contribuyen a la presentación de anemia macrocítica.
Lin y Li.(25) establecen que la deficiencia nutricional se puede relacionar también con la anorexia y otros trastornos gastrointestinales ocasionados por los fármacos antirretrovirales. El déficit de vitamina B12 es la alteración más frecuente, y se produce como efecto adverso en las en las proteínas transportadoras de esta vitamina. En cambio, Katemba et al.(26) establecen que la insuficiencia de folatos se presenta en inmunodeficiencias avanzadas, en estados diarreicos y en malabsorción severa.
Khan et al.(13) concuerda con Rather et al.(6) en que los inhibidores de la transcriptasa inversa nucleósidos (INTI) se han relacionado con reacciones de hipersensibilidad, anemia y neutropenia, principalmente la zidovudina, debido a que produce supresión de la médula ósea. Leroi et al.(17) realizo un análisis de cohorte retrospectivo, donde encontró un mayor riesgo de neutropenia grave en pacientes expuestos a ZDV y este riesgo se mantuvo después de un año de tratamiento. Estos resultados son consistentes con el efecto mielosupresor conocido del fármaco (Tabla 1). También se encontró que la inmunodeficiencia avanzada y el estadio clínico avanzado eran factores de riesgo independientes para la neutropenia grave.
En contraste, Denue et al.(27) en su estudio demostró que la infección por HIV produce una alteración de los índices hematológicos independientemente de la edad y el sexo; además, estos trastornos mejoraron con la administración de terapia antirretroviral. Teniendo en cuenta los niveles de inmunosupresión en función de los recuentos de CD4, se demostró que la incidencia de anemia de grados 1 a 4 entre los participantes sin tratamiento previo con TAR con inmunosupresión grave, moderada y leve disminuyó significativamente con el aumento de los niveles de CD4. Aunque la relación lineal entre el nivel de inmunidad y los grados de anemia se perdió en los pacientes que habían recibido TAR, los grados graves (3 y 4) no estuvieron presentes en los pacientes que recibieron TAR como resultado de la disminución en la prevalencia de las infecciones oportunistas y la reconstitución inmunológica.
Woldeamanuel et al.(6) en su estudio demostró que los pacientes en régimen TARV basado en ZDV tienen una mayor prevalencia de trombocitopenia en comparación con el régimen HAART basado en TDF. Sin embargo, la trombocitopenia no mostró diferencia estadísticamente significativa con el tipo de régimen HAART (Tabla 1). La alta prevalencia de trombocitopenia podría deberse a la destrucción mediada por el sistema inmunitario de plaquetas y megacariocitos que se produce en el tratamiento con zidovudina.
Talargia et al.(28) y van der Heijden.(29) concuerdan en que la terapia antirretroviral combinada se asocia a disfunción mitocondrial plaquetaria y reducción en el suministro de energía. Los inhibidores de la transcriptasa inversa análogos de nucleótidos (NRTI), como zidovudina, estavudina, y didanosina, actúan inhibiendo el ADN polimerasa mitocondrial e incrementando el estrés oxidativo, dando como resultado el agotamiento del ADN mitocondrial (ADNmt) y disfunción mitocondrial a nivel tisular. Como la vida media de las plaquetas es corto, esto puede influir en la reducción de la masa mitocondrial durante la trombopoyesis y la toxicidad producida por la zidovudina en la médula ósea todavía esté presente incluso luego de reemplazar los NRTI a tenofovir o abacavir.
Jin et al.(30) en su estudio reporta una alta prevalencia de anemia (39,2 %) entre los pacientes con VIH que reciben terapia antirretroviral de gran actividad. Sin embargo, en este estudio se observaron diferencias significativas en los factores de riesgo de padecer anemia, el más característico es la influencia del sexo donde se encontró que la anemia fue más prevalente entre los pacientes del sexo masculino (81,7 %), mientras que en el sexo femenino fue del 55,6 %. También demostró que la edad avanzada se asocia con un mayor riesgo de padecer anemia. Los datos obtenidos en el estudio estuvieron de acuerdo con la información de otros informes. Un estudio transversal realizado entre 7252 pacientes que recibieron TAR en Estados Unidos expuso que la prevalencia de anemia fue del 35,5 %. De manera similar, los resultados en pacientes hispanos que recibieron TAR mostraron que la prevalencia de anemia fue del 43,4 %.
Sin embargo, varias investigaciones(31,32,33,34) identificaron mayor prevalencia de anemia y nivel medio de hemoglobina más bajo en los participantes VIH positivos sin tratamiento previo con terapia antirretroviral en comparación con los pacientes que si recibían el esquema. Esto se asocia de forma indirecta con la eficacia de la terapia antirretroviral en el descenso de anemia relacionada al VIH, disminuyendo la aparición de infecciones oportunistas, la presencia de anemia de enfermedades crónicas y mejorando el estado nutricional de los pacientes. No obstante, la macrocitosis se presentó con mayor frecuencia (85,7 %) en pacientes que recibieron TAR que en los participantes que sin tratamiento antirretroviral (14,3 %). Por lo que el volumen corpuscular medio (VCM) elevado se podría atribuir al efecto de la zidovudina (ZDV), debido a que la mayoría de los participantes recibían una terapia combinada de ZDV y lamivudina (3TC). Además, consideraron factores de riesgo para anemia como infección oportunista, recuento de CD4 <200 células/µl y residencia rural en pacientes que no recibían tratamiento previamente, a diferencia de los pacientes que se les administró TAR se consideró el tipo y duración de régimen antirretroviral.
Rajesh et al.(35) y Ssali et al.(36) en sus estudios determinaron que la zidovudina incrementa el riesgo de anemia debido a su potencial efecto mielosupresor, como resultado de la alteración en la maduración de los eritrocitos; incremento en el volumen corpuscular medio que demuestra cambios megaloblásticos. Este resultado se presentó hasta un 42,1 % de anemia de grado 4; hemoglobina < 6,5 g/dl durante las primeras semanas o incluso hasta un año después del inicio de zidovudina. En las investigaciones, algunas presentaciones de anemia inducida por zidovudina eran macrocíticas y megaloblásticas; sin embargo, también se observó una anemia normocítica asociada con hipoplasia eritroide o aplasia. En cuanto a los factores de riesgo, Rajesh et al.(35) demostró que no había una asociación significativa entre la edad, el sexo femenino, tabaquismo, índice de masa corporal y recuento de CD4; y el riesgo de presentar anemia.
CONCLUSIONES
Las alteraciones hematológicas están asociadas a la toxicidad de los medicamentos antirretrovirales y a las condiciones clínicas del paciente VIH positivo, dando como resultado una hematopoyesis alterada afectando a las tres líneas celulares, los pacientes pueden presentar anemia, leucopenia, trombocitopenia y/o pancitopenia.
El uso de terapia antirretroviral puede afectar positiva o negativamente sobre los parámetros hematológicos del paciente, dependiendo del esquema utilizado se resolverá las complicaciones provocadas por el mismo VIH, cabe recalcar que la mayoría de medicamentos utilizados para tratar los trastornos relacionados con el virus son mielosupresores, el uso de zidovudina es la causa más común de citopenias graves.
La falta de vigilancia e identificación de estos trastornos repercute gravemente en la historia natural de la enfermedad en el paciente. Aunque, actualmente las dosis relativamente pequeñas de ZDV en combinación con otros antirretrovirales ha disminuido la frecuencia de anemia, en pacientes con VIH avanzado que reciben una dosis menor de 500 mg al día de ZDV presentan una disminución significativa en los niveles de hemoglobina, el volumen corpuscular medio (VCM) aumenta progresivamente con el tiempo, el recuento de glóbulos blancos bajos y el número de plaquetas elevados; sin embargo, la prevalencia de anomalías hematológicas en individuos no tratados está relacionada de manera independiente con la ubicación geográfica, el género y las coinfecciones crónicas como infección por hepatitis B. En consecuencia, los efectos secundarios son una preocupación de salud pública y una importancia inmensa para los responsables de las políticas de salud.
REFERENCIAS BIBLIOGRÁFICAS
1. UNAIDS. Global HIV & AIDS statistics — Fact sheet 2022:6.
2. van Welzen BJ, Oomen PGA, Hoepelman AIM. Dual Antiretroviral Therapy—All Quiet Beneath the Surface? Frontiers in Immunology 2021;12:280. https://doi.org/10.3389/fimmu.2021.637910.
3. Tamir Z, Alemu J, Tsegaye A. Anemia among HIV Infected Individuals Taking ART with and without Zidovudine at Addis Ababa, Ethiopia. Ethiopian Journal of Health Sciences 2018;28:73. https://doi.org/10.4314/EJHS.V28I1.9.
4. Marchionatti A, Parisi MM. Anemia and thrombocytopenia in people living with HIV/AIDS: a narrative literature review. International Health 2021;13:98-109. https://doi.org/10.1093/INTHEALTH/IHAA036.
5. Ezeamama AE, Sikorskii A, Bajwa RK, Tuke R, Kyeyune RB, Fenton JI, et al. Evolution of Anemia Types During Antiretroviral Therapy—Implications for Treatment Outcomes and Quality of Life Among HIV-Infected Adults. Nutrients 2019;11:755. https://doi.org/10.3390/NU11040755.
6. Woldeamanuel GG, Wondimu DH. Prevalence of thrombocytopenia before and after initiation of HAART among HIV infected patients at black lion specialized hospital, Addis Ababa, Ethiopia: A cross sectional study. BMC Hematology 2018;18:1-6. https://doi.org/10.1186/s12878-018-0103-6.
7. Bisetegn H, Ebrahim H. The prevalence of thrombocytopenia and leucopenia among people living with HIV/AIDS in Ethiopia: A systematic review and meta-analysis. PLoS ONE 2021; 16(9):e0257630. https://doi.org/10.1371/JOURNAL.PONE.0257630.
8. Cao G, Wang Y, Wu Y, Jing W, Liu J, Liu M. Prevalence of anemia among people living with HIV: A systematic review and meta-analysis. eClinicalMedicine 2022;44:101283. https://doi.org/10.1016/j.eclinm.2022.101283.
9. Duguma N, Kiya GT, Maleko WA, Bimerew LG. Hematological parameters abnormalities and associated factors in HIV-positive adults before and after highly active antiretroviral treatment in Goba Referral Hospital, southeast Ethiopia: A cross-sectional study. SAGE Open Medicine 2021;9:20503121211020176. https://doi.org/10.1177/20503121211020175.
10. Carvajal Alzate M, Lopez L, Sarmiento J, Ruiz C, Quintero D, Álvarez Hernández L, et al. Compromiso hematológico en pacientes con infección por virus de la inmunodeficiencia humana en un hospital universitario de la ciudad de Medellín, Colombia. Enfermedades Infecciosas y Microbiología 2020;40:130.
11. Damtie S, Workineh L, Kiros T, Eyayu T, Tiruneh T. Hematological Abnormalities of Adult HIV-Infected Patients Before and After Initiation of Highly Active Antiretroviral Treatment at Debre Tabor Comprehensive Specialized Hospital, Northcentral Ethiopia: A Cross-Sectional Study. HIV/AIDS (Auckland, NZ) 2021;13:477. https://doi.org/10.2147/HIV.S308422.
12. Ogar CK, Abiola A, Yuah D, Ibrahim A, Oreagba IA, Amadi EC, et al. A Retrospective Review of Serious Adverse Drug Reaction Reports in the Nigerian VigiFlow Database from September 2004 to December 2016. Pharmaceutical medicine 2019;33:145-57. https://doi.org/10.1007/S40290-019-00267-2.
13. Khan K, Khan AH, Sulaiman SA, Ting Soo C, Akhtar A. Adverse Drug Reactions in HIV/AIDS Patients at a Tertiary Care Hospital in Penang, Malaysia. Japanese journal of infectious diseases 2016;69:56-9. https://doi.org/10.7883/YOKEN.JJID.2014.246.
14. Rather ZA, Chowta MN, Prakash Raju GJK, Mubeen F. Evaluation of the adverse reactions of antiretroviral drug regimens in a tertiary care hospital. Indian journal of pharmacology 2013;45:145-8. https://doi.org/10.4103/0253-7613.108294.
15. Zenebe WA, Anbese AT, Tesfaye TS. Anemia And Associated Factors Among Adult People Living With HIV/AIDS Receiving Anti-Retroviral Therapy At Gedeo Zone, SNNPR, Ethiopia, 2018. HIV/AIDS (Auckland, NZ) 2019;11:351. https://doi.org/10.2147/HIV.S220461.
16. Mengistu A, Egata G, Hawulte B, Markos M, Lolaso T. Anemia and Associated Factors Among Adults with Human Immune Deficiency Virus on Antiretroviral Therapy in Public Health Facilities of Kembata Tembaro Zone, Southern Ethiopia: A Cross-Sectional Study. HIV/AIDS (Auckland, NZ) 2020;12:341. https://doi.org/10.2147/HIV.S259259.
17. Leroi C, Balestre E, Messou E, Minga A, Sawadogo A, Drabo J, et al. Incidence of Severe Neutropenia in HIV-Infected People Starting Antiretroviral Therapy in West Africa. PLoS ONE 2017;12. https://doi.org/10.1371/JOURNAL.PONE.0170753.
18. Talargia F, Teshome Y, Aynalem YA, Asefa A. Prevalence of Leucopenia and Associated Factors before and after Initiation of ART among HIV-Infected Patients, North East Ethiopia: Cross-Sectional Study. Journal of Blood Medicine 2021;12:269. https://doi.org/10.2147/JBM.S306369.
19. Taiwo B, Yanik EL, Napravnik S, Ryscavage P, Koletar SL, Moore R, et al. Evidence for risk stratification when monitoring for toxicities following initiation of combination antiretroviral therapy. AIDS (London, England) 2013;27:1593. https://doi.org/10.1097/QAD.0B013E3283601115.
20. Kyeyune R, Saathoff E, Ezeamama AE, Löscher T, Fawzi W, Guwatudde D. Prevalence and correlates of cytopenias in HIV-infected adults initiating highly active antiretroviral therapy in Uganda. BMC Infectious Diseases 2014;14:496. https://doi.org/10.1186/1471-2334-14-496.
21. Prosperi MCF, Fabbiani M, Fanti I, Zaccarelli M, Colafigli M, Mondi A, et al. Predictors of first-line antiretroviral therapy discontinuation due to drug-related adverse events in HIV-infected patients: a retrospective cohort study. BMC infectious diseases 2012;12:296. https://doi.org/10.1186/1471-2334-12-296.
22. Bekolo CE, Sonkoue C, Djidjou H, Bekoule PS, Kollo B. Evaluating the utility of early laboratory monitoring of antiretroviral-induced haematological and hepatic toxicity in HIV-infected persons in Cameroon. BMC Infectious Diseases 2014;14:519. https://doi.org/10.1186/1471-2334-14-519.
23. Ako SE, Njunda LA, Akum EA, Benjamin PT, Eteneneng EJ, Bernard W, et al. Hematological Related Disorders and Transfusion of HIV Patients on Highly Active Antiretroviral Therapy (HAART) in the South West Region of Cameroon: Hematological Monitory Parameters for HIV Follow-Up. Journal of HIV & Retro Virus 2018;4(1):5. https://doi.org/10.21767/2471-9676.100037.
24. Ngongondo MN, Rosenberg NE, Stanley CC, Lim R, Ongubo D, Broadhurst R, et al. Anemia in people on second line antiretroviral treatment in Lilongwe, Malawi: A cross-sectional study. BMC Infectious Diseases 2018;18:1-8. https://doi.org/10.1186/S12879-018-2952-9/TABLES/3.
25. Lin L, Li TS. Multidisciplinary collaborative integrated management of increasingly prominent HIV complications in the post-cART era. HIV Medicine 2020;21:683-91. https://doi.org/10.1111/HIV.13022.
26. Katemba C, Muzoora C, Muwanguzi E, Mwambi B, Atuhairwe C, Taremwa IM. Hematological abnormalities in HIV-antiretroviral therapy naïve clients as seen at an immune suppression syndrome clinic at Mbarara Regional Referral Hospital, southwestern Uganda. Journal of blood medicine 2018;9:105-10. https://doi.org/10.2147/JBM.S157148.
27. Denue BA, Kida IM, Hammagabdo A, Dayar A, Sahabi MA. Prevalence of Anemia and Immunological Markers in HIV-Infected Patients on Highly Active Antiretroviral Therapy in Northeastern Nigeria. Infectious diseases 2013;6:25-33. https://doi.org/10.4137/IDRT.S10477.
28. Talargia F, Getacher L. Thrombocytopenia and Associated Factors Among HIV Infected Patients in Pre- and Post-Anti-Retroviral Therapy, North East Ethiopia. Journal of Blood Medicine 2021;12:741. https://doi.org/10.2147/JBM.S323086.
29. van der Heijden WA, van de Wijer L, Jaeger M, Grintjes K, Netea MG, Urbanus RT, et al. Long-term treated HIV infection is associated with platelet mitochondrial dysfunction. Scientific Reports 2021;11:1-12. https://doi.org/10.1038/s41598-021-85775-5.
30. Jin Y, Li Q, Meng X, Xu Q, Yuan J, Li Z, et al. Prevalence of anaemia among HIV patients in rural China during the HAART era. International Journal of STD and AIDS 2017;28:63-8. https://doi.org/10.1177/0956462415622866.
31. Gedefaw L, Yemane T, Sahlemariam Z, Yilma D. Anemia and Risk Factors in HAART Naïve and HAART Experienced HIV Positive Persons in South West Ethiopia: A Comparative Study. PLoS ONE 2013;8. https://doi.org/10.1371/JOURNAL.PONE.0072202.
32. Owiredu WKBA, Quaye L, Amidu N, Addai-Mensah O. Prevalence of anaemia and immunological markers among Ghanaian HAART-naïve HIV-patients and those on HAART. African Health Sciences 2011;11:2.
33. Johannessen A, Naman E, Gundersen SG, Bruun JN. Antiretroviral treatment reverses HIV-associated anemia in rural Tanzania. BMC Infectious Diseases 2011;11:190. https://doi.org/10.1186/1471-2334-11-190.
34. Moore RD, Forney D. Anemia in HIV-infected patients receiving highly active antiretroviral therapy. Journal of acquired immune deficiency syndromes (1999) 2002;29:54-7. https://doi.org/10.1097/00042560-200201010-00007.
35. Rajesh R, Vidyasagar S, Varma DM, Mohiuddin S, Noorunnisa. Evaluation of incidence of zidovudine induced anemia in Indian human immunodeficiency virus positive patients in comparison with stavudine based highly active antiretroviral therapy. The International journal of risk & safety in medicine 2011;23:171-80. https://doi.org/10.3233/JRS-2011-0531.
36. Ssali F, Stöhr W, Munderi P, Reid A, Walker AS, Gibb DM, et al. Prevalence, incidence and predictors of severe anaemia with zidovudine-containing regimens in African adults with HIV infection within the DART trial. Antiviral therapy 2006;11:741-9. https://doi.org/10.1177/135965350601100612.
GLOSARIO
VIH: Virus de inmunodeficiencia humana
IMC: Índice de masa corporal
TAR: Terapia antiretroviral
TNF: Factor de necrosis tumoral
IL-1: Interleucina-1
ZDV: Zidovudina
INH: Isoniacida
ONUSIDA: Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA
NRTI: Inhibidores de la transcriptasa inversa análogos de nucleótidos
HAART: Terapia antirretroviral de gran actividad
ADN: Ácido desoxirribonucleico
ADNmt: ADN mitocondrial
TDF: Tenofovir
VCM: Volumen corpuscular medio
3TC: Lamivudina
FINANCIACIÓN
Sin financiación externa
CONCLICTOS DE INTERÉS
No existe conflicto de interés
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Carla María Taimal Sárez, Esteban Adrián Reiban Espinoza, Giselle Marina Flores Siranaula, Paul Alexis Chuquitarco Marín.
Investigación: Carla María Taimal Sárez, Esteban Adrián Reiban Espinoza, Giselle Marina Flores Siranaula, Paul Alexis Chuquitarco Marín.
Metodología: Carla María Taimal Sárez, Esteban Adrián Reiban Espinoza, Giselle Marina Flores Siranaula, Paul Alexis Chuquitarco Marín.
Administración del proyecto: Carla María Taimal Sárez, Esteban Adrián Reiban Espinoza, Giselle Marina Flores Siranaula, Paul Alexis Chuquitarco Marín.
Redacción-borrador original: Carla María Taimal Sárez, Esteban Adrián Reiban Espinoza, Giselle Marina Flores Siranaula, Paul Alexis Chuquitarco Marín.
Redacción, revisión y edición: Carla María Taimal Sárez, Esteban Adrián Reiban Espinoza, Giselle Marina Flores Siranaula, Paul Alexis Chuquitarco Marín.