REVISIÓN BIBLIOGRÁFICA
Update on diagnostic techniques for Amebiasis
Actualización en técnicas diagnósticas de Amebiasis
Kevin Adrián Garcés Curay1 ![]() *, Elena Johanna Pérez Laborde1
*, Elena Johanna Pérez Laborde1 ![]() *
*
1Universidad Técnica de Ambato. Facultad de Ciencias de la Salud. Carrera de Laboratorio Clínico. Ambato, Ecuador.
Citar como: Curay KAG, Laborde EJP. Update on diagnostic techniques for Amebiasis. Salud, Ciencia y Tecnología 2024;4:725. https://doi.org/10.56294/saludcyt2024725.
Enviado: 31-10-2023 Revisado: 12-12-2023 Aceptado: 14-01-2024 Publicado: 15-01-2024
Editor: Dr.
William Castillo-González ![]()
ABSTRACT
Amebiasis is an intestinal infection prevalent throughout the world, with the population of underdeveloped and tropical countries being the most affected. The disease is caused by the genus Entamoeba, Entamoeba histolytica is considered the only pathogenic species for humans, affecting the intestine, lung, brain and liver with the formation of abscesses. The data on the prevalence and incidence of amebiasis are considered to be overestimated, because traditionally the epidemiology of the disease has been studied by direct observation by microscopy, a technique that does not facilitate the differentiation of E. histolytica from other morphologically similar and non-pathogenic amoebas. To identify the real rate of amebiasis infection, techniques and methods have been implemented that moderately increase the diagnostic specificity of amebiasis, such as concentration techniques (Faust and Ritchie), stains, cultures and blood tests; these methods have not been able to resolve this problem public health problem. With the arrival of technology, laboratories have managed to implement techniques that identify microorganisms at a molecular level using techniques such as: Polymerase chain reaction (PCR) or Loop-mediated isothermal amplification (LAMP), whose specificity rate is close to 100%, which they are considered novel techniques whose objective is to update the diagnostic process of amebiasis.
Keywords: Amebiasis; Entamoeba Histolytica; PCR; LAMP; Specificity; Sensitivity.
RESUMEN
La amebiasis es una infección intestinal prevalente en todo el mundo, siendo la población de países subdesarrollados y tropicales los más afectados. La enfermedad es provocada por el género Entamoeba, se considera a Entamoeba histolytica la única especie patógena para el ser humano, afectando el intestino, pulmón, cerebro e hígado con la formación de abscesos. Se consideran que los datos de prevalencia e incidencia de amebiasis están sobreestimados, debido a que tradicionalmente la epidemiología de la enfermedad se ha estudiado mediante observación directa por microscopía, técnica que no facilita diferenciar a E. histolytica de otras amebas morfológicamente similares y no patógenas. Para identificar la tasa real de infección de amebiasis se han implementado técnicas y métodos que elevan moderadamente la especificidad diagnóstica de amebiasis, como las técnicas de concentración (Faust y Ritchie), tinciones, cultivos y exámenes de sangre, estos métodos no ha logrado resolver esta problemática de salud pública. La llegada de la tecnología los laboratorios han logrado implementar técnicas que identifiquen a microorganismos a nivel molecular utilizando técnicas como: Polymerase chain recation (PCR) o Loop-mediated isothermal amplification (LAMP), cuya tasa de especificidad están cerca al 100%, las cuales son consideradas como técnicas novedosas cuyo objetivo es actualizar el proceso diagnóstico de amebiasis.
Palabras clave: Amebiasis; Entamoeba Histolytica; PCR; LAMP; Especificidad; Sensibilidad.
INTRODUCCIÓN
La parasitosis intestinal representa un problema de salud pública a pesar de los grandes avances en temas de salubridad y bienestar.(1,2) La amebiasis es la parasitosis intestinal de mayor prevalencia en el mundo.(1) La Organización Mundial de la Salud (OMS) la define como una infección que afecta el intestino grueso, causado por Entamoeba histolytica,(3) parásito de gran capacidad infectiva que provoca diferentes enfermedades al ser humano como colitis amebiana, disentería amebiana e infiltraciones extraintestinales como abscesos hepáticos.(4,5)
La amebiasis se ubica como la tercera causa de fallecimientos provocados por parásitos a nivel mundial, pero sus datos de prevalencia e incidencia están en estudio, debido a la falta de confiabilidad en los métodos y técnicas diagnósticas empleadas en la observación de amebas.(6,7,8) Por esta razón para los laboratorios de baja y mediana complejidad, la identificación de protozoos intestinales resulta ser una tarea complicada en el ámbito de la parasitología.(1,7)
El género Entamoeba está compuesto por siete especies de amebas que parasitan el intestino humano: E. coli, E. polecki, E. hartmanni, E. dispar, E. moshkovskii, E. bangladesí y E. histolytica, todas son comensales y similares en su morfología y esta última es considerada como patógena para el ser humano y en algunos casos E. polecki ha sido relacionado con cuadros diarreicos.(1)
Cerca de 500 millones de personas se parasitan por la ameba cada año, reflejando una prevalencia mundial del 10 % y se eleva a un 80 % en países endémicos.(4,5,9) Se considera al continente africano como la región más afectada por la infección4,10. Mientras que, en países desarrollados como Europa y Estados Unidos la prevalencia media es del 4 %.(3,4)
En Latinoamérica el 80 % de la población es parasitada por la ameba con mayor prevalencia en zonas rurales y/o marginadas.(3) La Organización Panamericana de la Salud (OPS) declara que en países de América del Sur y América Central E. histolytica representa un comportamiento endémico.(3,4) En Ecuador no existen datos contundentes acerca de la amebiasis.(3) El Ministerio de Salud Pública (MSP) revela que la parasitosis intestinal es la segunda causa más común de atención hospitalaria y en la población infantil representa el 85 % de los casos.(11,12)
El diagnóstico temprano es esencial y se realiza con el análisis de una serie de muestras fecales mediante métodos como: observación microscópica,(7) técnicas de concentración, flotación, uso de medios de cultivo (Robinson), pruebas inmunocromatográficas,(13) análisis serológico(14) y diagnóstico molecular (Polymerase chain recation- PCR y Loop-mediated isothermal amplification-LAMP),(7,15,16,17) siendo esta ultima el método con mayor sensibilidad y especificidad.(7,18,19)
El presente estudio tiene como objetivo actualizar y describir fundamentos de un conjunto de técnicas diagnósticas que garanticen la correcta identificación del género Entamoeba, principales ventajas y desventajas de los métodos tradicionales y moleculares empleados en el diagnóstico diferencial de E. histolytica, aportando un conjunto de técnicas aplicables en los Laboratorios Clínicos.
MÉTODOS
El presente estudio es un artículo de revisión narrativa de la literatura de enfoque documental. Se realizó un estudio bibliográfico donde se recopila, sintetiza y analiza información enfocada en: diagnóstico de amebiasis, comparación de la eficiencia de las técnicas tradicionales y moleculares en la identificación de E. histolytica.
La investigación científica se realizó en documentos, libros y artículos originales indexados en bases de datos como Google Académico, PubMed, Elsevier, Scielo y en la biblioteca virtual de la Universidad Técnica de Ambato (UTA), incluyendo combinaciones con las siguientes palabras claves: Entamoeba histolytica/ PCR/ LAMP/ especificidad/ sensibilidad/ molecular diagnosis y molecular techniques, además del uso de operadores como “AND” y “OR”.
Criterios de inclusión
Los documentos seleccionados son artículos científicos en idioma inglés y español, publicados desde el año 2019. Se hace énfasis en investigaciones sistemáticas y originales vinculados al tema de investigación.
Criterios de exclusión
Se excluyeron las investigaciones que no están disponibles en su estructura completa y aquellas donde los datos son insuficientes.
RESULTADOS
Las investigaciones que cumplieron con los requisitos de inclusión definidos previamente son utilizadas para realizar el siguiente cuadro resumen, cuyo objetivo es brindar un panorama general acerca de las técnicas y métodos usados para el diagnóstico de E. histolytica.
|
Tabla 1. Sensibilidad, especificidad, ventajas, desventajas y costos de implementación de métodos y técnicas para el diagnóstico de amebiasis |
||||||
|
Métodos y técnicas para el diagnóstico de amebiasis |
||||||
|
Los métodos directos se basan en el hallazgo, diagnóstico e identificación específica del agente etiológico mediante el uso del microscopio.(7) |
||||||
|
Técnica |
Fundamento |
Sensibilidad |
Especificidad |
Ventajas |
Desventajas |
Costos |
|
Observación directa por microscopía
Suero fisiológico y Lugol |
El estudio directo en fresco es una técnica sencilla de realizar y un diagnóstico eficaz depende de una cuidadosa observación e identificación de estructuras parasitarias.(7) Se mezcla una pequeña cantidad de muestra con una gota de suero fisiológico útil en la identificación de trofozoítos móviles.(7,9) Se prepara una segunda muestra de lectura con yodo Lugol que permite visualizar núcleos e inclusiones de glucógeno.(7) |
35-60 % |
10-50 % |
Económica y de fácil realización.(7) No requiere del uso de equipos de alta gama o costo.(7) |
La pérdida de movilidad de los trofozoítos y la refractilidad de los quistes dificultan la observación de estas estructuras.(7) Es usual confundir los quistes con otros objetos que no son necesariamente parásitos como neutrófilos, macrófagos o con células del epitelio escamoso.(7) |
Equipo: 1000,0USD(7) |
|
Concentración (Faust y Ritchie) Se utilizan cuando el examen de observación directa resulta negativo.(20,21) |
Técnica de Faust Se usa un líquido de alta densidad y los elementos de interés flotaran en este.(21) La modificación de la técnica es más usada, donde se omite la centrifugación de la muestra y en dos fases de sedimentación se obtiene al parásito que se desea estudiar en un medio con sulfato de cinc.(15,21) |
91 % |
83 % |
Método estandarizado y de fácil realización21. Los elementos para identificar se obtienen en un medio limpio que permite examinar la lámina de forma rápida.(21) |
Existen problemas cuando se manipulan muestras con gran contenido de grasas.(21) Es necesario usar una muestra con concentraciones de parásitos conocidos (control positivo).(21) Prolongada exposición con sulfato de cinc puede deformar a los quistes.(21) |
Procedimiento: valor estimado: 1500,0USD(21) |
|
Técnica de Ritchie Permite visualizar quistes de protozoos, el procedimiento brinda un medio limpio libre de grasas que después de centrifugar la muestra, el éter elimina el detritus orgánico y el formol conserva al parásito.(18,21) |
90 % |
70,5 % |
Se usa formaldehído que no deforma a los parásitos.(21) Técnica estandarizada en casi todos los laboratorios.(21) Conserva al parásito para lecturas posteriores.(21) |
La técnica requiere de tiempo para su elaboración.(21) Para depurar correctamente la muestra, el operario debe controlar el tiempo y la velocidad de la centrifugación, un problema en algunos casos.(21) |
||
|
Tinciones |
Tinción de Wheatley Se utilizan muestras fecales frescas o preservadas con alcohol polivinílico (PVA) o con una solución de acetato de sodio-ácido acético.(21) El parásito se tiñe de dos colores representativos.(21,22) Se observa de un color rojo púrpura a los cariosomas, la cromatina nuclear y eritrocitos deglutidos por los trofozoítos y bacterias.(22) Mientras que, el citoplasma de los trofozoítos y quistes fijados se tiñen de un color azul-verdoso. El contraste de colores es útil en el diagnóstico diferencial de cada ameba.(23) |
85 % |
80 % |
Permite distinguir la estructura parasitaria, así que es útil para el diagnóstico de enfermedades intestinales provocadas por protozoos. La fijación de la placa permite conservar al parásito para lecturas posteriores.(23) |
Sustancias oleosas como el aceite de inmersión pueden provocar la aparición de manchas refráctiles.(23) Un uso incorrecto de sustancias fijadoras, además la presencia de medicamentos interfiere con la lectura de protozoos intestinales.(23) Una prolongada exposición de la muestra a los reactivos deforma a los parásitos.(23) |
Insumos-equipo: 1274,0USD(21,22) |
|
Tinción hierro-hematoxilina Se basa en la oxidación de los cristales de hematoxilina que tiñe fuertemente los núcleos de los protozoos.(22,23) Cuando la placa está completamente fijada los quistes de Entamoeba histolytica presentan un citoplasma color gris azulado y los núcleos se tiñen de color negro.(21,22) |
85 % |
85 % |
El alto contraste de estructuras parasitarias permite identificar a cada parásito en diferentes muestras biológicas ya sea en tejidos duros como blandos.(22) Ampliamente utilizada en el área de histología y parasitología.(22) Brinda mayor sensibilidad y especificidad que la tinción de Wheatley.(22) |
El procedimiento es tedioso y complejo, además se requiere de profesionales altamente capacitados.(22) Los reactivos utilizados son costosos y tóxicos y su eliminación se debe realizar de forma cuidadosa, los tintes no funcionan cuando no se fija correctamente la muestra.(22,23) |
Equipos e insumos: 1000,0USD(21,22) |
|
|
Cultivo (medio de Robinson) |
Permite observar colonias puntiformes, aisladas y de color blanco, se realiza un posterior análisis de isoenzimas (hexoquinasa, peptidasa, aldolasa, etc.), estos se basan en patrones electroforéticos.(24) |
>95 % |
>90 % |
El uso combinado del cultivo con el análisis de isoenzimas proporciona confiabilidad en los resultados. (24) |
Para laboratorios de consulta rutinaria se hace imposible implementar este sistema debido a sus altos costos de realización, infraestructura y capacitación de personal.(24) El porcentaje de éxito disminuye a un 50 %, cuando bacterias u hongos compiten por los nutrientes del cultivo esto provoca un sesgo en la selectividad del crecimiento de una especie en particular de ameba.(24) |
Costo promedio de un área de microbiología: 40000,0USD(24)
|
|
Biometría |
En parasitología se hace especial énfasis en determinar la presencia de eosinófilos, cuya elevación es usual en infecciones parasitarias.(1,21,25) |
- |
- |
Técnica estandarizada y económica.(25) |
Es inespecífica para el diagnóstico de cualquier enfermedad.(25) |
Equipo: 7500,0USD(21) |
|
Inmunodiagnóstico |
Las técnicas serológicas (ELISA, inmunocromatográfica, etc.) se basan en el uso de anticuerpos monoclonales que se unen a los factores de virulencia expresados por la ameba como: la lectina Gal/GalNAc o a un antígeno rico en serina.(13) Estas pruebas permiten identificar a personas que fueron infectadas por la E. histolytica.(15) |
100 % |
98 % |
Es un procedimiento estandarizado y ampliamente utilizado.(26) |
Ocurre errores cuando se manejan muestra lipémicas, hemolíticas e ictéricas.(26) Los resultados se alteran cuando las muestras están contaminadas con bacterias u hongos.(26) Es necesario el uso de los analizadores y equipos de un fabricante específico.(26) |
Equipos e insumos: 4500,0USD(15) |
|
|
Enzimoinmunoensayo (EIA) Se basa en el principio de la técnica ELISA.(26) Se usan antígenos, ubicados en los pocillos que se unen con los anticuerpos IgG contra E. histolytica de la muestra y después de un lavado se añade un conjugado de peroxidasa de rábano (HRP) este complejo se tiñe con el sustrato tetrametilbencidina (TMB), la intensidad del producto final es directamente proporcional a la concentración de los anticuerpos presentes en la muestra.(21,26) |
|
|
|
El procedimiento debe ser ejecutado por personal correctamente cualificado y los laboratorios deben contar con muestras conocida (controles).(26) |
|
|
Imágenes |
El diagnóstico por imágenes es usado para el diagnóstico de úlceras o abscesos hepáticos.(16) El estudio de estas lesiones se puede hacer mediante ultrasonidos, resonancia magnética y tomografía computarizada.(5,16,27) |
- |
- |
Se usa ultrasonido para el diagnóstico de abscesos hepáticos que se ubican en el lóbulo derecho del hígado y la tomografía computarizada es útil para diagnosticar colitis amebiana a nivel del colon y recto.(15) |
Los abscesos son secuelas de diversas enfermedades y no esta específicamente relacionados a la amebiasis.(15) |
Equipo: 11900,0USD Depende de la complejidad del ecógrafo(27) |
|
Molecular El uso de técnicas moleculares ha adquirido gran importancia en el diagnóstico de enfermedades infecciosas como la amebiasis.(16,28) La técnica molecular más representativa es la Reacción en cadena de la Polimerasa (PCR) con sus múltiples variantes.(16,19,29) |
PCR convencional Identifica, estudia y amplifica genes representativos de las amebas, entre los más comunes encontramos al gen 18S rRNA (subunidad ribosomal que se encuentra en la ameba), antígeno 30 kDa (subunidad que forma parte de un gran complejo multicatalítico o proteosoma) y el gen HYL 6 (gen de hemolisina presente en amebas patógenas)16,19.(16,19) El ADN se obtiene a partir de muestras fecales como de tejidos.(17) |
99 % |
97 % |
Las técnicas moleculares tienen alta especificidad y sensibilidad para el diagnóstico de cualquier microorganismo, especialmente de virus.(17) Las probabilidades de un resultado falso negativo o falso positivo son bajos.(17) La sensibilidad del test no varía cuando la concentración del parásito es mínima, principal defecto de las técnicas serológicas.(16,31) |
Es una técnica electroforesis-dependiente, así que la contaminación provoca resultados incorrectos.(17) |
Costo anual promedio de insumos, para microorganismos más prevalentes: 87410,67USD(17) Costo promedio de equipos de laboratorio: 88430,00USD(17) |
|
PCR anidada Se utiliza para aumentar la sensibilidad de detección.(16) Se realiza un segundo proceso de PCR, a partir de un fragmento nuclear amplificado previamente.(16,30) La PCR anidad múltiplex, facilita el diagnóstico simultáneo de tres especies de amebas como la E. histolytica, E. dispar y E. moshkovskii.(16,31) |
94 % |
100 % |
La PCR anidada es un proceso tedioso. La PCR anidad multiplex puede arrojar resultados falsos positivos.(16) |
|||
|
|
|
|
|
|||
|
PCR en tiempo real Optimiza el tiempo y la cuantificación se puede realizar con una pequeña cantidad de parásitos y tiene una gran sensibilidad.(16,28) La qPCR multipex es usada para identificar cuatro especies de amebas (E. histolytica, E. dispar, E. bangladeshi y E. moshkovskii), por esta razón se diseñaron cuatro cebadores bajo controles exigentes de calidad para mantener la especificidad diagnóstica.(16,17) |
95 % |
87 % |
Altos costos de operación e infraestructura. Se requiere de personal altamente cualificado.(16) |
|
||
|
LAMP Técnica molecular usada para el diagnóstico de varias enfermedades.(16) LAMP a diferencia de la PCR, es una reacción mediada por varios ciclos de temperatura, le amplificación isotérmica requiere de temperatura constante.(16,29) El gen diana se amplifica a temperatura de 60 a 65 grados centígrados y gracias al uso de tres a cuatro conjuntos de cebadores y una polimerasa con gran actividad replicativa.(29) LAMP detecta E. histolytica mediante la replicación del gen 18S rRNA, siendo su límite de detección de 15 a 50 parásitos.(19,29) |
92 % |
100 % |
Técnica nueva de amplificación de ADN, usada en el ámbito de la investigación y de la medicina.(16) Método potencialmente útil para el diagnóstico de enfermedades infecciosas en países en vías de desarrollo, debido a que no se requiere de equipos sofisticados y costosos como los usados en la PCR.(29) |
No es una técnica versátil.(16) El diseño de los cebadores es una tarea que puede llegar a ser complicada, debido a la alta especificidad de estos.(29) Al ser una técnica relativamente nueva, se requiere de personal capacitado en esta área.(29) |
Costo promedio de equipos de laboratorio, similares al PCR: 70430,00USD(16) |
|
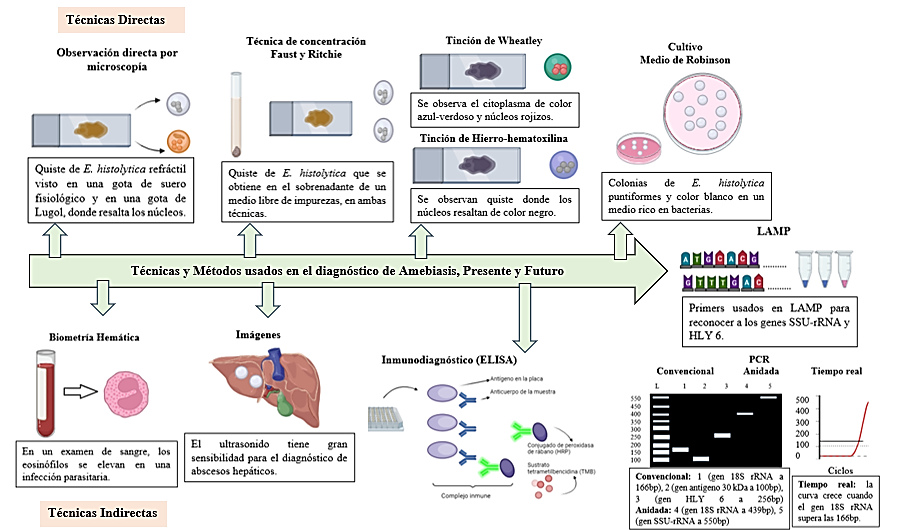
Figura 1. Técnicas y Métodos usados en el diagnóstico de E. histolytica, a lo largo del tiempo
CONCLUSIONES
La observación directa mediante el microscopio es la técnica predilecta para el diagnóstico de parásitos intestinales, pero su baja especificidad impulsó el uso de otras técnicas para un diagnóstico eficaz.
Con el impulso de la tecnología se desarrolló procedimientos innovadores como el inmunodiagnóstico, PCR y LAMP, cuya tasa de especificidad y positividad rozan el 100 %, las cuales son recomendadas para la identificación de E. histolytica.
Es importante reconocer las limitaciones de la microscopía y empezar a reducir su uso y voltear la mirada hacia las técnicas moleculares que son el presente y futuro del diagnóstico de enfermedades infecciosas.
REFERENCIAS BIBLIOGRÁFICAS
1. Singh A, Banerjee T, Khan U, Shukla SK. Epidemiology of clinically relevant entamoeba spp. (E. histolytica/dispar/moshkovskii/bangladeshi): A cross sectional study from North India. PLoS Negl Trop Dis [Internet]. el 1 de septiembre de 2021 [citado el 22 de noviembre de 2023];15(9). Disponible en: https://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0009762
2. Unzaga - J M, Zonta YML, De Ciencias Veterinarias F, Facultad Y, Ciencias DE, Museo NY. PROTOZOOS PARÁSITOS DE IMPORTANCIA SANITARIA [Internet]. el 2 de mayo de 2020 [citado el 20 de noviembre de 2023]. Disponible en: https://www.cdc.gov/dpdx
3. Organización Panamericana de la Salud (OPS). Amebiasis. [Internet]. 2019 [citado el 20 de noviembre de 2023]; Disponible en: https://www3.paho.org/spanish/sha/epibul_95-98/bs971ami.htm
4. Asociación de Médicos de Sanidad Exterior (A.M.S.E). Inf. Epidemiológica [Internet]. 2020 [citado el 22 de noviembre de 2023]. Disponible en: https://www.amse.es/informacion-epidemiologica/133-amebiasis-epidemiologia-y-situacion-mundial?tmpl=component&print=1&page=
5. Salvador Rodríguez M, Guillén Martín S, Díaz-Conradi Á, Fumadó Pérez V, Alegría I, Varo R, et al. Absceso amebiano en la población pediátrica. Revista Latinoamericana de Infectología Pediátrica [Internet]. 2023 [citado el 22 de noviembre de 2023];36(3):110–5 . Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=113205
6. Campos J, Fernández A, Monroy M del C, Partida A. Métodos para la detección de Blastocystis spp, Entamoeba histolytica, Giardia lamblia, y Cryptosporidium spp en muestras de agua y materia fecal [Internet]. 2022 [citado el 12 de noviembre de 2023]. Disponible en: https://sociedadesruralesojs.xoc.uam.mx/index.php/srpma/article/view/463
7. Sante Fernández L, Capón González P, Moreno Flores A, Coira Marín P, Alonso García P. Microscopy vs. molecular biology in the diagnosis of intestinal protozoal infections, is it time for a change? Revista Espanola de Quimioterapia [Internet]. el 1 de febrero de 2023 [citado el 20 de noviembre de 2023];26(1):88–91. Disponible en: https://europepmc.org/article/pmc/pmc9910676
8. Wesel J, Shuman J, Bastuzel I, Dickerson J, Ingram-Smith C. Encystation of entamoeba histolytica in axenic culture. Microorganisms [Internet]. el 1 de abril de 2021 [citado el 20 de noviembre de 2023];9(4). Disponible en: https://www.mdpi.com/2076-2607/9/4/873
9. Ghosh S, Padalia J, Moonah S. Tissue Destruction Caused by Entamoeba histolytica Parasite: Cell Death, Inflammation, Invasion, and the Gut Microbiome [Internet]. Vol. 6, Current Clinical Microbiology Reports. Springer; 2019 [citado el 10 de noviembre de 2023]. p. 51–7. Disponible en: https://link.springer.com/article/10.1007/s40588-019-0113-6
10. Hemphill A, Müller N, Müller J. Comparative pathobiology of the intestinal protozoan parasites giardia lamblia, entamoeba histolytica, and cryptosporidium parvum [Internet]. Vol. 8, Pathogens. MDPI AG; 2019 [citado el 13 de noviembre de 2023]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31362451/
11. Durán Y, Rivero DR, Quimis Y, García M. Vista de Parasitosis intestinales en el ecuador. Revisión Sistemática | Kasmera [Internet]. 2023 [citado el 11 de noviembre de 2023]. Disponible en: https://produccioncientificaluz.org/index.php/kasmera/article/view/37705/45265
12. Estrada DMJ, Guerrero ACZ, Largo SNV, Guarderas CAV. Amoebic liver abscess: Epidemiological background on a case in Ecuador, 2019. Bol Malariol Salud Ambient [Internet]. 2021 [citado el 25 de noviembre de 2023];61:93–8. Disponible en: http://iaes.edu.ve/iaespro/ojs/index.php/bmsa/article/download/134/306
13. Noordin AR, Yunus MH, Saidin S, Mohamed Z, Corripio IF, Rubio JM, et al. Multi-laboratory evaluation of a lateral flow rapid test for detection of amebic liver. American Journal of Tropical Medicine and Hygiene [Internet]. el 1 de diciembre de 2020 [citado el 17 de noviembre de 2023];103(6):2233–8. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7695048/
14. Uribe-Querol E, Rosales C. Immune response to the enteric parasite entamoeba histolytica [Internet]. Vol. 35, Physiology. American Physiological Society; 2020 [citado el 20 de noviembre de 2023]. p. 244–60. Disponible en: https://journals.physiology.org/doi/full/10.1152/physiol.00038.2019
15. Pablo Padilla-Martínez J, Berenice Sánchez-Ponce A, Peña-Jiménez E, Herrera-Gallardo J, Irazú Olalde-Arriaga L, Berenice Ramírez-Montiel F, et al. VOLUMEN 16 XXVII Verano De la Ciencia Detección molecular de Entamoeba histolytica. 2021 [citado el 20 de noviembre de 2023];16(2395–9797). Disponible en: www.jóvenesenlaciencia.ugto.mx
16. Calle-Pacheco GL, Jiménez-Chunga JA, Vivas-Ruiz DE. Molecular diagnosis of amoebiasis. Bol Med Hosp Infant Mex [Internet]. el 1 de enero de 2022 [citado el 18 de noviembre de 2023];79(1):3–16. Disponible en: https://www.scielo.org.mx/scielo.php?pid=S1665-11462022000100003&script=sci_arttext&tlng=en
17. Bañuelos C, Betanzos A, Javier-Reyna R, Galindo A, Orozco E. Molecular interplays of the Entamoeba histolytica endosomal sorting complexes required for transport during phagocytosis [Internet]. Vol. 12, Frontiers in Cellular and Infection Microbiology. Frontiers Media S.A.; 2022 [citado el 17 de noviembre de 2023]. Disponible en: https://www.frontiersin.org/articles/10.3389/fcimb.2022.855797/full
18. Rivero Z, Villarreal L, Bracho A, Prieto C, Villalobos R. Molecular identification of Entamoeba histolytica, E. dispar y E. moshkovskii in children with diarrhea from Maracaibo, Venezuela. Biomedica [Internet]. 2021 [citado el 21 de noviembre de 2023];41(Supplement1 1):1–28. Disponible en: https://revistabiomedica.org/index.php/biomedica/article/view/5584
19. Ysea MAV, Umaña MC, Fuentes SP, Campos IV, Carmona MC. Standardization of molecular techniques for the detection and characterization of intestinal protozoa and other pathogens in humans. Journal of Venomous Animals and Toxins Including Tropical Diseases [Internet]. 2022 [citado el 18 de noviembre de 2023];28. Disponible en: https://www.scielo.br/j/jvatitd/a/WCytyq6rcrCVZDFJftZk8gn
20. Liempi D, Zulantay I, Apt W, Canals M. Repellent and or acaricide / insecticide effect of natural extracts derived from native and foreign plants on parasitic arthropods. View project Molecular epidemiology of Cryptosporidium parvum isolates View project [Internet]. 2019 [citado el 22 de noviembre de 2023] Disponible en: https://www.researchgate.net/publication/355478956
21. Al-Hilfi AA, Al-Malak MK, Al-Tomah MA. A Prevalence study of Entamoeba spp. In Basrah Province using Different Detection Methods. Baghdad Science Journal [Internet]. el 30 de abril de 2021 [citado el 25 de noviembre de 2023];18(4):1163–72. Disponible en: https://www.iasj.net/iasj/download/e8ae14a2d3694f14
22. Megías M, Molist P, Pombal M. Técnicas. Protocolos y recetas. Hematoxilina de Weigert. Atlas de Histología Vegetal y Animal [Internet]. 2021 [citado el 11 de noviembre de 2023]. Disponible en: https://mmegias.webs.uvigo.es/6-tecnicas/protocolos/s-colorante-hem-weigert.php
23. Universidad de Talca. Tinciones:: Parasitología [Internet]. 2021 [citado el 11 de noviembre de 2023]. Disponible en: https://parasitologia24.webnode.cl/tinciones/
24. Gonçalves AQ, Abellana R, Pereira-da-Silva HD, Santos I, Serra PT, Julião GR, et al. Comparison of the performance of two spontaneous sedimentation techniques for the diagnosis of human intestinal parasites in the absence of a gold standard. Acta Trop [Internet]. marzo de 2014 [citado el 18 de diciembre de 2023];131(1):63–70. Disponible en: https://www.sciencedirect.com/science/article/pii/S0001706X13003495
25. Hemphill A, Müller N, Müller J. Comparative pathobiology of the intestinal protozoan parasites giardia lamblia, entamoeba histolytica, and cryptosporidium parvum [Internet]. Vol. 8, Pathogens. MDPI AG; 2019 [citado el 18 de noviembre de 2023]. Disponible en: https://www.mdpi.com/2076-0817/8/3/116
26. Araujo Inastrilla CR. Data Visualization in the Information Society. Seminars in Medical Writing and Education. 2023;2:25. https://doi.org/10.56294/mw202325
27. Singh A, Banerjee T, Shukla SK, Upadhyay S, Verma A. Creep in nitroimidazole inhibitory concentration among the Entamoeba histolytica isolates causing amoebic liver abscess and screening of andrographolide as a repurposing drug. Sci Rep [Internet]. el 1 de diciembre de 2023 [citado el 19 de noviembre de 2023];13(1). Disponible en: https://www.nature.com/articles/s41598-023-39382-1
28. Pablo Padilla-Martínez J, Berenice Sánchez-Ponce A, Peña-Jiménez E, Herrera-Gallardo J, Irazú Olalde-Arriaga L, Berenice Ramírez-Montiel F, et al. VOLUMEN 16 XXVII Verano De la Ciencia Detección molecular de Entamoeba histolytica. 2021 [citado el 21 de noviembre de 2023]. Disponible en: www.jóvenesenlaciencia.ugto.mx
29. Foo PC, Nurul Najian AB, Muhamad NA, Ahamad M, Mohamed M, Yean Yean C, et al. Loop-mediated isothermal amplification (LAMP) reaction as viable PCR substitute for diagnostic applications: A comparative analysis study of LAMP, conventional PCR, nested PCR (nPCR) and real-time PCR (qPCR) based on Entamoeba histolytica DNA derived from faecal sample. BMC Biotechnol [Internet]. el 22 de junio de 2020 [citado el 14 de noviembre de 2023];20(1). Disponible en: https://link.springer.com/article/10.1186/s12896-020-00629-8
30. Rivero Z, Villarreal L, Bracho A, Prieto C, Villalobos R. Molecular identification of Entamoeba histolytica, E. dispar y E. moshkovskii in children with diarrhea from Maracaibo, Venezuela. Biomedica [Internet]. 2021 [citado el 19 de noviembre de 2023];41(Supplement1 1):1–28. Disponible en: http://www.scielo.org.co/scielo.php?pid=S0120-41572021000500023&script=sci_abstract&tlng=en
31. Bhattacharya S. Episomal and chromosomal DNA replication and recombination in Entamoeba histolytica [Internet]. Vol. 10, Frontiers in Molecular Biosciences. Frontiers Media S.A.; 2023 [citado el 20 de noviembre de 2023]. Disponible en: https://www.frontiersin.org/articles/10.3389/fmolb.2023.1212082/full
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Kevin Adrián Garcés Curay.
Investigación: Kevin Adrián Garcés Curay.
Metodología: Kevin Adrián Garcés Curay.
Redacción – borrador original: Kevin Adrián Garcés Curay.
Redacción – revisión y edición: Kevin Adrián Garcés Curay, Elena Johanna Perez Laborde.