REVISIÓN
Effectiveness of supplemented micronutrients on inflammatory markers in patients infected with covid-19. A systematic review
Efectividad de micronutrientes suplementados sobre marcadores inflamatorios en pacientes contagiados con covid-19. Una revisión sistemática
Valentina Rail1 ![]() *, Nicole Seguel1
*, Nicole Seguel1 ![]() *, Laura Quezada1
*, Laura Quezada1 ![]() *, Miguel Ángel López-Espinoza1
*, Miguel Ángel López-Espinoza1 ![]() *
*
1Carrera de Nutrición y Dietética, Facultad de Ciencias de la Salud, Universidad Adventista de Chile. Chillán, Chile.
Citar como: Rail V, Seguel N, Quezada L, López-Espinoza M. Effectiveness of supplemented micronutrients on inflammatory markers in patients infected with covid-19. A systematic review. Salud, Ciencia y Tecnología. 2024;3:781. https://doi.org/10.56294/saludcyt2024781
Enviado: 05-12-2023 Revisado: 28-02-2024 Aceptado: 30-03-2024 Publicado: 31-03-2024
Editor: Prof.
Dr. William Castillo-González ![]()
ABSTRACT
Introduction: Covid-19 is a recently discovered disease, originating in Wuhan, China at the end of 2019, this virus being responsible for the current pandemic. Due to the spread of the virus, it is of interest to evaluate the available evidence on the role of micronutrient supplementation.
Objective: characterize the effectiveness of supplemented micronutrients on inflammatory markers in Covid-19 patients.
Methods: a systematic review of 3 053 studies was carried out through a search in electronic databases. Studies without variable results, without a comparison group and incomplete information were excluded.
Results: three of which proposed supplementation with vitamin C and D in critically ill patients with Covid-19 were found. Two clinical trials evaluate vitamin D supplementation, showing a decrease in the response variables (interleukin 6, ferritin and CRP), while the third evaluated vitamin C in relation to the admission of patients to the ICU.
Conclusions: with little evidence found, it is not possible to affirm the idea that the micronutrients studied help reduce the concentration of inflammatory markers.
Keywords: Covid-19; Inflammatory markers; Vitamin D; Vitamin C; Interleukin-6; Supplementation; Treatment.
RESUMEN
Introducción: el Covid-19 es una enfermedad recientemente descubierta, originada en Wuhan, China a fines del 2019, siendo este virus responsable de la actual pandemia. Debido a la propagación del virus es de interés evaluar la evidencia disponible sobre el rol de la suplementación de micronutrientes.
Objetivo: caracterizar la efectividad de micronutrientes suplementados sobre marcadores inflamatorios en pacientes con Covid-19.
Métodos: se realizó una revisión sistemática de 3 053 estudios mediante una búsqueda en bases de datos electrónica. Se excluyeron los estudios sin variables resultados, sin grupo de comparación e información incompleta.
Resultados: se encontraron tres de los cuales plantearon suplementación con vitamina C y D en pacientes críticos con Covid-19. Dos ensayos clínicos evaluaron la suplementación con vitamina D, mostrando disminución en las variables de respuesta (interleucina 6, ferritina y PCR), mientras que el tercero evaluó la vitamina C con relación al ingreso de pacientes a la UCI.
Conclusiones: con la escasa evidencia encontrada no es posible afirmar la idea que los micronutrientes estudiados ayudan a disminuir la concentración de marcadores inflamatorios.
Palabras clave: Covid-19; Marcadores Inflamatorios; Vitamina D; Vitamina C; Interleucina-6; Suplementación Tratamiento.
INTRODUCCIÓN
Originado en la ciudad de Wuhan, China en diciembre del 2019, rápidamente se expandió por todo el mundo.(1,2) Esta pandemia es provocada por un tipo de coronavirus que pertenece a la familia coronavidae(3,4) que causan enfermedades como una gripe común hasta cuadros más graves como el Síndrome Respiratorio de Oriente Medio (MERS-CoV)(5) y el Síndrome Respiratorio Agudo Severo (SARS-CoV).(6) Actualmente se conocen cuatro géneros: alfa, beta, gamma y delta, de los cuales los dos primeros pueden infectar al humano. En efecto, el recientemente descubierto Covid-19 pertenece a la beta coronavirus.(7,8) El virus tiene como hábitat las diferentes secreciones mucosas, en donde la principal vía de trasmisión son las gotitas a través de la vía aérea(9) al haber tenido contacto estrecho con un infectante.(10) La propagación de este virus es demasiado rápida por lo que han surgido estrategias para controlar su transmisión a través de la búsqueda activa de casos(11) como el test de saliva, hisopado nasofaríngeo u orofaríngeo, test de detección de anticuerpos (IgG y IgM) y anticuerpos totales (Ab).(12,13)
De acuerdo con los estudios disponibles, el Covid-19 logra infectar a un sujeto uniéndose a la Enzima Convertidora de Angiotensina II (ACE 2), esta enzima es un receptor altamente capacitado para la adherencia del virus produciendo mayor gravedad en la dificultad respiratoria(14,15,16) comprometiendo órganos importantes como corazón, pulmones, intestino y riñón.(17) Hasta el momento no se sabe bien la causa de la hiperinflamación provocada por Covid-19, pero la hipótesis de una mayor carga viral que puede explicar este fenómeno. (18) Una de las consecuencias de Covid-19, es la fibrosis pulmonar asociada a una disfunción pulmonar que resulta ser irreversible,(19,20) y una de las herramientas que es esencial para la detección de la enfermedad es la tomografía computarizada de alta resolución, (21) se dice que un número significativo de pacientes contagiados tendrá este tipo de secuelas.(19)
La terapia de apoyo de suplementos de vitaminas C y D podrían usarse para mitigar la infección por Covid-19.(22) Por ejemplo; un tratamiento intravenoso con altas dosis de vitamina C ha mostrado efectos beneficiosos sobre la sepsis y shock séptico(23,24) la vitamina D juega un papel antiinflamatorio,(25) asiste a la inmunidad y también permite controlar reacciones oxidativas contra Covid-19,(26,27,28) por ende, la administración de vitaminas es beneficiosas para mejorar la inmunidad de los pacientes Covid-19.(29) Por otro lado, se plantea que el Zinc inhibe los pasos de la replicación del Covid-19 dependientes del pH;(30) mientras que el Selenio contribuye a una respuesta inmune y función antioxidante.(31)
Hasta donde sabemos existen revisiones sistemáticas que involucran suplementación de micronutrientes como prevención del Covid-19,(32) sin embargo, hasta donde se pudo buscar no se han encontrado revisiones sistemáticas que abarquen la suplementación de vitamina C y D, Selenio y Zinc durante la exposición al Covid-19. Es por ello que se pretende caracterizar la efectividad de micronutrientes suplementados sobre marcadores inflamatorios en pacientes con Covid-19.
MÉTODOS
Diseño
Revisión sistemática fue basada en ensayos clínicos bajo términos de los ítems de Preferred Reporting Items For Systematic Reviews and Meta-Analyses (PRISMA).(33)
Criterios de elegibilidad
Se estudiaron ensayos clínicos que analizaron a pacientes mayores de 18 años hospitalizados con una duración desde 7 días, con diagnóstico clínico de Covid-19 requirieron apoyo respiratorio invasivo y que tuvieron un riesgo de ser derivados a UCI. Se admitieron ensayos clínicos con enmascaramiento y abiertos. Se incluyeron ensayos clínicos que hayan aplicado suplementación con los siguientes micronutrientes: vitaminas Zinc (μg/dL), Selenio (μg/dL), vitaminas C (μg/dL) y D (μg/dL) para mitigar los síntomas la infección por Covid-19. El grupo de comparación fueron pacientes con similares características de gravedad, pero que se les aplicaron un tratamiento de cuidado intensivo estándar sin la incorporación de los suplementos mencionados anteriormente. Se consideraron ensayos clínicos con un tiempo de intervención mínimo de 7 días y con la variable outcome con el marcador inflamatorio de interleucina-6, ferritina y PCR.
Estrategia de Búsqueda
Se diseñó una estrategia de búsqueda que incluyó a descriptores controlados extraídos de Medical Subject Heading (Mesh) y palabras no controladas con relación al tema. El total de las palabras claves incluidas abarcaron todos los términos de la pregunta de formato de pacientes, intervención, comparación y outcome: PICO disponible en tabla 1. Se utilizaron bases de datos electrónicas: Scopus, PubMed, Web of Science, Cochrane Library y Proquest. Además, se buscó ensayos clínicos en el proceso de diseño o implementación con ClinicalTrials.gov. No se discriminó por idiomas ni antigüedad.
|
Tabla 1. Palabras clave en formato PICO |
||
|
Estrategia |
Palabras claves de uso libre |
Palabras claves controlado por Mesh |
|
Paciente |
“Mechanic ventilation” “Respiratory infection” “Tracheotomy” “Wuhan” “Hospitalized”
|
“Covid-19” “Virus” “Signs” “SARS-CoV-2” “Pathology” “Pandemic” “Inflammation” “Intensive care” “Intensive care unit” “Intubation” “coronaviruses” |
|
Intervención |
“Supplementation” “Redox potential” “Intravenous treatment” “Immunity” “Deficiency” “Cofactor” “Critical nutrient” |
“Disease” “Nutrition” “Micronutrients” “Vitamins” “Vitamin D” “Vitamin C” “Minerals” “Selenium” “Zinc” “Treatment” “Quarantine” “Cholecalciferol” “Ascorbic acid” “Zinc oxide” “Trace elements” |
|
Control |
“Control group” |
“Therapy” |
|
Outcome |
“Inflammatory markers” “Anti-inflammatory activity” “Hyperinflammation” |
“Interleucina-6” “Recovery” “Macrophages” “T cells” “B cells” “Immunity” “Inhibitors” “Chemical analysis of blond” |
Selección de los estudios
Dos revisoras independientes previamente entrenadas (VR y LQ), analizaron el título y el resumen de los ensayos clínico con relación al tema tratado de acuerdo con los criterios de elegibilidad previamente especificados. Estas dos investigadoras clasificaron los ensayos clínicos en una de las siguientes tres categorías: “incluido”, “excluido” o “dudoso”. Los dudosos serán reclasificados “incluido” o “excluido luego de una segunda lectura individual de título y resumen. Una vez concluida esta actividad se abrieron los resultados de ambas evaluadoras y en aquellos casos de diferencias en la calificación una tercera investigadora (NS) ayudó a generar una categorización por consenso. Luego, hubo una segunda revisión a texto completo por las mismas dos revisoras previamente señaladas y se repetirá el modo de selección de los ensayos clínicos elegibles para este estudio. Se aplicó la pauta CONSORT (Consolidated Standards of Reporting Trials) (34) para facilitar la lectura crítica de los ensayos clínicos.
Extracción de los Datos
Las mismas dos revisoras antes descritas extrajeron de los ensayos clínicos seleccionados características del estudio como: a) primer autor y año; b) tipo de estudio, tamaño muestral, características de los participantes (sexo, edad, tiempo de hospitalización, comorbilidad) lugar; c) características en el grupo intervenido y grupo control, tiempo de intervención; d) tamaño de efecto de la intervención. Potenciales desacuerdos en el contenido de las tablas que se instauraron las dos revisoras independientes serán solucionados mediante el consenso con una tercera investigadora (NS).
Calidad de la evidencia para evitar sesgos en los estudios individuales
Cada investigadora de forma individual (VR y LQ) evaluó la presencia de potenciales riesgos de sesgos: selección, realización, detección, desgaste y notificación, a través del análisis de los seis dominios que reporta la colaboración Cochrane:(35) Generación de la secuencia de aleatorización ocultamiento de la secuencia de aleatorización, ciego de los participantes de los investigadores y el personal sanitario, ciego de los evaluadores de desenlaces, perdida del seguimiento de los pacientes y reporte selectivo de desenlace. Aquí se calificó a cada sesgo como: “bajo”, “alto” o “no claro” y potenciales disensos fueron solucionados luego del análisis de las dos versiones con ayuda de una tercera investigadora (NS).
Síntesis de los datos
Se efectuó un resumen cuantitativo de la evidencia, debido a que los estudios que se encontraron no fueron suficientes para comparar las variables de respuesta (con unidades de medida que no se lograron convertir a una sola), del mismo modo planteaban intervenciones diferentes, por lo que realizar un metaanálisis no fue viable para esta revisión sistemática.
RESULTADOS
Resultados de Búsqueda
El proceso de búsqueda de artículos elegibles se presenta en la figura 1. De un total de 3 059 registros identificados, fueron estudiados sus títulos 2 741 y quedaron disponibles para una lectura completa 17 estudios, de los cuales 3 de ellos quedaron incluidos en esta revisión sistemática; sin embargo, se pretendía estudiar otros micronutrientes de interés como el Selenio y Zinc, pero solo se encontraron evidencia para tratamientos orales con vitamina C y D.
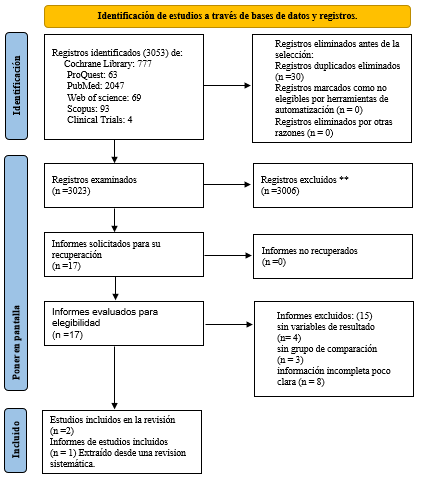
Figura 1. Diagrama de flujo(36)
Características de los estudios incluidos
Las principales características de los estudios incluidos están disponibles en la tabla 1. Los estudios se realizaron en España,(37) India(38) y China.(39) Dos estudios informaron los promedios de edad (en torno a los 50 años) y porcentajes de mujeres (46 % y 34 %, respectivamente) en los grupos asignados,(37,38) mientras que el tercer estudio no informó estos antecedentes(39) (tabla 1).
Las intervenciones aplicadas duraron entre 7(39) y 14 días,(38) sin embargo, Entrenas et al.(37) tuvo un tiempo variable según la evolución clínica de los pacientes.
Tanto Entrenas M. et al.(37) como Lakkireddy M. et al.(38) evaluaron la suplementación con colecalciferol (vitamina D) a través de tratamiento oral con 0,266 mg de colecalciferol en los días 3 y 7;(37) el segundo con tratamiento oral diaria dirigida de 60,000 UI (1,50 mg).(38) Liu F. et al.(39) describió una intervención con vitamina C con una dilución de 12 g de Vitamina C en agua estéril hasta completar un volumen de 50 ml y se infundirán en un plazo de 4 hr por medio de la bomba de infusión (tabla 1).
|
Tabla 1. Características de los estudios incluidos |
|||||
|
Apellido primer autor; año |
Diseño y objetivo |
Participantes |
Intervención |
Tiempo de intervención |
Resultados |
|
Entrenas M; 2020 |
Diseño: Estudio clínico piloto paralelo, aleatorizado, abierto, de doble máscara. Objetivo: evaluar si el colecalciferol puede reducir la necesidad de ingreso a la UCI y la muerte relacionada, como parte anterior del ensayo clínico Covidiol (Prevención y tratamiento con colecalciferol de la enfermedad aguda inducida por coronavirus). síndrome respiratorio (SARS) COVID-19 (COVIDIOL) ”(NCT04366908)) y facilitar el cálculo de la muestra. |
Muestra inicial Intervención:50 Control:26 Edad Media: Intervención: 53,1±10,7 Control: 52,7±9,3 Porcentaje de mujeres: Intervención: 46 % Control: 31 % Porcentaje de hombres: Intervención:54 % Control: 69 % Córdoba, España |
Grupo intervenido: Tratamiento oral con 0,266 mg de colecalciferol en los días 3 y 7, y luego semanalmente hasta el alta o la admisión en la UCI.
Grupo control: Atención estándar una combinación de hidroxicloroquina (400 mg cada 12 h el primer día y 200 mg cada 12 h durante los siguientes 5 días), azitromicina ( 500 mg por vía oral durante 5 días |
Es variable según evolución clínica del paciente. |
Tasa de ingresos en UCI y mortalidad. |
|
Lakkireddy M; 2021 |
Diseño: ensayo clínico intervencionista de asignación paralela, prospectivo, aleatorizado, prospectivo y abierto Objetivo: Investigar objetivamente el papel de la vitamina D y el impacto de la terapia Pulso D en la reducción de los biomarcadores inflamatorios de COVID-19. investigar objetivamente el papel de la vitamina D y el impacto de la terapia Pulso D en la reducción de los biomarcadores inflamatorios de COVID-19. |
Muestra inicial Intervención:44 Control:43 Edad Media: Intervención:47 ± 12 Control:44 ± 14 Porcentaje de mujeres: Intervención: 34,0 % Control: 34,8 % Porcentaje de hombres: Intervención: Control: Hyderabad, India |
Grupo intervenido:
Suplementación oral diaria dirigida de 60,000 UI (1,50 mg) de vitamina D según el IMC del sujeto y tratamiento estándar para Covid-19.
Grupo control: Tratamiento estándar solo / grupo sin vitamina D. |
14 días |
IL-6 (pg / mL): Disminución del grupo intervenido: 13(2 a 46)**
Disminución del grupo control: 0,5 (-7 a 4)**
PCR (mg/L): Disminución del grupo intervenido: 51 (10 a 113)**
Disminución del grupo control: 5 (-3 a 39)**
Ferritina (ng/mL) Disminución del grupo intervenido: 84 (8 a 268)**
Disminución del grupo control: 11 (11 a 55)**
Los resultados corresponden a mediciones pre-post. |
|
Liu F; 2020 |
Diseño: aleatorizado controlado con placebo y de dos brazos. Objetivo: investigar una nueva terapia potencial para COVID-19 aclarando el efecto de HIVC en el pronóstico de pacientes con COVID-19, especialmente en la función respiratoria evaluada por días sin ventilación. |
Muestra inicial Intervención: no informado Control: no informado Edad Media: Intervención: no informado Control: no informado Porcentaje de mujeres: Intervención: no informado Control: no informado Porcentaje de hombres: Intervención: no informado Control: no informado Wuhan, China |
Grupo intervenido:
Dilución de 12 g de Vitamina C en agua estéril hasta un volumen de 50 ml y se infundirán en un plazo de 4 hrs por medio de la bomba de infusión. Se repite cada 12 hrs. (en total 24 gr de veces por día).
Grupo control: placebo (50 ml de agua esterilizada) se infundirán en un plazo de 4 horas mediante una bomba de infusión. |
7 días |
Los resultados del PCR y Interleucina-6 mostraron un cambio en los biomarcadores inflamatorios, pero no se señala si aumentó o disminuyó
Los autores no informan datos numéricos en el estudio. |
|
* media aritmética ± desviación estándar; ** mediana (rango intercuartil) |
|||||
De los estudios que intervinieron con vitamina D los resultados de IL-6 que evidencia el estudio de Lakkireddy M. et al.(38) demostró una disminución de 13 pg/mL en relación con el pre – post intervención, comparado con el control que solo fue de 0,5 pg/mL. No obstante, a lo anterior, el rango normal para IL-6 es de 17,0 pg/ml. (tabla 1)
Ahora, en el caso de PCR y ferritina, también mostraron disminuciones significativas de p=0,0001 para PCR y p=0,008 para ferritina, en relación con el grupo intervenido versus el grupo control. A su vez los valores normales de PCR <1 mg/dl normal, 1- 10 mg/dl elevación moderada y >10 mg/dl elevación marcada,(40) valores normales en suero de Ferritina en mujeres 30–200 ng/mL y hombres 30–300 ng/mL(41). (tabla 1)
Entrenas M. et al.(37) expuso resultados dirigidos a la tasa de ingresos y mortalidad en la unidad de cuidados intensivos entre los pacientes hospitalizados por Covid-19, demostró que la terapia con vitamina D fue efectiva porque los sujetos con la intervención ninguno falleció, solo 1 sujeto necesitó el ingreso a UCI.
Por último, en el caso de Liu F. et al.(39) menciono de manera cualitativa que sus resultados de PCR e Interleucina-6 mostraron un cambio en los biomarcadores inflamatorios, sin mencionar si estos aumentaron o disminuyeron.
Riesgo de sesgo
Al evaluar los seis dominios de riesgo de sesgos, la figura 2 presenta que 66,6 % de los estudios que entraron a esta RS. Fueron calificados con “bajo” riesgo de sesgo en relación con el dominio de selección, desempeño, detección y reporte, mientras que el 100 % de los estudios tuvo bajo riesgo de sesgo en el dominio de desgaste.
El 33,3 % de los estudios mostró riesgo de sesgo “poco claro” en los dominios de selección y detección. Se obtuvo el mismo porcentaje para el riesgo de sesgo “alto” en los dominios de desempeño y reporte.
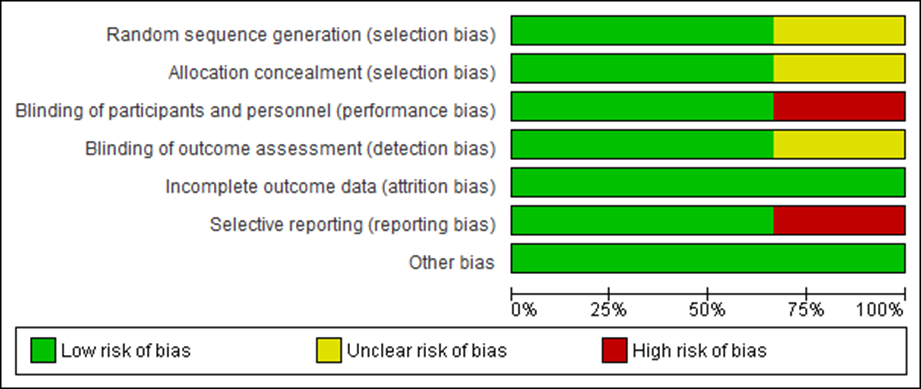
Figura 2. Porcentajes de estudios según clasificación de “alto”, “bajo” o “no claro” riesgo de sesgo
En la figura 3 se indica que los estudios de Liu F. et al.(39) y Entrenas M. et al.(37) presentaron “bajo” riesgo en casi la totalidad de los dominios, exceptuando por el sesgo de reporte que se presentó “alto”, debido a que los resultados obtenidos no tienen un respaldo con evidencia (sólo plantearon un resumen cualitativo de resultados), y el sesgo de detección de Entrenas et al(37) que evidenció un riesgo de sesgo “poco claro”, porque existió una falta de información para discernir si hubo cegamiento en los resultados, respectivamente.
Por otro lado, si bien Lakkireddy M. et al.(38) mostró “bajo” riesgo en el dominio de detección y reporte, se calificó como “alto” el riesgo en el sesgo de desempeño debido a que este estudio no hubo ciego entre los participantes, investigadores ni del personal sanitario. La generación de la secuencia de aleatorización fue evaluada como “poco claro”, debido a que no especificaron si fue centralizado o se utilizó algún otro método equivalente. Aun cuando se tienen estos antecedentes, de igual manera fue incorporado a esta revisión sistemática puesto que contiene resultados de las variables de respuesta estudiadas.

Figura 3. Calificación de riesgo de sesgo evaluado en cada estudio a partir de los seis dominios propuestos por la Colaboración Cochrane
DISCUSIÓN
En primer lugar, se planteó como expectativa analizar y discutir suplementaciones nutricionales de Zinc, Selenio, vitaminas C y D; sin embargo, luego de haber aplicado criterios rigurosos en bases de datos electrónicas de alto alcance solo se encontró evidencia de vitaminas C y D. La novedad de la enfermedad, la ventana de tiempo y la búsqueda de sólo ensayos clínicos (por la calidad de evidencia que aportan) fueron factores que contribuyeron a tal volumen de evidencia. En efecto, una RS anterior a la nuestra publicada en 2021 no logró encontrar artículos que permitieran sustentar la hipótesis que el tratamiento con vitamina C suplementada sobre pacientes con covid-19 tenga o no efectividad.(42)
En relación con la efectividad de la suplementación con Vitamina D sobre IL-6, PCR y ferritina, encontramos un estudio disponible,(38) el cual deja en evidencia que el tratamiento para hipovitaminosis D, la terapia de Pulse D, donde se administran altas dosis de vitamina D 60,000 UI por un periodo de 8 días para aquellos pacientes que tengan un IMC entre los 18,5-25 kg/mt2 y 10 días para aquellos que tengan un IMC>25 kg/mt2 logra disminuir valores de estas tres variables de respuesta. Estos resultados pueden explicarse debido al tiempo y dosis de intervención utilizada, puesto que la recomendación para la población sana (estadounidense) es de 600 UI en menores de 70 años y 800 en mayores de 80 años,(43) por lo tanto se planteó una intervención 100 veces mayor a la dosis diaria recomendada. Por otro lado, la deficiencia de vitamina D, es asociada a mayor riesgo de adquirir Covid-19 debido al papel antinflamatorio e inmunomodulador, favoreciendo la fagocitosis y la acción microbicida, por esto que su deficiencia podría aumentar los valores de los marcadores inflamatorios. (44)
En el caso de Lakkireddy M. et al.(38) en el grupo con Vitamina D requirieron apoyo en cuidados intensivos (UCI) 4 sujetos del grupo de intervención, en cambio en el grupo control ingresaron 5 sujetos; mientras que en el estudio de Entrenas et al(37) demostraron que no hubo necesidad de ingresar pacientes a UCI, a diferencia del grupo control que señaló a 13 sujetos que ingresaron a la UCI. Esto podría deberse a uno de los mecanismos de la vitamina D para potenciar el sistema inmunológico, es la reducción de las citocinas proinflamatorias, moderando la respuesta inmunitaria responsable de neumonías, además se entiende que el Covid-19 provoca un daño a nivel de las células epiteliales propiciando el desarrollo de la neumonía donde hay una mayor producción de citoquinas, entonces se puede decir que al usar vitamina D, está puede disminuir la respuesta inmunitaria.(45)
En cuanto a la vitamina C, se considera un excelente antioxidante con propiedades antimicrobianas y antiinflamatorias, ayudando así a la función inmune para mejorar las infecciones. La evidencia de Lui F. et al.(39) indicó que la vitamina C intravenosa contribuye a una elevada respuesta antiinflamatoria,(46) según Feyaerts AF. et al.(47) podría afirmar que la suplementación con la vitamina C disminuye la IL-6 y bloquea la liberación de esta interleucina, por otro lado, el PCR disminuye la inflamación reduciendo la secreción de citoquinas proinflamatorias;(48) La interacción entre la vitamina C y la ferritina aumentan los niveles de este marcador inflamatorio.(46)
La IL-6 es una citoquina proinflamatoria(49) y multifuncional producida por una variedad de tipos de células, cuyos niveles séricos están elevados en diversos trastornos inflamatorios y autoinmunes.(50) En particular, los niveles de interleucina-6 en sangre (IL-6) están directamente correlacionados con la gravedad de COVID-19 y se han considerado un biomarcador independiente para predecir un mal pronóstico.(51)
La PCR desempeña un papel importante en el proceso inflamatorio, ya que reacciona con receptores de la superficie celular, facilitando la opsonización y fagocitosis(52) su deficiencia facilita el desarrollo de fenómenos de autoinmunidad,(53) además es sabido que el PCR disminuye cuando la infección comienza a desaparecer, ya que tiene una semivida entre 4-9 horas.(54)
Los niveles de ferritina sérica se incrementan en procesos inflamatorios agudos, las citosinas inflamatorias pueden inducir la expresión de ferritina y la ferritina induce la producción de mayores citocinas antiinflamatorias como la IL-10; por lo tanto, la ferritina es un mecanismo inmunosupresor importante, por medio de lo que parece ser una compleja interacción entre ferritina y citocinas en el control de mediadores inflamatorios, antiinflamatorios y marcador en el enfermo grave.(55) Además, la ferritina es un mediador claro de la desregulación inmunológica desencadenando una tormenta de citocinas cuando esta se encuentra elevada(56) ferritina elevada en estos estados refleja un mayor almacenamiento corporal total de hierro, pero estas reservas no están disponibles para la hematopoyesis.(57) La hiperferritinemia(58) iniciada por la inflamación excesiva por la infección se asocia con el ingreso a la unidad de cuidados intensivos y la alta mortalidad, y representa una señal para distinguir a los pacientes de alto riesgo para orientar la intervención terapéutica para el control de la inflamación.(59)
Este estudio no ha estado ajeno a limitaciones. La primera es la escasa cantidad de artículos disponibles, lo que dificulta la preparación de una síntesis cuantitativa de datos y el resumen cualitativo de la evidencia, ya que esta dificultad trae consigo la escasa capacidad de contrastar la evidencia con más estudios, sumado a que cada ensayo clínico responde a variables de respuestas diferentes, de modo que no se logró crear un panorama global del problema. No obstante, creemos que este estudio plantea de forma realista la evidencia acumulada con relación a este tema y por tanto permite animar a investigadores iniciar estudios de este tipo para evidenciar la función que ejerce la suplementación en este tipo de pacientes.
CONCLUSIONES
La evidencia que existe aún sigue siendo escasa, pero hasta ahora coincide que la suplementación de vitaminas C y D en pacientes con Covid-19, logran reducir las variables de respuesta (Interleucina-6, PCR y ferritina). Además, se demostró que en uno de los estudios la suplementación con vitamina D, pudo reducir los días UCI de los pacientes. Sin embargo, esta información sigue siendo escasa, por lo que se necesita más de ella para poder reafirmar lo expuesto en esta RS.
REFERENCIAS BIBLIOGRÁFICAS
1. FDA. Fact sheet for healthcare providers G Medical VSMS ECG Patch. 2020;1–36. Consulta el 03 12 2022. Disponible en: https://www.fda.gov/media/138104/download
2. Sant’Ana G, Imoto AM, Amorim FF, Taminato M, Peccin MS, Santana LA, et al. Infection and death in healthcare workers due to COVID-19: a systematic review. ACTA Paul Enferm. 2020;33: eAPE20200107. doi: http://dx.doi.org/10.37689/actaape/2020AO0107
3. Tabatabaeizadeh SA. Airborne transmission of COVID-19 and the role of face mask to prevent it: a systematic review and meta-analysis. Eur J Med Res. 2021;26(1):1. doi: https://doi.org/10.1186/s40001-020-00475-6
4. Siddell SG, Anderson R, Cavanagh D, Fujiwara K, Klenk HD, Macnaughton MR, et al. Coronaviridae 1. 1983;189:181–189.
5. Reina J, Reina N. El coronavirus causante del síndrome respiratorio de Oriente Medio. Med Clin (Barc). 2015;145(12):529-531
6. Monroy-Gómez J, Torres-Fernández O. Effects of severe acute respiratory syndrome (SARS-CoV) and Middle East respiratory syndrome (MERS CoV) coronaviruses on the nervous system. What to expect from SARS-CoV-2? Biomedical. 2020; 40:173–179.
7. Marcillí MI, Fernández AP, Marsillí YI, Drullet DI, Isalgué VMF. Characterization of legal drug use in older adult caregivers who are victims of violence. SCT Proceedings in Interdisciplinary Insights and Innovations 2023;1:13-13. https://doi.org/10.56294/piii202313.
8. Nafis E, Priesemann V, Balling R, Bauer S, Beutels P, Calero A, et al. A look into the future of the COVID-19 pandemic in Europe: an expert consultation. The Lancet Regional Health - Europe, 2021, 8: 100185. doi: https://doi.org/10.1016/j.lanepe.2021.100185
9. Sánchez J, Miranda C, Castillo C, Arellano N, Tixe T. Covid-19: fisiopatología, historia natural y diagnóstico. Revista Eugenio Espejo. 2021; 15 (2): 98-108.
10. Tapia P. M, Méndez M, Seguel W, Robles C, Hurtado S, Ávila R, et al. Prevention in the transmission of Coronavirus-19: how prepared are health personnel in Chile? Rev Med Chil. 2020;148:1589–1597.
11. Chansaenroj J, Yorsaeng R, Posuwan N, Puenpa J, Sudhinaraset N, Chirathaworn C, Poovorawan Y. Detection of SARS-CoV-2-specific antibodies via rapid diagnostic immunoassays in COVID-19 patients. Virol J. 2021;18(1):52. doi: https://doi.org/10.1186/s12985-021-01530-2
12. Caulley L, Shaw J, Corsten M, Hua N, Angel JB, Poliquin G, Whelan J, Antonation K, Johnson-Obaseki S. Salivary testing of COVID-19: evaluation of serological testing following positive salivary results. BMC Infect Dis. 2021 May 4;21(1):410. doi: https://doi.org/10.1186/s12879-021-06108-5
13. Gestoso-Pecellín L, García-Flores Y, González-Quintana P, Marrero-Arencibia JL. Recommendations and use of the different types of tests for detection of infection by SARS-COV-2. Clinical Nursing. 2021;31:S40–48.
14. Lamas-Barreiro JM, Alonso-Suárez M, Fernández-Martín JJ, Saavedra-Alonso JA. Angiotensin II suppression in SARS-CoV-2 infection: a therapeutic approach. Nefrologia. 2020;40:213–216.
15. Kuba K, Imai Y, Rao S, Gao H, Guo F, Guan B, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat Med. 2005;11:875–879.
16. Santos-López G, Cortés-Hernández P, Vallejo-Ruiz V, Reyes-Leyva J. SARS-CoV 2: generalities, origin and advances in treatment. Gac Mexico. 2021;157:88–93.
17. Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417–1418.
18. Ritchie AI, Singanayagam A. Immunosuppression for hyperinflammation in COVID-19: a double-edged sword? Lancet. 2020;395(10230):1111. doi: https://doi.org/10.1016/S0140-6736(20)30691-7
19. Ali RMM, Ghonimy MBI. Post-COVID-19 pneumonia lung fibrosis: a worrisome sequelae in surviving patients. Egypt J Radiol Nucl Med. 2021;52(1):101. doi: https://doi.org/10.1186/s43055-021-00484-3
20. Gómez H, Galbete A, Álvarez Galván B, Caballero García P, Vicaría Fernández I. Residual lesions on chest-Xray after SARS-CoV-2 pneumonia: Identification of risk factors. Med Clin (Barc). 2022 May 13;158(9):418-421.
21. Yasin R, Gomaa AAK, Ghazy T, Hassanein SA, Ibrahem RAL, Khalifa MH. Predicting lung fibrosis in post-COVID-19 patients after discharge with follow-up chest CT findings. Egypt J Radiol Nucl Med. 2021;52(1):118. doi: https://doi.org/10.1186/s43055-021-00495-0
22. Shakoor H, Feehan J, Mikkelsen K, Al Dhaheri AS, Ali HI, Platat C, Ismail LC, Stojanovska L, Apostolopoulos V. Be well: A potential role for vitamin B in COVID-19. Maturitas. 2021 Feb;144:108-111. doi: https://doi.org/10.1016/j.maturitas.2020.08.007
23. Bae M, Kim H. Mini-Review on the Roles of Vitamin C, Vitamin D, and Selenium in the Immune System against COVID-19. Molecules. 2020;25(22):5346. doi: https://doi.org/10.3390/molecules25225346
24. Topal Hançer A, Yilmaz P, Yilmaz M. New coronavirus (2019-nCoV/COVID-19) and vitamin C. Vol. 40, Turkiye Klinikleri J Med Sci. 2020;40(2):260-264.
25. Sassi F, Tamone C, D’amelio P. Vitamin D: Nutrient, hormone, and immunomodulator. Nutrients. 2018;10(11):1656. doi: https://doi.org/10.3390/nu10111656
26. Machuca-Contreras F, Lepez CO, Canova-Barrios C. Influence of virtual reality and augmented reality on mental health. Gamification and Augmented Reality 2024;2:25-25. https://doi.org/10.56294/gr202425.
27. Al-Daghri NM, Amer OE, Alotaibi NH, Aldisi DA, Enani MA, Sheshah E, et al. Vitamin D status of Arab Gulf residents screened for SARS-CoV-2 and its association with COVID-19 infection: a multi-centre case–control study. J Transl Med. 2021;19(1):1–9.
28. Pinheiro MM, Fabbri A, Infante M. Cytokine storm modulation in COVID-19: a proposed role for vitamin D and DPP-4 inhibitor combination therapy (VIDPP-4i). Immunotherapy. 2021;13(9):753-765.
29. Alzaben AS. The potential influence of vitamin a, c, and d and zinc supplements on the severity of covid-19 symptoms and clinical outcomes: An updated review of literature. Curr Res Nutr Food Sci. 2020;8:703–14.
30. Oyagbemi AA, Ajibade TO, Aboua YG, Gbadamosi IT, Adedapo ADA, Aro AO, et al. Potential health benefits of zinc supplementation for the management of COVID-19 pandemic. J Food Biochem. 2021;45:1–12.
31. Zhang HY, Zhang AR, Lu QB, Zhang XA, Zhang ZJ, Guan XG, Che TL, Yang Y, Li H, Liu W, Fang LQ. Association between fatality rate of COVID-19 and selenium deficiency in China. BMC Infect Dis. 2021;21(1):452. doi: https://doi.org/10.1186/s12879-021-06167-8
32. Corrao S, Mallaci Bocchio R, Lo Monaco M, Natoli G, Cavezzi A, Troiani E, Argano C. Does Evidence Exist to Blunt Inflammatory Response by Nutraceutical Supplementation during COVID-19 Pandemic? An Overview of Systematic Reviews of Vitamin D, Vitamin C, Melatonin, and Zinc. Nutrients. 2021;13(4):1261. doi: https://doi.org/10.3390/nu13041261
33. Urrútia G, Bonfill X. Declaración PRISMA: una propuesta para mejorar la publicación de revisiones sistemáticas y metaanálisis. Med Clin (Barc). 2010;135(11):507-511.
34. Needleman I. CONSORT. Consolidated Standards of Reporting Trials. Br Dent J. 1999;186(5):207. doi: https://doi.org/10.1038/sj.bdj.4800065a
35. Centro Cochrane Iberoamericano translators. Cochrane Handbook of Systematic Reviews of Interventions. 2012; version 5.3
36. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: An updated guideline for reporting systematic reviews. BMJ. 2021;372:2021. doi: https://doi.org/10.1136/bmj.n71
37. Entrenas Castillo M, Entrenas Costa LM, Vaquero Barrios JM, Alcalá Díaz JF, López Miranda J, Bouillon R, Quesada Gomez JM. "Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study". J Steroid Biochem Mol Biol. 2020;203:105751. doi: https://doi.org/10.1016/j.jsbmb.2020.105751.
38. Lakkireddy M, Gadiga SG, Malathi RD, Karra ML, Raju ISSVPM, Ragini, Chinapaka S, Baba KSSS, Kandakatla M. Impact of daily high dose oral vitamin D therapy on the inflammatory markers in patients with COVID 19 disease. Sci Rep. 2021;11(1):10641. doi: https://doi.org/10.1038/s41598-021-90189-4
39. Liu F, Zhu Y, Zhang J, Li Y, Peng Z. Intravenous high-dose vitamin C for the treatment of severe COVID-19: study protocol for a multicentre randomised controlled trial. BMJ Open. 2020 Jul 8;10(7):e039519. doi: https://doi.org/10.1136/bmjopen-2020-039519
40. Cuervo MED. Exclusive breastfeeding. Factors that influence its abandonment. AG Multidisciplinar 2023;1:6-6. https://doi.org/10.62486/agmu20236.
41. MSD Manual Professional version. Representative Laboratory Reference Values: Blood, Plasma, and Serum. Consulta el 03 12 2021. Disponible en: https://www.msdmanuals.com/professional/multimedia/table/representative-laboratory-reference-values-blood-plasma-and-serum
42. Baladia E, Pizarro AB, Ortiz-Muñoz L, Rada G. Vitamin C for COVID-19: A living systematic review. Medwave. 2020; 20 (6): e7978. doi: https://doi.org/10.5867/medwave.2020.06.7978
43. Varsavsky M, Rozas Moreno P, Becerra Fernández A, Luque Fernández I, Quesada Gómez JM, Ávila Rubio V, et al. Recomendaciones de vitamina D para la población general. Endocrinol Diabetes y Nutr. 2017;64:7–14.
44. Niño DA, Mora-Plazas M, Poveda E. Vitamin D, its possible effects on immune function and the response to COVID-19: an exploratory systematic review. Rev Nutr Clinic and Metab. 2021;4:73–97.
45. Reyes Pérez RA, Puente Nieto AV, Martínez-Cuazitl A, Montelongo Mercado EA, Rodríguez Tort A. Vitamin D deficiency is a risk factor for mortality in COVID-19 patients. Rev Sanid Milit. 2020;74:106–113
46. Walter O, Vásquez-Bonilla MD, Orozco R, Argueta V, Sierra M, Zambrano L, et al. A review of the main histopathological findings in coronavirus disease 2019. Human Pathology. 2020; 105: 74-83
47. Feyaerts AF, Luyten W. Vitamin C as prophylaxis and adjunctive medical treatment for COVID-19? Nutrition. 2020;79-80:110948. doi: https://doi.org/10.1016/j.nut.2020.110948
48. Villagrán M, Muñoz M, Díaz F, Troncoso C, Celis-Morales C, Mardones L. A current look at vitamin C in health and disease. Rev Chil Nutr. 2019;46:800–808.
49. Goyenechea E, Parra MD, Martínez Hernández JA. Implication of IL-6 and its -174G> C polymorphism in the control of body weight and in the metabolic complications associated with obesity. An Sist Sanit Navar. 2005;28:357–366.
50. Mazzoni A, Salvati L, Maggi L, Capone M, Vanni A, Spinicci M, et al. Impaired immune cell cytotoxicity in severe COVID-19 is IL-6 dependent. J Clin Invest. 2020;130(9):4694–4703.
51. Huang L, Zhao X, Qi Y, Li H, Ye G, Liu Y, et al. Sepsis-associated severe interleukin-6 storm in critical coronavirus disease 2019. Cell Mol Immunol. 2020;17:1092–1094.
52. Alejandro G, Maribel A, Beatriz F, Enrique C. Evaluation of vitamin D, biomarkers of inflammation and cardiovascular risk factors in patients with arterial hypertension. Arch Venez Farmacol and Ter. 2018;37:360–367.
53. Amezcua-Guerra LM, Del Villar RS, Parra RB. C-reactive protein: Cardiovascular aspects of an acute phase protein.Arch Cardiol Mex. 2007;77:58–66.
54. Urquizo Ayala, Guillermo; Arteaga Coarti R. C-reactive protein in the diagnosis and prognosis of infectious diseases in gastric patients. Rev medica la paz. 2017;23:69–73.
55. Brissot P. Hyperferritinemia. Hematologie. 2015;21:139–145.
56. Vargas-Vargas M, Cortés-Rojo C. Ferritin levels and COVID-19. Rev Panam Salud Publica/Pan Am J Public Heal. 2020;44:2019–2020.
57. Arsanios D, Serrano S, Espinel B, Quintero E, Rincón MJ, Bastidas A. Iron deficiency without anemia, more than a laboratory finding. Univ Médica. 2018;59 (4):1–22.
58. Kernan KF, Carcillo JA. Hyperferritinemia and inflammation. Int Immunol. 2017;29:401–409.
59. Cheng L, Li H, Li L, Liu C, Yan S, Chen H, et al. Ferritin in the coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis. J Clin Lab Anal. 2020;34:1–18.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Ninguno.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Valentina Rail, Nicole Seguel, Laura Quezada, Miguel Ángel López-Espinoza.
Investigación: Valentina Rail, Nicole Seguel, Laura Quezada, Miguel Ángel López-Espinoza.
Redacción – borrador original: Valentina Rail, Nicole Seguel, Laura Quezada, Miguel Ángel López-Espinoza.
Redacción – revisión y edición: Valentina Rail, Nicole Seguel, Laura Quezada, Miguel Ángel López-Espinoza.