doi: 10.56294/saludcyt2024768
REVISIÓN
Effectiveness
of the diet low in fermentable carbohydrates as a treatment in adults diagnosed
with irritable bowel syndrome: a Systematic Review.
Efectividad de la dieta
baja en carbohidratos fermentables como tratamiento en adultos diagnosticados
con síndrome del intestino irritable: una Revisión Sistemática
Lidia Díaz1  *,
Ninoska Leiva1
*,
Ninoska Leiva1  *,
María San Martin1
*,
María San Martin1  *,
Gabriela Pedraza1
*,
Gabriela Pedraza1  *
*
1Universidad
Adventista, Ciencias de la salud. Chillán, Chile.
Citar como:
Díaz L, Leiva N, San Martin M, Pedraza G. Effectiveness of the diet low in
fermentable carbohydrates as a treatment in adults diagnosed with irritable
bowel syndrome: A Systematic Review. Salud,
Ciencia y Tecnología. 2024 4:768. https://doi.org/10.56294/saludcyt2024768
Recibido: 20-11-2023 Revisado:
02-03-2024 Aceptado: 07-08-2024 Publicado:
08-08-2024
Editor: Dr.
William Castillo-González 
ABSTRACT
Currently the diet low in
fermentable carbohydrates (FODMAP) is has established itself as a first-line
strategy as a treatment for IBS in adults, so the purpose of this study is to
analyze the effectiveness of the low diet in fermentable carbohydrates, as a
treatment in adult patients diagnosed with IBS. Method: Systematic review
(S.R.) based on randomized clinical trials (ECA) obtained from the databases
Web of Science, PubMed, Cochrane Library, Scopus, EBSCO and Proquest. RCTs that
included adults over 18 were reviewed years and older, both sexes, diagnosed
with irritable bowel syndrome (IBS), who have contemplated a FODMAP restriction
<112 gr/day, compared to a high FODMAP diet, regular diet with healthy
habits. The risk of
bias, according to the Cochrane
collaboration.
Results: five RCTs were found from
Iran, Australia, China and Sweden, where four of them showed changes on the
study variables: pain and distention abdominal, visceral hypersensitivity,
alterations in depositional habits, transit abnormal levels of gas and
vomiting, compared to their respective control groups. Conclusion: the evidence
collected suggests that a low FODMAP diet in adults diagnosed with IBS
significantly reduce the associated classic symptoms, generating decreases on
the study variables, however, it is essential have adequate dietary advice from
a professional nutritionist, to avoid nutritional deficiency and possible side
effects.
Keywords: Irritable
Bowel Syndrome (IBS); FODMAP; Diet; Abdominal Pain and Inflammation of the
Intestine.
RESUMEN
En la actualidad la
dieta baja en carbohidratos fermentables (FODMAP) se ha consolidado como una
estrategia de primera línea como tratamiento ante SII en adultos, por lo que el
propósito de este estudio es analizar la efectividad de la dieta baja en
carbohidratos fermentables, como tratamiento en pacientes adultos diagnosticado
con SII. Método: Revisión sistemática (R.S) basada en ensayos clínicos
aleatorizados (ECAs) obtenidos en las bases de datos Web of Science, PubMed,
Cochrane Library, Scopus, EBSCO y Proquest. Se revisaron ECAs que incluían
adultos mayores de 18 años en adelante, ambos sexos, diagnosticados con
síndrome de intestino irritable (SII), que hayan contemplado una restricción de
FODMAP <112 gr/día, comparado con una dieta alta en FODMAP, dieta
habitual con hábitos saludables. Se evaluó riesgo de sesgo, según colaboración
Cochrane. Resultados: se encontraron cinco ECAs de Irán, Australia, China y
Suecia, donde cuatro de ellos mostraron cambios sobre las variables de estudio:
dolor y distension abdominal, hipersensibilidad visceral, alteraciones en el
hábito deposicional, tránsito anormal de gases y vómitos, comparado con sus
respectivos grupos de control. Conclusión: la evidencia recopilada plantea que
una dieta baja en FODMAP en adultos diagnosticados con SII reduce
significativamente la sintomatología clásica asociada, generando disminuciones
sobre las variables de estudio, sin embargo, es fundamental contar con un
adecuado asesoramiento dietético por parte del profesional nutricionista, para
evitar déficit nutricional y posibles efectos secundarios.
Palabras clave: Síndrome
del Intestino Irritable (SII); FODMAP; Dieta; Dolor
Abdominal e Inflamación del Intestino.
INTRODUCCIÓN
El síndrome del intestino irritable (SII) es un
trastorno gastrointestinal (GI) de tipo crónico(1) con una
prevalencia mundial entre un 5 % % a un 15 % de la población.(2,3,4)
El SII se caracteriza por una serie de alteraciones gastrointestinales como el
dolor y distensión abdominal, hipersensibilidad visceral, alteraciones en el
hábito deposicional, tránsito anormal de gases y vómitos.(5,6) Dicha
sintomatología genera repercusiones incluso en la calidad de vida en pacientes
con SII, afectando el desarrollo de actividades cotidianas, actividades
cotidianas, inclusive su estado de ánimo.(7)
La
patogenia del SII se explica debido a diversos mecanismos que producen la
sintomatología clásica, principalmente anomalías del huésped en la motilidad
gastrointestinal, tales como alteraciones a nivel de intestino delgado y colon,
hiperalgesia visceral, interacciones
cerebro-intestino, malabsorción intestinal e intolerancias dietéticas.(6,8)
Una alternativa
dietoterapéutica recomendada para reducir la sintomatología clásica del SII,
que ha presentado efectos positivos en más de un 70 % de los pacientes, es la
dieta baja en FODMAP (del inglés: fermentable, oligosaccharides, disaccharides,
monosaccharides and polyols), la cual restringe la ingesta de carbohidratos
fermentables, como oligosacáridos, disacáridos, monosacáridos y polioles fermentables.(9,10)
Esta
intervención consta de una restricción por un periodo mínimo de tres semanas de
alimentos altos en FODMAP, seguida de una reintroducción gradual de los
alimentos según tolerancia.(11)
El mecanismo de
acción de la dieta baja en FODMAP se basa en una reducción de la ingesta de los
carbohidratos de cadena corta, pues una ingesta alta (>112 gr/día de FODMAP)
genera una serie de efectos en el tracto gastrointestinal, como una absorción
deficiente en el intestino delgado y una producción importante de gases como
hidrógeno, metano y dióxido de carbono cuando llegan al colon debido a su
fermentación con el microbiota intestinal.(4,7,12)
Las
recomendaciones dietéticas de la dieta baja en FODMAP descritas actualmente en
la literatura, coinciden en que existe una mejoría en la sintomatología clásica
del SII al considerar ciertos factores dietéticos como una disminución en el
consumo de grasa, alcohol, cafeína e incorporar comidas en volumen reducido
pero frecuentes. Sumado a lo anterior es fundamental la reducción de ciertos
alimentos como: lácteos, carbohidratos complejos, fibra soluble, gluten;
además, evitar el consumo de ciertas verduras y frutas como la manzana, sandía,
higos, palta, alcachofa, cebolla, champiñón, pimiento morrón, ajo, coles, entre
otros.(12,13,14)
Sin embargo, a
pesar de los beneficios descritos anteriormente autores como Vakil et al.(15)
Señalan que la evidencia a largo plazo de una dieta baja en FODMAP en el SII es
limitada en calidad y en número de estudios disponibles. Por otro lado, Nybacka
et al.(1) Informa que para obtener resultados positivos se debe
adaptar la dieta baja en FODMAP según las distintas categorizaciones del SII
(SII- con estreñimiento y/o diarrea predominante, SII con alternancia entre
estreñimiento y diarrea y SII No subtipificado), además de contar con el
asesoramiento de un dietista y/o profesional nutricionista como parte
fundamental para obtener efectos positivos.(17)
En base a lo
mencionado anteriormente y debido a la discusión existente en la literatura en
cuanto a la efectividad de la dieta baja en FODMAP cómo tratamiento en usuarios
adultos diagnosticados con SII, convoca realizar una revisión sistemática con
el propósitoorar
la efectividad de este patrón alimentario como una estrategia de primera línea
para la disminución de la sintomatología asociada al SII.
MÉTODO
Diseño De La Intervención
El presente
estudio llevó a cabo una revisión sistemática de ensayos clínicos aleatorizados
(ECAs), basada en el modelo Preferred
Reporting Items for Systematic reviews and Meta Analyses (PRISMA).(18)
Criterios de elegibilidad
Este estudio se
centró en incluir ECAs
de pacientes diagnosticados con síndrome de intestino irritable y con cualquier
subtipificación. Los autores incluyeron ECAs con adultos mayores de 18 años en
adelante y de ambos sexos. La intervención contempló una restricción de FODMAP
<112 gr/día, mientras que el grupo de comparación incluyó una dieta alta en
FODMAP, una dieta habitual con la presencia o no de hábitos saludables. Las
variables de respuesta analizadas fueron extraídas a partir de la escala
analógica visual del dolor (EVA) y de la escala que representa la gravedad de
los síntomas del síndrome del intestino irritable (IBS-SSS). Las variables de
estudio fueron alteraciones gastrointestinales, dolor
y distensión abdominal, hipersensibilidad visceral, alteraciones en el hábito
deposicional, tránsito anormal de gases y vómitos. También fue fundamental
estudiar los efectos secundarios/adversos de la dieta baja en FODMAP (presenta,
no presenta, no declara) tales como pérdida de peso y adherencia insuficiente,
según informó Frieling et al.(19) La búsqueda de términos incluyó SII, FODMAP, dieta, dolor y distensión
abdominal. La duración mínima de la intervención en los estudios
incluidos fue de al menos tres semanas en adelante.
Estrategia de búsqueda
Entre agosto y
septiembre del año 2023, se llevó a cabo una búsqueda con las siguientes
palabras claves de uso libre y controladas (MeSH), sustentado en la estructura
de la pregunta PICO (pacientes, intervención, comparación y outcome) El listado
de las palabras claves está disponible en el Material Suplementario 1 (Tabla
S1). Se utilizaron bases de datos electrónicas, Web of Science, PubMed,
Cochrane Library, Scopus, EBSCO y Proquest, para encontrar artículos de
estudios y revisar sus resultados. Las estrategias de búsqueda están en el
Material Suplementario 2 (Tablas S2-S7). No se utilizó restricción de
antigüedad ni idioma en la búsqueda de artículos.
Selección de los estudios
Dos revisoras
previamente entrenadas realizaron la búsqueda de artículos en las bases de
datos antes mencionadas. Para ello se realizó lectura de título y
resumen, además se consideraron los criterios de
elegibilidad descritos anteriormente. Para la selección de artículos las
revisoras consideraron tres categorías “incluido”, “excluido” o “incierto”. En
caso de discrepancia en la selección de los ECAs, se acudió a una tercera revisora que contribuyó para
analizar y generar el consenso y selección de los
estudios. Una vez realizada la selección primaria de los ensayos se procedió a
hacer una lectura a texto completo, donde finalmente se seleccionó los
artículos que ingresaron definitivamente a la revisión sistemática. Este
proceso fue apoyado con la guía de lectura Consolidated Standards of Reporting
Trials (CONSORT).(20)
Datos de extracción
De los estudios
seleccionados anteriormente las revisoras extrajeron la siguiente información:
a) autor y año; b) localidad: ciudad-país; c) población de estudio (edad: años,
sexo biológico: hombre-mujer); d) características de la intervención; e)
duración: semanas; f) tamaño de efecto de las variables y g) efectos secundarios.
Evaluación de la calidad
Para evaluar el riesgo de sesgo,
dos revisoras evaluaron la posible presencia de sesgo de: selección,
realización, detección, desgaste y notificación. Cada evaluadora calificó el
estudio de acuerdo con la escala del nivel de sesgo: bajo riesgo, alto riesgo o
no claro. En caso de que hubiera discrepancia, se llamó a una tercera
evaluadora para tomar la decisión final. Para graficar la evaluación del riesgo
de sesgo se utilizó el software review mánager.(21)
Síntesis de datos
Una vez
analizados todos los ECAs, se pretendió tener la diferencia de media global con
desviación estándar pre y post intervención, con un intervalo de confianza del
95 %. El grado de heterogeneidad se obtuvo con el indicador I2 más
el p valor de la prueba de Q de Cochran. Se
realizaron metaanálisis con Rev Man 5.4, sin embargo, se decidió no publicar
los resultados, ya que la cantidad de estudios involucrados en cada
metaanálisis fueron menores que cinco.
RESULTADOS
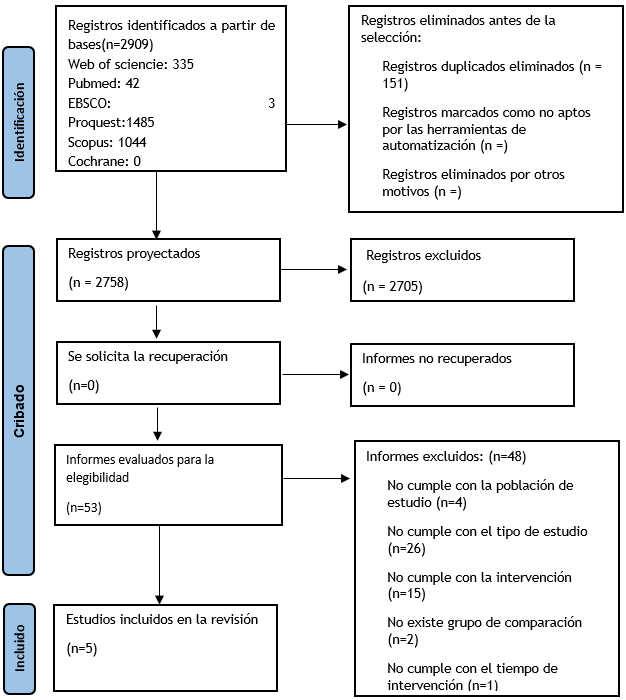
Resultados de la búsqueda
El proceso de
búsqueda de los artículos se presenta en la figura 1. Cinco estudios publicados
desde el 2014 hasta la actualidad.(22,23,24,25,26), se incluyeron en
esta revisión sistemática. Las intervenciones se dividieron en dos grupos a)
dieta baja en FODMAP <112 gr/día. b) dieta alta en FODMAP >112 gr/día,
una dieta habitual con la presencia o no de hábitos saludables.
Características de los estudios incluidos
Las
características de los estudios seleccionados en esta RS se encuentran en la tabla
2. En total fueron cinco ECAs, de los cuales dos fueron realizados en Irán(22,23),
uno en Australia(24), uno en China(25) y otro en Suecia.(26)
En relación del número de participantes, el rango es de 30 a 110 e incluye
edades de 18 a 65 años. El porcentaje de mujeres osciló entre un 50,4 % y un
100 %, mientras que el porcentaje de hombres oscila entre un 0 % a un 49,5 %.
La duración de las intervenciones fue entre 3 a 6 semanas. Tres de los estudios
incluyeron dieta habitual con la presencia de hábitos saludables, uno incluyó
dieta habitual con la presencia de hábitos no saludables y uno de dieta alta en
FODMAP.(22,23,24,25)
Con relación a
las variables de respuesta disponibles en la tabla 3, tres de los cinco
estudios presentaron dolor abdominal(22,24,26), cuatro presentaron
alteraciones gastrointestinales (22,23,24,25), tres presentaron dolor abdominal(22,24,26), los cinco
incluyen distensión abdominal (22,23,24,25,26), tres presentaron
hipersensibilidad visceral(22,25,26) los cinco incluyen alteraciones
en el hábito deposicional(22,23,24,25,26) y solo uno declara
tránsito anormal de gases.(25)
|
Tabla
2. Características de los
estudios incluidos
|
|
Primer
autor, año
|
Diseño
|
Localidad
|
Población
de estudio
|
Intervención
|
Control
|
Duración
Intervención
(semanas)
|
|
Zahedi et al.(22)
|
Estudio
aleatorizado ensayo controlado
|
Kerman,
Irán.
|
Muestra analizada
Intervención 101
FODMAP: 50
Control: 51
Edad (años) Media (DE) FODMAP: 37,60 ± 11,09
Control: 37,43± 13,27
Frecuencia de mujeres/hombres
FODMAP: 24/26
Control: 27/24
|
Intervención (dieta baja en FODMAP) =
Aporta menos de 0,5 gr por comida de
oligosacáridos fermentables, monosacáridos, disacáridos y polioles. Se
entregó un folleto con alimentos adecuados, inadecuados y sus sustitutos,
guía de compras, estrategias para comer fuera e información sobre
preparaciones de alimentos.
|
Consejos dietéticos los cuales considera ciertos
hábitos saludables como comer despacio y en paz siguiendo pautas británicas
de alimentación las cuales no prohíben sino limitan el consumo de alcohol,
cafeína, alimentos ultraprocesados y bebidas carbonatadas.
|
6 semanas
|
|
Mohseni et al.(23)
|
Estudio
aleatorizado, doble ciego, controlado con placebo
ensayo clínico
|
Teherán,
Irán.
|
Muestra analizada
Intervención 49
FODMAP: 23
Control: 26
Edad (años) Media (DE) FODMAP: 34,55 ± 9,19
Control: 41,64 ± 13,94
Frecuencia de mujeres/hombres
FODMAP: 15/12
Control: 12/10
|
Intervención (dieta baja en FODMAP) =
Aporta menos de 5gr por día más unas capsulas con
almidón de arroz. Durante toda la investigación, se contó con la supervisión
de un nutricionista, quien previamente explicó en qué consistía la dieta baja
en FODMAP y posteriormente realizó un seguimiento exhaustivo de la misma.
|
Se entregó una dieta baja en FODMAP de menos de
5gr por día, sin embargo, se les dio unas cápsulas con gluten (trigo, la
cebada y el centeno). Durante toda la investigación, se contó con la
supervisión de un nutricionista, quien previamente explicó en qué consistía
la dieta baja en FODMAP y posteriormente realizó un seguimiento exhaustivo de
la misma.
|
6 semanas
|
|
Halmos et al.(24)
|
Estudio
aleatorizado ensayo controlado
|
Victoria,
Australia
|
Muestra analizada
Intervención 38
FODMAP: 30
Control: 8
Edad (años) Media (DE) FODMAP: 41 (29±53)
Control: 31 (23±60)
|
Intervención en pacientes con SII (dieta baja en
FODMAP) =
aporte 0,5 gr de FODMAP por comida, las cuales eran 3 comidas principales más
3 colaciones, diseñadas por una dietista y preparadas exclusivamente por un
chef y personal de hotelería entregadas directamente en el hogar de las
participantes.
|
Se proporcionó un plan nutricional para usuarios
sin SII. Incluyó comidas típicas/ de Australia. El plan consta de 3 comidas
principales y 3 colaciones, diseñadas por un dietista y preparadas por un
chef. Además, estas comidas se entregan en el hogar de los participantes.
|
3 semanas
|
|
Zhang et al.(25)
|
Ensayo
controlado aleatorio de grupos paralelos con
análisis de factores clínicos
|
Zhejiang, China.
|
Muestra analizada
Intervención 56
FODMAP: 30
Control: 26
Edad (años) Media (DE) FODMAP: 42,4 ± 10,7
Control: 44,6 ± 14,6
Frecuencia de mujeres/hombres
FODMAP: 15/15
Control: 15/11
|
Intervención (dieta baja en FODMAP) =
Los pacientes asignados a una dieta baja en FODMAP
recibieron una consulta dietética cara a cara de al menos 20 minutos con un
dietista de investigación, junto con un plan de menú de 3 semanas para una
dieta baja en FODMAP (LFD). Se les indicó que evitaran los alimentos con alto
contenido de FODMAP y se les proporcionó una lista parcial de alimentos
típicos con alto contenido de FODMAP que deben evitar.
|
A los pacientes asignados aleatoriamente al grupo
control se les proporcionó una consulta dietética cara a cara de al menos 20
minutos con un dietista de investigación. Se les recomendó reducir la ingesta
de alimentos grasos o picantes, café y alcohol, y comer regularmente 3 veces
al día. Se les aconsejó no consumir demasiado o muy poco, y comer en paz
masticando bien. No se excluyeron específicamente los alimentos que contienen
FODMAP.
|
3 semanas
|
|
Böhn
et al.(26)
|
Estudio
aleatorizado ensayo controlado
|
Gotemburgo, Suecia.
|
Muestra
analizada
Intervención
67
FODMAP: 33
Control:
34
Edad (años) Media (DE) FODMAP:
44
(18-69)
Control:
41 (18-68)
Frecuencia
de mujeres
FODMAP: 30
Control:
31
|
Intervención (dieta baja en FODMAP) = dieta FODMAP
con contenido reducido de carbohidratos fermentables de cadena corta. Los
pacientes recibieron instrucciones verbales detalladas sobre los consejos
dietéticos de uno de los tres dietistas del estudio, junto con un folleto,
con instrucciones escritas sobre la dieta, incluidas instrucciones detalladas
sobre los alimentos.
|
Se realizó un patrón de alimentación regular, con
mayor énfasis en cómo y cuándo comer, qué en qué alimentos ingerir, se deben
evitar comidas copiosas y reducción del consumo de grasas, fibras insolubles,
cafeína y alimentos que producen gases como frijoles, repollo y cebolla.
|
4 semanas
|
|
Abreviatura:
FODMAP, oligosacáridos, disacáridos, monosacáridos y polioles fermentables (carbohidratos
fermentables)
|
|
Tabla
3. Resultados de los estudios
incluidos
|
|
Primer autor,
año
|
Alteraciones
gastrointestinales
|
Distensión
abdominal
|
Hipersensibilidad
visceral
|
Alteraciones en
el
hábito
deposicional
|
Tránsito
anormal de
gases
|
Dolor abdominal
|
Efectos
secundarios
|
Efectos de
disminución
FODMAP
|
|
Zahedi
et al.(22) IBS-SSS
|
Semana 0 intervención
FODMAP*
69,75 (DE= 23,03)
Control*
62,38 (DE= 21,36)
Semana 3 intervención
FODMAP*
50,5 (DE= 17,53)
Control*
50,5 (DE= 19,47)
Semana 6 intervención
FODMAP*
31,75 (DE= 17,37)
**P <0,001
Control*
9,25 (De= 16,23)
**P <0,001
|
Semana 0 intervención
FODMAP*
60,50 (DE= 26,98)
Control*
58,75 (De= 27,09)
Semana 3 intervención
FODMAP*
43 (De= 23,88)
Control*
47,5 (De= 21,33)
Semana 6 intervención
FODMAP:
26,25 (De= 18,35)
**P <0,001
Control:
36,88 (De= 15,83)
**P <0,001
|
Semana 0 Intervención
FODMAP*
48,38 (De= 29,57)
Control*
47,38 (De= 33,03)
Semana 3
Intervención
FODMAP*
34,13 (De= 20,53)
Control*
34,88 (De= 24,21)
Semana 6 Intervención
FODMAP* 1,6,13 (De=
13,13)
** P <0,001
Control*
25,88 (De= 21,11)
**P <0,001
|
Semana 0 intervención
FODMAP*
3,29 (De= 0,87)
Control* 3,3 (De= 0,77)
Semana 6 intervención
FODMAP* 1,91 (De= 0,56)
**P <0,001
Control* 2,6 (De= 0,96)
**P <0,001
|
No declara
|
Semana 0 intervención
FODMAP* 37,38 (De= 31,63)
Control* 32 (De= 28,75)
Semana 3
Intervención
FODMAP*24,5 (De= 24,17)
Control* 24,5 (De= 22,41)
Semana 6 Intervención
FODMAP*13,25 (De= 14,21)
**P <0,001
Control*
16,75 (De= 17,74)
**P <0,001
|
No
declara
|
Semana 0 intervención
FODMAP*
263,75 (De= 91,25)
Control*
252,5 (De= 85,51)
Semana 3 intervención
FODMAP*
187,63 (De= 82,89)
Control*
202 (De= 76,03
Semana 6 intervención
FODMAP*
108 (De= 63,82)
**P <0,001
Control*
149,75 (De= 51,39)
*P <0,001
|
|
Mohseni
et al.(23) IBS-SSS
|
Semana 0 intervención
FODMAP* 52,95 (De= 21,36)
Control* 41,59 (De=
23,31)
Semana 6 intervención
FODMAP* 36,36 (De= 18,20)
**P <0,002
Control* 29,32 (De=
24,31)
**P 0,99
|
Semana 0 intervención
FODMAP* 70,45 (De= 12,71)
Control* 56,36 (De=
21,88)
Semana 6 intervención
FODMAP 26,14 (De= 11,22)
**P <0,01
Control* 32,73 (De=
20,85)
**P 0,37
|
No declara
|
Semana 0 intervención
FODMAP* 2,50 (De= 1,30)
Control* 1,82 (De= 0,73)
Semana 6 intervención
FODMAP* 1,77 (De= 0,97)
**P <0,01
Control* 2,00 (De= 0,87)
**P 0,61
|
No declara
|
No declara
|
No declara
|
Semana 0
FODMAP:
294,77 (De= 64,00)
Control: 241,81 (De=
82,36)
semana 6
FODMAP: 150,22 (De=
47,16) P<0,02
control: 156,81 (De=
86,09)
**P 0,75
|
|
Halmos et al.(24). EVA
|
Semana 3 intervención
FODMAP*** 22,8 mm en
la EVA [IC 95 %, 16,7,28,8 mm] **P < 0,001 Control*** 44,9 mm en la EVA
[IC 95 %, 36,6,53,1 mm]
**P < 0,001
|
Semana 1 intervención
FODMAP*** 37,6 [29,6,45,6]
Control*** 18,1 [4,9,31,2]
**P 0,022
Semana 2 intervención
FODMAP*** 24,2 (17,1,31,2)
Control*** 45,1 (35,1,55,0
**P <0,001
Semana 3 intervención
FODMAP*** 10,4 (5,4,15)
Control*** 11,8 (5,9,17,8)
**P 0,742
|
No declara
|
Semana 1 intervención
FODMAP***35,1 [27,7,42,4]
Control*** 21,2 [11,1,31,3]
**P 0,068
Semana 2 intervención
FODMAP*** 25,9 (18,9,32,9)
Control*** 47,8 (37,6,57,9)
**P < 0,001
Semana 3 intervención
FODMAP*** 10,1 (4,9,15,2)
Control*** 17,7 (7,5,27,9)
**P 0,547
|
No declara
|
Semana 1 intervención
FODMAP*** 35,5 [28,2,42,8]
Control*** 14,8 [3,2,26,4]
**P 0,008
Semana 2 intervención
FODMAP*** 22,5 (16,3,28,6)
Control*** 43,8 (35,0,52,5)
**P < 0,001
Semana 3 intervención
FODMAP*** 9,1 (4,6,13,7)
Control*** 9,6 (5,1,14,4)
**P 0,742
|
No declara
|
Semana 3 intervención
FODMAP***] 3,05 [1,86,4,25]
**P <0,001
Control*** 23,7 [16,9,30,6]
|
|
Zhang et al.(25). IBS-SSS
|
Semana 0 intervención
FODMAP* 177,9 (De= 89,6)
Control* 178,2 (De=
71,5)
Semana 3 intervención
FODMAP* 126,3 (De= 63,0)
**P <0,001
Control* 167,1 (De= 67,3)
**P 0,232
|
**P < 0,05
|
**P < 0,01
|
**P < 0,01
|
**P < 0,001
|
No declara
|
Los resultados
secundarios incluyeron cambios en la consistencia de las heces, frecuencia de
las deposiciones, dolor abdominal, microbioma y AGCC
|
Semana 0 intervención
FODMAP* 6,32 (2,68 De= 10,85)
Control* 5,77 (3,23
De= 8,84)
Semana 3 intervención
FODMAP* 1,49 (0.95 De= 3.17)
**P <0,001
Control* 7.06 (2.20 De= 13.73)
**P 0.240
|
|
Böhn et al.(26). IBS-SSS
|
No declara
|
semana 0
intervención FODMAP*
68,7 (De= 21,6)
control* 62,4 (De= 26,2)
semana 4 intervención FODMAP*
45,8 (De=
32,8)
**P: <0,001
Control* 50,0 (De=
31,5)
**P: 0,003
|
semana 0 intervención FODMAP*
39,2 (De=
14,5)
Control*
40,5 (De=
17,8)
semana 4 intervención FODMAP*
42,0 (De=
10,4)
**P: 0,52
Control*
43,0 (De=
16,1)
**P: 0,66
|
semana 0
FODMAP*
4,0 (De=
1,1)
Control*
3,8 (De=
1,1)
semana 4
FODMAP*
3,9 (De=
1,1)
**P: 0,12
Control*
3,6 (De=
1,0)
**P: 0,002
|
semana 0
FODMAP*
51,8 (De=
23,8)
Control* 46,9 (De=
23,0)
semana 4
FODMAP*
42,2 (De=
32,6)
**P: 0,7
Control* 37,6 (De=
26,9)
**P: 0,06
|
No declara
|
No declara
|
semana 0
FODMAP*
324 (De=
69)
Control*
302 (De= 61)
semana 4
FODMAP*
246 (De= 127)
**P:<0,001
Control*236 (De=
78)
**P:<0,001
|
Los resultados
se presentan de la siguiente forma: *Media
aritmética y (DE) desviación estándar en el momento post y previo a la
intervención; **P valor post intervención; ***media [IC del 95 %]. Abreviaturas:
(EVA), escala analógica visual del dolor; (IBS-SSS), escala que representa la
gravedad de los síntomas del síndrome del intestino irritable. FODMAP, oligosacáridos, disacáridos,
monosacáridos y polioles fermentables (carbohidratos fermentables).
Evaluación del riesgo de sesgo
El porcentaje de
riesgo de sesgo se encuentra disponible en la figura 2. El 100 % de los
estudios presentó bajo riesgo de sesgo de selección y desgaste. En cuanto al
sesgo de realización, presentó un 25 % de alto riesgo debido a la existencia de
desigualdad en cuanto a la atención proporcionada a los participantes del
estudio y presentó un 25 % de riesgo no claro, ya que no declara información.
Mientras que los sesgos de detección y notificación presentaron un 25 % de
riesgo bajo y un 75 % de riesgo no claro por no presentar información.
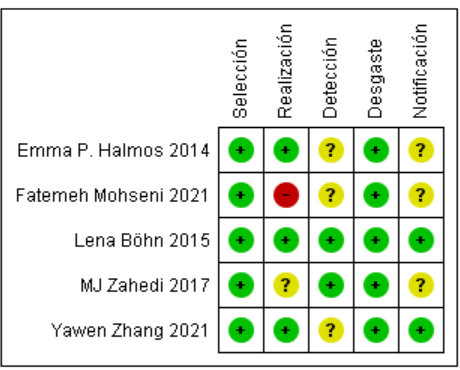
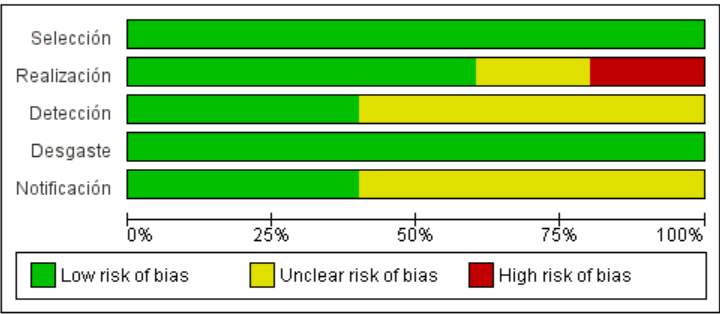
Figura 2. Evaluación del riesgo de sesgo de los 5 ECAs incluidos en la RS.
Verde: bajo riesgo de sesgo; amarillo: riesgo incierto de sesgo; rojo: alto
riesgo de sesgo
Resultados de los estudios incluidos
Zahedi et al.(22)
comparó dos grupos que recibieron consejos dietéticos, uno de ellos incluyó
dieta baja en FODMAP, mientras que el segundo grupo recibió asesoramiento
dietético en hábitos saludables. La dieta baja en FODMAP generó una disminución
entre la semana 0-6 de: alteraciones gastrointestinales (-54,5 %), distensión
abdominal (-56,7 %), hipersensibilidad visceral (-66,7 %), alteraciones en el
hábito posicional (-41,9 %) y dolor abdominal (-64,6 %). En síntesis, pese a
que ambos grupos incluían consejos dietéticos, el grupo FODMAP obtuvo
resultados más significativos (P < 0,001).
Mohseni et al.(23)
estudió la dieta baja en FODMAP de menos 5 gr/día sin consumo de gluten vs FODMAP
de menos 5 gr/día con consumo de gluten, con una duración de seis semanas. La
primera intervención demostró mejoras significativas (P < 0,001- P <
0,002) sobre las variables: distensión abdominal (-63 %), alteraciones
gastrointestinales (-36 %), dolor abdominal (-46 %) y alteraciones en el hábito
deposicional (-7 %). Las dos intervenciones experimentaron mejoras en las
variables del estudio, incluso se observa una mejora en la calidad de vida
relacionada con la salud en ambos grupos, sin embargo, la dieta baja en FODMAP
de menos 5 gr/día sin consumo de gluten demostró ser beneficiosa para los
pacientes con SII por sobre la dieta baja en FODMAP con consumo de gluten, ya
que genera efectos a nivel intestinal, tales como distensión abdominal (P <
0,001) y alteraciones en el hábito deposicional (P < 0,01).
Halmos et al.(24)
comparó la dieta baja en FODMAP versus una dieta típica australiana con una
duración de 3 semanas bajo la supervisión de dietistas, los resultados de las
variables fueron: distensión abdominal (-72 %), hipersensibilidad visceral (-71
%) y dolor abdominal (-74 %). Ambos grupos tuvieron efectos positivos, no
obstante, la dieta baja en FODMAP generó un mayor impacto estadísticamente
significativo sobre el efecto que provoca la disminución de los FODMAP (P <
0,001).
Zhang et al.(25)
estudió dos dietas con asesoramiento dietético, una de ellas la dieta baja en
FODMAP versus una dieta habitual con exclusión de alcohol, alimentos picantes y
grasos, por una duración de tres semanas. La dieta baja en FODMAP demostró
mejoras significativas sobre las variables: alteraciones gastrointestinales
(P<0,001), distensión abdominal (P<0,05), hipersensibilidad visceral
(P<0,01), alteraciones en el hábito deposicional (P<0,01), tránsito
intestinal de gases (P<0,001).
Böhn et al.(26)
estudió la dieta baja en FODMAP versus un patrón de alimentación regular con
restricción de alimentos grasos, con fibra insoluble, estimulantes y
meteorizantes, con una duración de cuatro semanas, los resultados informaron
disminuciones para las variables: alteraciones en el hábito deposicional (P= 0,120),
distensión abdominal los valores iniciales previo a la intervención fueron
mayores en el grupo FODMAP, sin embargo, de igual forma experimentaron una
disminución (P <0,001), mientras que el grupo de comparación también tuvo un
descenso en la variable (P= 0,003), por otra parte las variables dolor
abdominal (P= 0,700) e hipersensibilidad visceral (P= 0,520) no experimentaron
cambios. Pese a que las variables estudiadas en ambos grupos se redujeron,
estas no experimentaron mejoras significativas (P=0,62).
Con relación a
los efectos adversos presentados por Zhang et al.(25) se informan
cambios en la consistencia de las heces, frecuencia de las deposiciones, dolor
abdominal, microbioma y AGCC. Mientras que Zahedi et al.(22),
Mohseni et al.(23), Halmos et al.(24) y Böhn et al.(26),
no informaron efectos adversos de las intervenciones.
DISCUSIÓN
En la
actualidad, la dieta baja en FODMAP se ha consolidado como una estrategia de
primera línea como tratamiento ante SII en adultos. Al analizar las variables
de interés, múltiples estudios informan disminución en la sintomatología
gastrointestinal clásica asociada a esta patología (27-29). Es por
ello que al estudiar los ECAs incluidos en la
R.S según variable de respuesta, se evidencian cambios en las variables
alteraciones gastrointestinales, distención y dolor abdominal, sintomatología
que puede disminuir hasta en un 70 % siguiendo este patrón alimentario
(31). Lo anterior se explica, por el alto consumo de FODMAP(30),
que genera una absorción parcial de los alimentos en el intestino delgado y
colon, produciendo un sobrecrecimiento bacteriano y su posterior fermentación(31),
desencadenando una serie de alteraciones gastrointestinales, entre ellas
inflamación de las paredes del colon debido a la producción excesiva de gas (34),
causando distensión abdominal y dolor, frecuencia en los hábitos deposicionales
(33), inclusive diarrea y flatulencia, lo cual concuerda con lo
expuesto por Zhang et al. (2021(25)); sin embargo, de
igual forma se debe considerar un equilibrio entre la producción y la
eliminación de estos productos fermentados, pues al existir desequilibrios es
más probable presentar la sintomatología.(33)
En cuanto a la
variable tránsito anormal de gases, las disminuciones se explican debido al
ciclo mencionado anteriormente. Al tener una alta ingesta de FODMAP, los
alimentos digeridos parcialmente fermentan de gran manera debido a la alta
concentración de bacterias, principalmente anaeróbicas en el colon como las
Bifidobacterium y Bacteroides que son fermentadoras de carbohidratos(25)
aumentando la concentración de gas colónico el cual desencadena un aumento de
presión osmótica, la cual acrecienta aún más la concentración de gases,
provocando que se acumulen y genere presión en las paredes del colon, lo que
desencadena y contribuye a presentar distención y dolor abdominal. Por el
contrario, al seguir una dieta baja en FODMAP y no contar con productos
fermentables en el colon, disminuye la presión osmótica lo que genera una
reducción de gases en el intestino, generando así que disminuya
significativamente todas las variables de estudio, es decir la sintomatología
clásica (34). Respecto a la variable hipersensibilidad visceral, los
cambios se explican, ya que, al tener alto consumo de carbohidratos
fermentables, se ocasiona un aumento de gases en el colón, desencadenando en
inflamación visceral y como consecuencia dolor y sensibilidad abdominal.(32)
En
síntesis, al instruir al paciente a una dieta baja en FODMAP, los síntomas del
SII mejoran considerablemente al compararla con un patrón alimentario habitual.
Lo anterior debido a la restricción de la ingesta de los carbohidratos de
cadena corta, que garantiza no contar con materia fermentable para las
bacterias del intestino. Por ende, es fundamental considerar que, si bien al
eliminar de la dieta tradicional el consumo de FODMAP no habrá una cura de manera
permanentemente para el SII, de igual forma, podremos suprimir de manera
importante la sintomatología asociada a esta patología.
Limitaciones
La presente R.S
no se encuentra exenta de limitaciones. En primer lugar, encontramos el bajo
número de estudios incluidos, que no permitió realizar metaanálisis de los
estudios incluidos, lo cual podría generar una síntesis
estadística problemática y de bajo poder estadístico. De igual modo
consideramos el reducido tiempo de intervención
de los estudios incluidos, ya que solo dos de los cinco estudios incluidos en
esta R.S consideraron 6 semanas de duración, mientras que los tres restantes
consideraron intervenciones de 3 y 4 semanas. Sumado a lo anterior, las
variables vómitos, diarrea y calidad de vida no fueron consideradas dentro de
la mayoría de los estudios analizados en el proceso de búsqueda, pese a que son
parámetros establecidos dentro de la sintomatología del SII(1)
(referencia que hablen sobre todos los síntomas del SII e incluya vómitos y náuseas).
Por último, con relación a la variable tránsito anormal de gases, es necesario
mencionar que pese a ser un síntoma clásico del SII no se considera como una
variable de estudio en todos los ECAs analizados.
Sugerencias
De acuerdo con
lo anterior, podemos sugerir que las próximas investigaciones consideren
duraciones más extensas, de un mínimo de 6 semanas y
con seguimiento post- intervención para identificar posibles efectos adversos, sumado
a un adecuado asesoramiento nutricional para evitar carencias
nutricionales y por ende presentar mejores resultados ante la intervención.
Además, se recomienda considerar otras variables de estudio para
investigaciones futuras, tales como vómitos, náuseas y calidad de vida. También
sugerimos estandarizar el protocolo de intervención de la dieta baja en FODMAP,
y considerar tiempos de seguimiento post- intervención de 6 meses como mínimo
para evaluar posibles efectos secundarios.
CONCLUSIÓN
En definitiva,
la evidencia científica analizada permite informar que la dieta baja en FODMAP
en adultos diagnosticados con SII reduce significativamente la sintomatología
clásica asociada, generando disminuciones sobre las variables de estudio:
distensión abdominal, alteraciones en el hábito deposicional, dolor abdominal,
tránsito anormal de gases, alteraciones gastrointestinales, hipersensibilidad
visceral. La presente investigación permite sugerir la dieta baja en FODMAP
como una estrategia efectiva y de primera línea ante el diagnóstico de SII,
siempre y cuando se cuente con un adecuado asesoramiento dietético para evitar
déficit nutricional y posibles efectos secundarios.
REFERENCIAS
BIBLIOGRÁFICAS
1. Nybacka S,
Störsrud S, Lindqvist HM, Törnblom H, Simrén M, Winkvist A. Habitual FODMAP
intake in relation to symptom severity and pattern in patients with irritable
bowel syndrome. Nutrients. 2020;13(1):27. Disponible en: http://dx.doi.org/10.3390/nu13010027
2. Wilson B, Cox
SR, Whelan K. Challenges of the low FODMAP diet for managing irritable bowel
syndrome and approaches to their minimisation and mitigation. Proc
Nutr Soc [Internet]. 2021;80(1):19–28. Disponible en: http://dx.doi.org/10.1017/S0029665120006990
3. Manning LP,
Yao CK, Biesiekierski JR. Therapy of IBS: Is a low FODMAP diet the answer?
Front Psychiatry [Internet]. 2020;11:865. Disponible en: http://dx.doi.org/10.3389/fpsyt.2020.00865
4. Altobelli E,
Del Negro V, Angeletti P, Latella G. Low-FODMAP diet improves irritable bowel
syndrome symptoms: A meta-analysis. Nutrients [Internet]. 2017;9(9):940.
Disponible en: http://dx.doi.org/10.3390/nu9090940
5. Zugasti
Murillo A, Estremera Arévalo F, Petrina Jáuregui E. Diet low in fermentable
oligosaccharides, disaccharides, monosaccharides and polyols (FODMAPs) in the
treatment of irritable bowel syndrome: Indications and design. Endocrinol
Nutr (Engl Ed) [Internet]. 2016;63(3):132–8. Disponible en: http://dx.doi.org/10.1016/j.endoen.2015.10.014
6.
Mearin F, Peña E, Balboa A. Importancia de la dieta en el síndrome del
intestino irritable. Gastroenterol Hepatol [Internet]. 2014;37(5):302–10.
Disponible en: http://dx.doi.org/10.1016/j.gastrohep.2013.12.010
7. Bellini M,
Tonarelli S, Nagy AG, Pancetti A, Costa F, Ricchiuti A, et al. Low FODMAP diet:
Evidence, doubts, and hopes. Nutrients [Internet]. 2020;12(1):148. Disponible
en: http://dx.doi.org/10.3390/nu12010148
8. Liu J, Chey
WD, Haller E, Eswaran S. Low-FODMAP diet for irritable bowel syndrome: What we
know and what we have yet to learn. Annu Rev Med
[Internet]. 2020;71(1):303–14. Disponible en: http://dx.doi.org/10.1146/annurev-med-050218-013625
9. Rej A,
Sanders DS, Shaw CC, Buckle R, Trott N, Agrawal A, et al. Efficacy and
acceptability of dietary therapies in non-constipated irritable bowel syndrome:
A randomized trial of traditional dietary advice, the low FODMAP diet, and the
gluten-free diet. Clin Gastroenterol Hepatol
[Internet]. 2022;20(12):2876-2887.e15. Disponible en: http://dx.doi.org/10.1016/j.cgh.2022.02.045
10. Halmos EP,
Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms
of irritable bowel syndrome. Gastroenterology
[Internet]. 2014;146(1):67-75.e5. Disponible en: http://dx.doi.org/10.1053/j.gastro.2013.09.046
11. O’Keeffe M,
Lomer MC. Who should deliver the low FODMAP diet and what educational methods
are optimal: a review: Low FODMAP diet; education. J
Gastroenterol Hepatol [Internet]. 2017;32 Suppl 1:23–6. Disponible en: http://dx.doi.org/10.1111/jgh.13690
12.
Pérez y López N, Torres-López E, Zamarripa-Dorsey F. Respuesta clínica en
pacientes mexicanos con síndrome de intestino irritable tratados con dieta baja
en carbohidratos fermentables (FODMAP). Rev Gastroenterol Mex [Internet].
2015;80(3):180–5. Disponible en: http://dx.doi.org/10.1016/j.rgmx.2015.06.008
13.
Mearin F, Peña E, Balboa A. Importancia de la dieta en el síndrome del
intestino irritable. Gastroenterol Hepatol [Internet]. 2014;37(5):302–10.
Disponible en: http://dx.doi.org/10.1016/j.gastrohep.2013.12.010
14.
Molina-Infante J, Serra J, Fernandez-Bañares F, Mearin F. The low-FODMAP diet
for irritable bowel syndrome: Lights and shadows. Gastroenterol
Hepatol (Engl Ed) [Internet]. 2016;39(2):55–65. Disponible en: http://dx.doi.org/10.1016/j.gastre.2016.01.004
15. Vakil N.
Dietary fermentable oligosaccharides, disaccharides, monosaccharides, and
polyols (FODMAPs) and gastrointestinal disease. Nutr Clin Pract [Internet].
2018;33(4):468–75. Disponible en: http://dx.doi.org/10.1002/ncp.10108
16. Frieling,
T., Heise, J., Krummen, B., Hundorf, C., & Kalde, S. (2019). Tolerability
of FODMAP-reduced diet in irritable bowel syndrome-efficacy, adherence, and
body weight course. Zeitschrift Fur
Gastroenterologie, 57(6), 740–744.
17.
Sebastián Domingo JJ, Sánchez Sánchez C. La dieta baja en FODMAP, ¿es realmente
eficaz y segura en el síndrome del intestino irritable?: una revisión
panorámica. Semergen [Internet]. 2020;46(8):566–76. Disponible en: http://dx.doi.org/10.1016/j.semerg.2020.07.010
18. PRISMA 2020
Checklist Section and Topic Item # Checklist item Location where item is
reported TITLE Title 1 Identify the report as a systematic review. (n.d.). https://doi.org/10.1136/bmj.n71
19. Frieling T,
Heise J, Krummen B, Corinna H, Kalde S. Toleranz einer FODMAP-reduzierten Diät
beim Reizdarmsyndrom – Effektivität, Adhärenz und Gewichtsentwicklung. En: 74
Jahrestagung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und
Stoffwechselkrankheiten mit Sektion Endoskopie – 13 Herbsttagung der Deutschen
Gesellschaft für Allgemein- und Viszeralchirurgie gemeinsam mit den
Arbeitsgemeinschaften der DGAV. Georg Thieme
Verlag KG; 2019.
20.
Manual Cochrane de revisiones sistemáticas de intervenciones | Cochrane
Training. (n.d.). Retrieved November 26, 2023,
from https://training.cochrane.org/es/manual-cochrane-de-revisiones-sistem%C3%A1ticas-de-intervenciones.
21. Schulz K,
Altman D, Moher D. CONSORT 2010 Statement: Updated guidelines for reporting
parallel group randomized trials. BMJ. 2010; 340: 698-702.
22. Zahedi, M.
J., Behrouz, V., & Azimi, M. (2018). Low fermentable oligo-di-monosaccharides
and polyols diet versus general dietary advice in patients with
diarrhea-predominant irritable bowel syndrome: A randomized controlled trial.
Journal of Gastroenterology and Hepatology, 33(6), 1192–1199.
23. Mohseni F,
Agah S, Ebrahimi-Daryani N, Taher M, Nattagh-Eshtivani E, Karimi S, et al. The
effect of low FODMAP diet with and without gluten on irritable bowel syndrome:
A double blind, placebo controlled randomized clinical trial. Clin
Nutr ESPEN [Internet]. 2022;47:45–50. Disponible en: http://dx.doi.org/10.1016/j.clnesp.2021.12.019
24. Halmos EP,
Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces
symptoms of irritable bowel syndrome. Gastroenterology
[Internet]. 2014;146(1):67-75.e5. Disponible en: http://dx.doi.org/10.1053/j.gastro.2013.09.046
25. Zhang Y,
Feng L, Wang X, Fox M, Luo L, Du L, et al. Low fermentable oligosaccharides,
disaccharides, monosaccharides, and polyols diet compared with traditional
dietary advice for diarrhea-predominant irritable bowel syndrome: a
parallel-group, randomized controlled trial with analysis of clinical and
microbiological factors associated with patient outcomes. Am J Clin Nutr
[Internet]. 2021;113(6):1531–45. Disponible en: http://dx.doi.org/10.1093/ajcn/nqab005
26. Böhn L,
Störsrud S, Liljebo T, Collin L, Lindfors P, Törnblom H, et al. Diet low in
FODMAPs reduces symptoms of irritable bowel syndrome as well as traditional
dietary advice: a randomized controlled trial. Gastroenterology
[Internet]. 2015;149(6):1399-1407.e2. Disponible en: http://dx.doi.org/10.1053/j.gastro.2015.07.054
27. Algera JP,
Demir D, Törnblom H, Nybacka S, Simrén M, Störsrud S. Low FODMAP diet reduces
gastrointestinal symptoms in irritable bowel syndrome and clinical response
could be predicted by symptom severity: A randomized crossover trial. Clin
Nutr [Internet]. 2022;41(12):2792–800. Disponible en: http://dx.doi.org/10.1016/j.clnu.2022.11.001
28.
Mohseni F, Agah S, Ebrahimi-Daryani N, Taher M, Nattagh-Eshtivani E, Karimi S,
et al. The effect of low FODMAP diet with and
without gluten on irritable bowel syndrome: A double blind, placebo controlled
randomized clinical trial. Clin Nutr ESPEN [Internet]. 2022;47:45–50.
Disponible en: http://dx.doi.org/10.1016/j.clnesp.2021.12.019
29. Eswaran SL,
Chey WD, Han-Markey T, Ball S, Jackson K. A randomized controlled trial
comparing the low FODMAP diet vs. Modified NICE guidelines in US adults with
IBS-D. Am J Gastroenterol [Internet].
2016;111(12):1824–32. Disponible en: http://dx.doi.org/10.1038/ajg.2016.434
30. Algera JP,
Demir D, Törnblom H, Nybacka S, Simrén M, Störsrud S. Low FODMAP diet reduces
gastrointestinal symptoms in irritable bowel syndrome and clinical response
could be predicted by symptom severity: A randomized crossover trial. Clin
Nutr [Internet]. 2022;41(12):2792–800. Disponible en: http://dx.doi.org/10.1016/j.clnu.2022.11.001
31. Wong Z, Mok
C-Z, Majid HA, Mahadeva S. Early experience with a low FODMAP diet in Asian
patients with irritable bowel syndrome: Diet and Asian Irritable Bowel
Syndrome. JGH Open [Internet]. 2018;2(5):178–81. Disponible en: http://dx.doi.org/10.1002/jgh3.12069
32. Gibson, P
Gibson PR. History of the low FODMAP diet: History of the low FODMAP diet. J
Gastroenterol Hepatol [Internet]. 2017;32 Suppl 1:5–7. Disponible en: http://dx.doi.org/10.1111/jgh.13685
33.
Fernández-Bañares F. Carbohydrate maldigestion and intolerance. Nutrients
[Internet]. 2022;14(9):1923. Disponible en: http://dx.doi.org/10.3390/nu14091923
34. Wu J, Masuy
I, Biesiekierski JR, Fitzke HE, Parikh C, Schofield L, et al. Gut-brain axis
dysfunction underlies FODMAP-induced symptom generation in irritable bowel
syndrome. Aliment Pharmacol Ther [Internet].
2022;55(6):670–82. Disponible en: http://dx.doi.org/10.1111/apt.16812
FINANCIACIÓN
Los
autores no recibieron financiación para el desarrollo de la presente
investigación.
CONFLICTO
DE INTERESES
Los
autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN
DE AUTORÍA
Conceptualización:
Ninoska Leiva Gallegos, María San Martín Medel, Lidia Díaz Villalobos, Gabriela
Pedraza-Veloso.
Curación
de datos: Ninoska Leiva Gallegos, María San
Martín Medel, Lidia Díaz Villalobos
Análisis
formal: Ninoska Leiva Gallegos, María San
Martín Medel, Lidia Díaz Villalobos, Gabriela Pedraza Veloso.
Adquisición
de fondos: Gabriela Pedraza Veloso.
Investigación:
Ninoska Leiva Gallegos, María San Martín Medel, Lidia Díaz Villalobos
Metodología:
Ninoska Leiva Gallegos, María San Martín Medel, Lidia Díaz Villalobos, Gabriela
Pedraza Veloso.
Administración
del proyecto: Gabriela Pedraza Veloso.
Recursos:
Gabriela Pedraza Veloso.
Software:
Gabriela Pedraza Veloso, Ninoska Leiva
Gallegos.
Supervisión:
Gabriela Pedraza Veloso.
Validación:
Gabriela Pedraza Veloso.
Visualización:
Gabriela Pedraza Veloso.
Redacción
– borrador original: Ninoska Leiva
Gallegos, María San Martín Medel, Lidia Díaz Villalobos.
Redacción
– revisión y edición: Ninoska Leiva
Gallegos, María San Martín Medel, Lidia Díaz Villalobos, Gabriela Pedraza
Veloso.
ANEXOS
Pregunta de
investigación
En
pacientes con Síndrome del intestino irritable (SII) ¿La dieta baja en
carbohidratos fermentables (FODMAP), comparada con un régimen de alimentación
habitual, disminuye la sintomatología clásica gastrointestinal asociada al SII?
Objetivos
Objetivo general
·
Analizar la
efectividad de la dieta baja en carbohidratos fermentables (FODMAP) como
tratamiento en usuarios adultos diagnosticados con Síndrome del intestino
irritable.
Objetivos específicos
·
Observar el
rol e importancia del profesional nutricionista/dietista ante la prescripción y
seguimiento en pacientes que siguen una dieta baja en carbohidratos
fermentables (FODMAP), diagnosticados con SII.
·
Analizar el
efecto de una dieta baja en FODMAP sobre variables como: distensión abdominal,
características de las deposiciones e hipersensibilidad visceral.
·
Señalar los
efectos adversos y limitaciones de la dieta baja en carbohidratos fermentables
(FODMAP), en usuarios diagnosticados con SII.
·
Evaluar los
niveles de riesgo de sesgo (selección, realización, detección, desgaste y
notificación) de los estudios que participan de esta revisión sistemática).
MATERIAL SUPLEMENTARIO
Nº 1
|
TABLA S1.
Palabras claves y su relación con el pico
|
|
ESTRATEGIA
|
PALABRAS
CLAVES
|
MESH
|
|
Paciente
|
1.
adult
2.
patients
3.
user
4.
human
5.
irritable bowel syndrome.
6.
inflammatory bowel disease
7.
irritable bowel syndrome
|
“adult”
“Patients”
“user”
“human”
“irritable
bowel syndrome”
“inflammatory
bowel disease”
|
|
Intervención
|
1.
Diet low in
oligosaccharides, disaccharides, monosaccharides and fermentable polyols.
2.
Low FODMAP diet
3.
Diet FODMAP.
4.
FODMAP.
5.
Diet low in fermentable
carbohydrates.
6.
Low intake in FODMAP.
7.
Restricted intake of
fermentable carbohydrates.
8.
diet low in fermentable
alcohols.
9.
High consumption of FODMAP
sources.
|
”FODMAP
diet”
|
|
Control
|
1.
usual diet
2.
Traditional dietary
pattern
3.
Usual regime
4.
Diet high in FODMAP
5.
Diet without FODMAP restriction.
6.
regular intake of FODMAPs
7.
regular consumption of
FODMAPs
8.
regular diet
9.
diet
|
“diet”
|
|
Outcome
|
1.
Diarrhea
2.
Predominant diarrhea.
3.
Constipation.
4.
Predominant constipation.
5.
Stool characteristics.
6.
Characteristics of the
depositions
7.
Abdominal pain
8.
Inflammation
9.
Abnormal transit of gases.
10.
Inflammation of the
intestine
11.
flatulence
12.
Visceral hypersensitivity
13.
Abdominal distention.
14.
nausea
15.
vomiting
|
“Diarrhea”
“Constipation”
“Inflammation”
“Nausea”
“Vomiting”
“flatulence”
“Abdominal
pain”
|
MATERIAL SUPLEMENTARIO
Nº 2 – ESTRATEGIA DE BÚSQUEDA
|
Tabla S2: web
of science
|
|
SEARCH
|
QUERY
|
RESULTS
|
|
#18
|
#7 AND #8 AND #9 AND
#17
|
335
|
|
#17
|
#10 OR #11 OR #12 OR
#13 OR #14 OR #15 OR #16
|
864780
|
|
#16
|
ALL=(Abdominal pain)
|
58555
|
|
#15
|
ALL=(flatulence)
|
1318
|
|
#14
|
ALL=(Vomiting)
|
44966
|
|
#13
|
ALL=(Nausea)
|
44302
|
|
#12
|
ALL=(Inflammation)
|
679364
|
|
#11
|
ALL=(Constipation)
|
23086
|
|
#10
|
ALL=(Diarrhea)
|
80394
|
|
#9
|
ALL=( DIET)
|
444586
|
|
#8
|
ALL=(FODMAP diet)
|
928
|
|
#7
|
#1 OR #2 OR #3 OR #4
OR #5 OR #6
|
10931413
|
|
#6
|
ALL=(inflammatory
bowel disease)
|
90834
|
|
#5
|
ALL=(irritable bowel
syndrome)
|
20574
|
|
#4
|
ALL=(human)
|
4886992
|
|
#3
|
ALL=(user)
|
592335
|
|
#2
|
ALL=<(Patients)
|
5722811
|
|
#1
|
ALL=(adult)
|
1499892
|
|
TABLA S3: PubMed
|
|
SEARCH
|
QUERY
|
RESULTS
|
|
#18
|
#7 AND #8 AND #9 AND
#17
|
42
|
|
#17
|
#10 OR #11 OR #12 OR
#13 OR #14 OR #15 OR #16
|
70,635
|
|
#16
|
“Abdominal pain”
|
3,919
|
|
#15
|
flatulence
|
767
|
|
#14
|
Vomiting
|
17,107
|
|
#13
|
Nausea
|
22.220
|
|
#12
|
Inflammation
|
30,471
|
|
#11
|
Constipation
|
4,127
|
|
#10
|
Diarrhea
|
15,260
|
|
#9
|
DIET
|
45,187
|
|
#8
|
FODMAP diet
|
95
|
|
#7
|
#1 OR #2 OR #3 OR #4
OR #5 OR #6
|
960,195
|
|
#6
|
“inflammatory
bowel disease”
|
1.545
|
|
#5
|
“irritable bowel
syndrome”
|
1,468
|
|
#4
|
Human
|
957,295
|
|
#3
|
User
|
2,683
|
|
#2
|
Patients
|
616,889
|
|
#1
|
Adult
|
724,928
|
|
TABLA S5: SCOPUS
|
|
SEARCH
|
QUERY
|
RESULTS
|
|
#18
|
#7 AND #8 AND #9 AND #17
|
2.211
|
|
#17
|
#10 OR #11 OR #12 OR
#13 OR #14 OR #15 OR #16
|
3.561.791
|
|
#16
|
“Abdominal pain”
|
244.740
|
|
#15
|
flatulence
|
16.193
|
|
#14
|
Vomiting
|
326.981
|
|
#13
|
Nausea
|
330.188
|
|
#12
|
Inflammation
|
2.669.340
|
|
#11
|
Constipation
|
139.984
|
|
#10
|
Diarrhea
|
485.242
|
|
#9
|
DIET
|
2.154.790
|
|
#8
|
FODMAP diet
|
2.659
|
|
#7
|
#1 OR #2 OR #3 OR #4
OR #5 OR #6
|
39.615.578
|
|
#6
|
“inflammatory
bowel disease”
|
324.210
|
|
#5
|
“irritable bowel
syndrome”
|
83.948
|
|
#4
|
Human
|
34.355.005
|
|
#3
|
User
|
4.517.910
|
|
#2
|
Patients
|
16.331.212
|
|
#1
|
Adult
|
13.772.695
|
|
TABLA S6: EBSCO
|
|
SEARCH
|
QUERY
|
RESULTS
|
|
S18
|
S7 AND
S8 AND S9 AND S17
|
3
|
|
S17
|
S10 OR
S11 OR S12 OR S13 OR S14 OR S15 OR S16
|
8,079
|
|
S16
|
“Abdominal pain”
|
1,079
|
|
S15
|
flatulence
|
87
|
|
S14
|
Vomiting
|
1,307
|
|
S13
|
Nausea
|
823
|
|
S12
|
Inflammation
|
3,556
|
|
S11
|
Constipation
|
639
|
|
S10
|
Diarrhea
|
1,851
|
|
S9
|
DIET
|
21,714
|
|
S8
|
FODMAP diet
|
19
|
|
S7
|
#1 OR #2 OR #3 OR #4
OR #5 OR #6
|
1,191,313
|
|
S6
|
“inflammatory
bowel disease”
|
439
|
|
S5
|
“irritable bowel
syndrome”
|
191
|
|
S4
|
Human
|
534,598
|
|
S3
|
User
|
129,917
|
|
S2
|
Patients
|
168,812
|
|
S1
|
Adult
|
724,928
|
|
**Aplicando filtro por artículo quedan el 1044.
|
|
TABLA S7: PROQUEST
|
|
SEARCH
|
QUERY
|
RESULTS
|
|
S18
|
S7 AND
S8 AND S9 AND S17
|
2.919
|
|
S17
|
S10 OR
S11 OR S12 OR S13 OR S14 OR S15 OR S16
|
4.320.440
|
|
S16
|
“Abdominal pain”
|
349.392
|
|
S15
|
flatulence
|
61.942
|
|
S14
|
Vomiting
|
899.711
|
|
S13
|
Nausea
|
927.934
|
|
S12
|
Inflammation
|
2.298.492
|
|
S11
|
Constipation
|
280.723
|
|
S10
|
Diarrhea
|
958.432
|
|
S9
|
DIET
|
4.720.039
|
|
S8
|
FODMAP diet
|
4.223
|
|
S7
|
#1 OR #2 OR #3 OR #4
OR #5 OR #6
|
92.552.914
|
|
S6
|
“inflammatory
bowel disease”
|
245.005
|
|
S5
|
“irritable bowel
syndrome”
|
129.194
|
|
S4
|
Human
|
41.046.765
|
|
S3
|
User
|
22.433.105
|
|
S2
|
Patients
|
26.813.689
|
|
S1
|
Adult
|
22.076.150
|
|
**Aplicando filtro
por artículo quedan el 1485.
|
MATERIAL
SUPLEMENTARIO Nº3 - FLOREST PLOT DE LAS VARIABLES META ANALIZADAS REVIEW
MANAGER.
Gastrointestinal
disorders (alteraciones gastrointestinales)
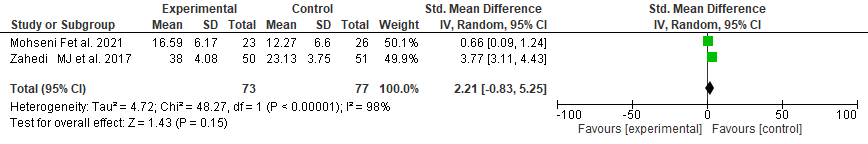

Abdominal
distension (distensión abdominal)


Visceral
hypersensitivity (hipersensibilidad visceral)


Alterations
in depositional habit


Normal gas
transit (transito normal de gases)


Abdominal
pain (dolor abdominal)


![]() *,
Ninoska Leiva1
*,
Ninoska Leiva1 ![]() *,
María San Martin1
*,
María San Martin1 ![]() *,
Gabriela Pedraza1
*,
Gabriela Pedraza1 ![]() *
*![]()














