REVISIÓN BIBLIOGRÁFICA
El rol del intestino como diana con papel terapéutico en personas con enfermedades neurodegenerativas
The role of the intestine as a target with a therapeutic role in people with neurodegenerative diseases
María Paz Valdivieso Castro1 ![]() *, Julio Cesar Ojeda Sánchez1
*, Julio Cesar Ojeda Sánchez1 ![]() *, Jorge Eduardo Ochoa Aucay1
*, Jorge Eduardo Ochoa Aucay1 ![]() *
*
1 Universidad Católica de Cuenca, Cuenca, Ecuador.
Citar como: Valdivieso Castro MP, Ojeda Sánchez JC, Ochoa Aucay JE. El rol del intestino como diana con papel terapéutico en personas con enfermedades neurodegenerativas. Salud Cienc. Tecnol. 2023;3:310. https://doi.org/10.56294/saludcyt2023310
Enviado: 30-01-2023 Revisado: 18-02-2023 Aceptado: 04-03-2023 Publicado: 05-03-2023
Editor: Prof.
Dr. William Castillo-González ![]()
RESUMEN
Existe un intercambio de papeles conocido como red bidireccional entre el cerebro e intestino con varias conexiones que incluyen el nervio vago, el sistema inmune, metabolitos y productos bacterianos, durante la disbiosis, se produce alteración de la permeabilidad de la barrera hematoencefálica y neuroinflamación. Esta revisión tuvo como objetivo describir el rol de la microbiota intestinal y su papel terapéutico en enfermedades neurodegenerativas. El eje microbiota-intestino-cerebro incluye como tal un conjunto de microorganismos entre ellos bacterias (Lactobacillus y S. Aureus) de los más comunes, hongos y virus por demás que cumplen un papel importante cuando hablamos del intestino, entre sus funciones está proteger al intestino como efecto barrera y no permitir el paso de bacterias o en si patógenos externos al intestino, también de metabolizar carbohidratos y la producción de vitamina K, B12, B7, sin embargo cuando está microbiota se ve alterada debido al estrés, la dieta o algún otro factor la comunicación mediantes vías ascendentes provoca alteraciones en la respuesta inmunitaria, la endocrina y la nerviosa.
Palabras clave: Intestino; Microbiota; Terapéutica; Enfermedad Neurodegenerativa.
ABSTRACT
There is a bidirectional exchange known as the gut-brain axis with several connections including the vagus nerve, the immune system, metabolites, and bacterial products. During dysbiosis, there is an alteration of the blood-brain barrier permeability and neuroinflammation. The objective of this review was to describe the role of the gut microbiota and its therapeutic role in neurodegenerative diseases. The gut microbiota-brain axis includes a set of microorganisms including common bacteria (Lactobacillus and S. aureus), fungi, and viruses that play an important role in gut function, such as barrier protection and preventing the passage of bacteria or pathogens from outside the gut, as well as metabolizing carbohydrates and producing vitamins K, B12, and B7. However, when the gut microbiota is altered due to stress, diet, or other factors, communication through ascending pathways can lead to alterations in the immune, endocrine, and nervous responses.
Keywords: Gut; Microbiota; Therapeutics; Neurodegenerative Disease.
INTRODUCCIÓN
Existe un intercambio de papeles conocido como red bidireccional entre el cerebro e intestino con varias conexiones que incluyen el nervio vago, el sistema inmune, metabolitos y productos bacterianos, durante la disbiosis, se produce alteración de la permeabilidad de la barrera hematoencefálica y neuroinflamación.(1) La microbiota del intestino hospeda un billón de microorganismos, bacterias anaerobias, aerobios como Escherichia coli y lactobacillus entre los más comunes,(2) hongos y virus que permiten la recuperación de la energía metabólica, los nutrientes y además la defensa del huésped, contra una invasión de microorganismos externos.(3)
El “eje microbiota-intestino-cerebro” es un sistema de comunicación bidireccional regulado por sistema nervioso, inmunológico, y endocrino en el cual los microorganismos cumplen un papel complejo. Mediante el sistema nervioso entérico se controla a las secreciones del tracto digestivo, movimientos, flujo sanguíneo, y mucosa de influencia en la flora intestinal, este sistema se une al sistema nervioso central por el nervio vago mediante señales neuroquímicas bidireccionales.(4)
La flora del intestino genera ácido acético propiónico y butírico que controla y regula la microbiota intestinal mediante inmunidad y fluidos corporales permitiendo un equilibrio dinámico del mismo.(5)
Las enfermedades neurodegenerativas se conforman por un grupo heterogéneo de síntomas con un común denominador, la afectación del sistema nervioso central mediante la disminución neuronal progresiva y disfunción neuronal con inicio en áreas específicas y posterior progresión, siendo las más frecuentes la enfermedad de Alzheimer y Parkinson.(6)
Análisis con 157 estudios epidemiológicos entre el año 1980 y 2009 a nivel mundial se determinó que la prevalencia de la demencia está entre 5-8 por ciento en personas mayores de 60 años, con un incremento de acuerdo a la edad y predominio en mujeres.(7) En cuanto a la enfermedad de Alzheimer, otro metaanálisis que incluyó ocho estudios europeos mostró predominio en el sexo femenino (7,1:3,3) y aumento con la edad llegando hasta el 22,5 % en personas mayores 85 años.(8)
Los datos que revela el estudio EURODEM mostraron una tasa de incidencia de 1,3/1000 individuos al año,con mayor riesgo en el grupo de edad entre 65-69 años y 24/1000 individuos al año personas mayores de 90 años. En el estudio NEDICES (neurological Disorders in Central Spain) de España mostró una incidencia de 1,4/ 1 000(9) individuos al año a partir de los 65 años en adelante.(7)
La composición del microbioma no es estática, debe adaptarse a su entorno y a las funciones que realiza. Cuando hay un desequilibrio, se facilita el desarrollo de enfermedades neurodegenerativas, por esto, si llegamos a comprender a la microbiota intestinal y su papel desde la perspectiva neuroinmunoendocrinológica, junto con factores epigenéticos como alimentación, edad y uso de antibióticos, construimos bases para futuras investigaciones y con ello potenciales curas para este tipo de enfermedades.(10)
Al describir el rol del intestino como plan terapéutico en personas con enfermedades neurodegenerativas en relación con la función que cumple la microbiota con el cerebro mediante el mecanismo que interfiere el intestino en enfermedades como la enfermedad del alzheimer y parkinson.
MÉTODOS
Se realizó una revisión bibliográfica basada en búsqueda sistemática.
Se determinará con la búsqueda sistemática con la ayuda de las bases de datos científicas open access: Hindawi, Pubmed apoyándonos en la metodología PRISMA. Se realizó una búsqueda mediante descriptores bibliográficos como DECS y MESH, conectores como “and, or, not” con palabras clave como: Intestino-microbiota-terapéutico-Neurodegenerative que permita mejorar la búsqueda.
La búsqueda se limitó al periodo comprendido desde el 2012 hasta enero 2023. Los datos que se procesaron mediante cuadro de síntesis de resultados que incluirán títulos, los autores, el año, lugar, población y las conclusiones en los mismos.
Se incluyeron artículos primarios y secundarios, y se excluyen, presentación de casos clínicos, cartas al editor, y tesis de grado. Los artículos finalmente incluidos fueron 17 (Figura 1).
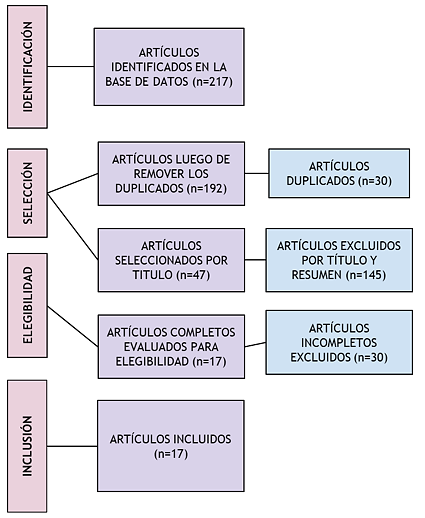
Figura 1. Flujograma PRISMA
RESULTADOS Y DISCUSIÓN
Gran parte de la literatura actual apoya la teoría que describe al microbioma intestinal como un adaptador principal del “eje microbiota- intestino- cerebro” influyendo de manera decisiva en la comprensión de la fisiopatología intestinal y sus manifestaciones en las funciones cerebrales.(9,11) Microflora intestinal alberga un conjunto de microorganismos abundantes y diversos con un gran impacto sobre la homeostasis y la inmunidad intestinal.(7)
La Tabla 1 muestra los principales resultados y conclusiones de los estudios incluidos en la revisión.
|
Tabla 1. Principales resultados y conclusiones de los estudios incluidos |
||
|
Autor, lugar |
Año |
Resultado |
|
Quigley EMM.(23), Estados Unidos |
2017 |
Los modelos de animales que han sido utilizados para estudio han respondido a los estudios con una microbiota intestinal alterada en varios trastornos del sistema nervioso central incluyendo EP Y EA. Sin embargo, los estudios en seres humanos son escasos. |
|
Cryan JF et al.(19), Suecia |
2019 |
El cerebro y la microbiota se van a comunicar entre ellos mediante varias vías, incluyendo el sistema inmunitario, metabolismo de triptófanos, SNE y nervio vago, entre ellos involucrados los metabolismos microbianos (SCFA, aminoácidos de cadena ramificada y peptidoglicanos). |
|
Socala K et al.(20), Polonia |
2021 |
El papel que cumple la microbiota intestinal en la comunicación bidireccional entre el cerebro y el intestino plantea que los microorganismos intestinales pueden dar paso al desarrollo neuronal, la neurotransmisión y de esta manera afectar al comportamiento y con ello la patogénesis, trastornos neurológicos y neuropsiquiatras. |
|
Tonini et al.(24), Brasil |
2020 |
Se sabe que la comunicación bidireccional entre el intestino y el cerebro se produce a través del nervio vago, el sistema nervioso entérico (ENS), el eje hipotálamo-pituitario-suprarrenal (HPA), los neurotransmisores y las vías inmunitarias. Nueve de los 10 estudios analizados demostraron la eficacia de los probióticos en la reducción de los síntomas depresivos. Los probióticos más utilizados en los estudios fueron Lactobacillus, Bifidobacterium y Lactococcus lactis W19, que ayudaron a reducir la inflamación de manera exponencial. |
|
Rutsch et al.(1), Alemania |
2020 |
La microbiota entra en contacto con el sistema inmunitario en los sitios de la mucosa, dando paso de la tolerancia inmunitaria a los microbios comensales y equilibrando la integridad de la mucosa al mismo tiempo. Además, se ven afectados los órganos distales entre ellos y principalmente, el cerebro, en particular, sufre cambios dramáticos en etapas tempranas de vida. |
|
Fung TC(2), Estados Unidos |
2020 |
Los trastornos inflamatorios intestinales se asocian con síntomas neuro fisiológicos y conductuales. No obstante, muchos trastornos del SNC se acompañan de complicaciones intestinales. Estas observaciones sugieren que la fisiología intestinal y del sistema nervioso están relacionadas funcionalmente. |
|
Kim & Shin(3), Corea del Sur |
2018 |
Los estudios de las investigaciones en neurociencia sugieren que los microorganismos intestinales son fundamentales para el desarrollo y para la maduración de los sistemas cerebrales relacionados a una respuesta derivada del estrés. |
|
Almaguer Mederos et al.(21), Cuba |
2018 |
El PMH manifestó ciertas relaciones que no eran conocidas antes entre el humano y la microbiota del mismo e insinúa la influencia del microbioma en distintos eventos y procesos biológicos que se ven involucrados en salud y enfermedad del hombre. |
|
Richarte et al.(10), España |
2018 |
La colonización de las bacterias que están en el tracto gastrointestinal depende de distintos factores, que incluye el parto y método de alimentación posparto |
|
Garre.(7), España |
2019 |
La modificación de la permeabilidad del intestino, ya que un incremento de su permeabilidad entre células del epitelio del intestino permite que productos bacterianos, citocinas y quimiocinas crucen a la circulación y a la barrera hematoencefálica contribuyendo a la inflamación sistémica, por demás la alteración de BHE y por ende, la neuroinflamación. |
|
Șchiopu et al.(11), Rumania |
2022 |
Mediante la vía simpática y parasimpática se da una regulación y la influencia bidireccional en cuanto a cognición, emoción y comportamiento además de la funcionalidad del sistema gastrointestinal con sus roles como digestión, absorción y sistema de inmunidad entérico. |
|
Guillot.(27), Ecuador |
2018 |
Los simbióticos son una combinación de probióticos y prebióticos. Tienen un efecto modulador característico sobre la microbiota intestinal. Se ha demostrado que aumentan la tasa de supervivencia de los probióticos en el tracto GI superior. La leche materna es un simbionte notable porque contiene bacterias del ácido láctico y bifidobacterias (bacterias del ácido láctico). La modulación de la microbiota intestinal actualmente parece ser una estrategia terapéutica novedosa. |
|
Suganya et al.(12), Corea del Sur |
2020 |
Estudios han demostrado que la microbiota intestinal influye en el desarrollo, la función y los trastornos del sistema nervioso central y del sistema nervioso a través de la interacción y activación de los receptores de reconocimiento de patrones, como los receptores tipo Toll 2 y 4 (TLR2) y TLR4. La disbiosis intestinal y la pérdida asociada de la integridad de la barrera intestinal y la permeabilidad intestinal permiten una mayor translocación de metabolitos derivados de bacterias intestinales y patrones moleculares asociados a microbios, en el tejido linfoide mesentérico, lo que lleva a la progresión y el desarrollo de diversas enfermedades del sistema nervioso. |
|
Wang et al.(13), China |
2019 |
Se ha demostrado que una restauración de la disbiosis del microbioma inducido por diversos factores por medio de la administración de probióticos o FMT de bacterias comensales del intestino permite la restauración de funciones de inmunidad adaptativa que se ven suprimidas en humanos y ratones. |
|
Andreo-Martínez et al.(29), España |
2019 |
La disbiosis del microbioma o algún problema en la flora intestinal pueden inducir una inflamación en el intestino que se verá asociada con la obesidad, la DM2 y Alzheimer. |
|
Garre Olmo.(8), Taiwan |
2018 |
La demencia es una enfermedad rara sindrómica, donde se subdivide en varios tipos y difiere por su etiología, presentación, el curso clínico y trastornos asociados. |
|
Gomez-Eguilaz et al.(9), Taiwan |
2019 |
El eje de la microbiota-intestino-cerebro se dirige como una posible cimiento patogénico de enfermedades neurológicas de gran impacto como EA, EP o esclerosis múltiple. |
|
Takiishi et al. (14), Brasil |
2017 |
El tracto gastrointestinal es considerado el órgano inmunitario más grande del cuerpo y cumple un papel central en la regulación de la homeostasis inmunitaria. Contrariamente a las suposiciones anteriores, la barrera epitelial intestinal no es una barrera física estática, sino que interactúa fuertemente con el microbioma intestinal y las células del sistema inmunitario. |
|
Pavón Fuentes et al.(16), Cuba |
2019 |
Las células T activadas pueden causar daño neuronal a través de contactos célula-célula. La α-sinucleína puede desempeñar un papel en la activación microglial observada y el aumento de la expresión de moléculas MHC-II en la SNpc. |
|
Chen et al.(8), Taiwan |
2022 |
La herencia genética del Parkinson con respecto a respuestas inmunitarias, y la mala función mitocondrial conducirá a neuronas vulnerables que son sensibles a los factores ambientales y, con ello una degeneración neuronal. |
|
Mulak et al.(17), Francia |
2017 |
La EP se va a caracterizar por a-sinucleinopatía que afecta todos las estructuras del eje cerebro-intestino, incluyendo los SNCl, SNA y SNE. |
La mayoría de estos microorganismos que predominan y regulan la fisiología del huésped son parte del tracto digestivo normal, lo que se le conoce como microflora comensal. Entre sus funciones incluye nutrición y metabolismo, ya que la flora entérica cumple su función metabolizando sustratos de alimentos no digeribles, moco endógeno y detritus celulares (desechos celulares).(12)
En el ciego y colon derecho tendrá pasó la fermentación de hidratos de carbono no digeribles por el anfitrión, esto funciona como una fuente de energía importante necesaria para la proliferación bacteriana y producción de AAGC que el hospedador puede absorber (conocido como recuperación de energía) se da también absorción de iones; calcio, magnesio y el hierro en el ciego. Además, producción de vitaminas K, B12, B7 (biotina), B5 (ácido pantoténico) y ácido fólico.(13)
Entre las funciones de protección se habla del efecto de barrera por la función defensiva, mientras hay un equilibrio entre las bacterias residentes esto confiere firmeza al conjunto de la población microbiana. Funciones tróficas: proliferación celular y la diferenciación de células epiteliales.(14)
El Sistema Nervioso Autónomo (SNA) permite la homeostasis del tracto gastro intestinal, a través del eje neuroendocrino y por ende obtiene respuesta del intestino como su permeabilidad, movimiento, mucosa y respuestas inmunes del intestino, que forman parte de la vía eferente. Las señales locales, como ansiedad, la disbiosis y el dolor, es decir un factor externo, van a ser moduladas y transmitidas al sistema nervioso central como vías aferentes mediante el sistema simpático y parasimpático dando como efecto respuestas en áreas cerebrales conectadas.(15)
La principal vía de comunicación que existe entre estos sistemas es el nervio vago, que actúa transportando señales desde la microbiota y estímulos de alteración, además de dirigir respuestas desde el cerebro con activación directa de ganglios vagales después de la inoculación intestinal que se demostró en ratones modelo y su conectividad con la ansiedad con respuestas inflamatorias. Estas vías aferentes transmiten la información mediante una densidad de fibra desde el duodeno hacia el colon transverso. El SNA se encuentra en conexión con el Sistema Nervioso Entérico (SNE) el que activan los reflejos vago-vagales que regulan la motilidad, el equilibrio de la microflora y la función de la mucosa.
El tejido intestinal que es una capa de mucosa densa cumple un papel importante al ser protector y centro de coordinación entre la luz intestinal y el ambiente interno, el sistema inmunitario entérico distingue los autoantígenos y elimina las posibles amenazas de microorganismos extraños, también cuenta con mecanismos que podrían acatar y provocar respuestas inflamatorias.
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo que se caracteriza por neuroinflamación y pérdida de neuronas dopaminérgicas.(16) Se ha descubierto que células específicas en el epitelio intestinal (enteroendocrinas) contienen propiedades parecidas a las neuronas entre estas la expresión de la alfa-sinucleína ya que al ser esta una proteína mal plegada permite la formación de cuerpos de lewy característico de esta patología y su acumulación anómala, lo que nos conduce a pensar en la progresión de la enfermedad.(17) Debido a su contacto con la luz del intestino y al estar conectadas simpáticamente las neuronas entéricas, las células enteroendocrinas crean un circuito neural que irá entre el tracto gastrointestinal con el SNE.(8)
La flora microbiana patógena produce aminoácidos tóxicos (isoleucina, fenilalanina) que inducen la estimulación de linfocitos tóxicos, como son los linfocito T helper (Th1), y bacterias de crecimiento extracelular (Th17) en sangre periférica. Estas células pasan la BHE produciendo una reacción neuroinflamatoria en el cerebro. Activan a células de la microglía para producir neuroinflamación y activan la producción de amiloide y fosfo-tau, todo ello considerado inductor de neurodegeneración Alzheimer.(13,18)
En una revisión sistemática se concluyó que tanto el cerebro como la microbiota se ven comunicados entre ellos, su concurrencia es gracias a vías, donde interviene el sistema inmunitario, metabolismo de triptófanos, sistema nervioso entérico y nervio vago, que es de la vía más indispensable para el mecanismo de este eje, involucrando a los metabolitos microbianos como SCFA, aminoácidos de cadena ramificada y los peptidoglicanos.
El estrés y la inflamación cuentan con papeles clave en la fisiopatología de las enfermedades en las que la microflora se puede desempeñar. El estrés interviene en la depresión, en trastornos psiquiátricos como la esquizofrenia y trastorno del espectro autista, la migraña y epilepsia, sin embargo, hay que tomar en cuenta que la inflamación es el desencadenante y por tanto importante en los trastornos mencionados anteriormente añadiendo la Enfermedad de Parkinson y la enfermedad del alzheimer.
Rutsch et al. (1) y Almaguer Mederos et al. (21), plantean que el contacto de la microflora intestinal con el sistema inmunitario en los sitios de mucosa dando paso de tolerancia inmunitaria a microbios comensales, es decir, del huésped y equilibrando la integridad de la mucosa al mismo tiempo.
Lotti-Mesa & Gutierrez-Gacel (22) por su parte mencionan que a pesar de ello cuando una de estas vías se ve alterada los órganos más afectados son los órganos distales entre ellos, primordialmente el cerebro, en particular ya que sufre cambios dramáticos en etapas tempranas de la vida, donde también se verá influenciado el surgir de la microbiota intestinal como tal.
En los últimos años se ha vuelto evidente que los microorganismos pueden también producir moléculas neuroactivas que se atribuyen de manera directa a la comunicación que se da entre el intestino y cerebro. Los neurotransmisores que intervienen es la acetilcolina, el GABA y la serotonina que son precedidos por bacterias que corresponden a especies lactobacillus, bifidobacterium, Enterococcus y Streptococcus, donde influyen directa e indirectamente en la fisiología de células del cerebro.
Añade Rutsch, que en un 90 % de la serotonina es requerida para el estado de ánimo, para el sueño, el comportamiento y distintas funciones que se den dentro del sistema nervioso central y el tracto gastrointestinal, se van a producir en el intestino.
Contrario a los resultados de estudios anteriores Quigley(23) determinaron que en modelos de animales como los ratones que tienen una microbiota intestinal alterada se ven relacionados con trastornos del sistema nervioso central entre ellos la Enfermedad de Parkinson y Alzheimer, no obstante, estudios en humanos son escasos y sin datos de relevancia.
Fung et al.(2) afirman que la enfermedad inflamatoria intestinal al ser una infección inflamatoria crónica donde se verá afectado el tracto digestivo y su etiología es multifactorial, está es una de las múltiples enfermedades que se están asociadas directamente con la microbiota, su función causal de la microflora en la enfermedad inflamatoria intestinal que ha sido la más reconocida. Los microbios del intestino son impulsores de inflamación intestinal ya de manera patológica gracias a la ruptura de mecanismos físicos y también inmunitarios que sostienen la separación entre microbios intestinales y el sistema de inmunidad del huésped y la relación que mantiene esto con las enfermedades neurodegenerativas.
Un elemento novedoso reportado por Tonini et al.(24), señala que la comunicación bidireccional que existe entre el intestino y el cerebro se da gracias a la acción del nervio vago, el sistema nervioso entérico, el eje hipotálamo pituitario suprarrenal, neurotransmisores y sistema inmunitario, nueve de los diez estudios que han sido analizados demuestran una gran eficacia de los probióticos en cuanto a la reducción de síntomas depresivos y la inflamación de manera excepcional, de los más utilizados fue lactobacillus, bifidobacterium y lactococcus lactis W19.
Kim et al.(3) sugieren que microorganismos del intestino son de existencia fundamental para el desarrollo y maduración de sistemas cerebrales que van a verse relacionados a una respuesta derivada del estrés.
Entre sus mecanismos lo alude, Richarte et al.(10) se encuentra la modificación de la permeabilidad del intestino, ya que un incremento de su permeabilidad permite que productos bacterianos, citocinas y quimiocinas crucen a la circulación y a la barrera hematoencefálica contribuyendo a la inflamación sistémica, por demás la alteración de BHE y por ende, la neuroinflamación.
La noradrenalina, dopamina y la serotonina con precursores como fenilalanina que su exceso puede aumentar el estrés oxidativo y alteración del metabolismo, tirosina y triptófano, análogos en estructura a los del SN del huésped. Provienen de la microbiota y permite la absorción del mismo a través del epitelio intestinal, también le permite entrar a la circulación y pasar la barrera.
Șchiopu et al.(11) atribuyen a partir de criterios ROMA IV, que el mecanismo por el que se verá relacionado el microbioma intestinal con el cerebro será mediante el nervio vago, igualmente reacciones neuronales, inmunitarias metabólicas y hormonales. Incluye 3 centros del eje, el sistema nervioso autónomo que conserva la homeostasis del tracto gastrointestinal de señales endocrinas, conductuales y motoras permitiendo vigilar la información que recepta del sistema nervioso central y el eje neuroendocrino asegurado la respuesta intestinal en sentido de permeabilidad, la motilidad y el estado de la mucosa. También se demostró que interactúan con este sistema el triptófano, catecolaminas y serotonina y su influencia sobre las vías que van a inducir cambios cognitivos.
Afirmando por sus revisiones de estudios entre los mecanismos de neuro-inmunidad que una deficiencia de linfocitos resulta en trastornos cognitivos y también ansiedad que serían tratados con probióticos de especies de lactobacillus, y además añade Suganya et al.(12) que la microbiota del intestino interviene en el proceso, función y trastornos del sistema nervioso central y el sistema nervioso entérico por medio de la interacción y la activación de receptores de reconocimiento de patrones, los llamados PRR, como son los receptores tipo Toll dos y cuatro ( TLR2, TLR4), cuando hay el intercambio de papeles, es decir la disbiosis intestinal y con ello la pérdida que se asocia a la integridad de la barrera como tal del intestino, la permeabilidad del mismo van a permitir una mayor translocación de metabolitos proceden de las bacterias intestinales y patrones relacionados a microbios en tejidos linfoides mesentéricos lo que se corresponde con distintas enfermedades neurológicas como la Enfermedad de Parkinson y la Enfermedad del Alzheimer.
Respecto a la inmunidad adaptativa, Wang et al.(25) y Caputi et al.(26) opinan que no solo interviene receptores tipo toll sino además las Th17 que son esenciales con respecto a la defensa contra los patógenos. Sobre todo, en casos de infecciones bacterianas y fúngicas. También son importantes para la producción de Inmunoglobulina A específica de bacterias de alta afinidad. De la misma manera los Tfh (células foliculares T intestinales), que estimulan la producción de células de alta afinidad.
Como algo novedoso, Guillot(27) concluye que los simbióticos son una combinación entre los probióticos y los prebióticos que se caracteriza por el efecto modulador de la microflora intestinal. Estos son necesarios y por tanto son indicados para ayudar a mejorar la supervivencia de los microorganismos ( bacterias) probióticas en el tránsito por el tubo digestivo superior y de esta manera lograr una implantación en el colón de mejor manera y su efecto incitante del proceso de colonización y crecimiento probiótico ya que su sustrato específico es necesario para que inicie el proceso de fermentación intestinal, es por eso que la leche materna es un simbiótico sumamente importante, este contiene lactobacillus y bifidobacterias que son bacterias ácido lácticas.
Adak et al.(28) encontraron que el manejo de la microbiota del intestino es visto como una nueva estrategia de terapia mediante la dieta, probióticos y prebióticos, además de otras rutas, de esta manera se puede tratar las afecciones gastrointestinales y consecuente a esto, enfermedades neurodegenerativas.
En el mismo orden de idea Chen et al.(8), demostraron que la ingestión de 2-fucosil-lactosa como oligosacárido mediante la leche materna, va a tener una acción en el hipocampo que mejora patrones de memoria, la habilidad de aprendizaje y marcadores de plasticidad sináptica cerebral en relación con el eje microbiota-intestinal-cerebro y el nervio vago.
Andreo Martínez et al.(29) encontraron que la microflora intestinal interviene en la generación del GABA del factor neurotrófico que proviene del cerebro, de la serotonina y otras moléculas que son necesarias para el buen funcionamiento del sistema nervioso central. La enfermedad de Parkinson se considera un trastorno del sistema nervioso central que afecta ganglios basales, un término acuñado a partir del uso al referirse al núcleo gris en la base del cerebro. Durante el curso de la enfermedad, más causan síntomas motores en lugar del sistema nervioso motor.
Pavón Fuentes et al.(16) utilizando la tomografía por emisión de positrones probaron que los pacientes con Enfermedad de Parkinson tiene un aumento significativo de los marcadores de inflamación neuronal en las zonas del puente, ganglios basales, cuerpo estriado y corteza frontal y temporal, a diferencia con controles de igual edad. La alteración de la alfa-sinucleína puede deberse a genes que codifican está proteína, puede ser por mutaciones en el cromosoma 4q o la aparición de una copia extra que no está mutada del gen de la alfa sinucleína. Esto se encadena a la microbiota intestinal pues los microorganismos que se encuentran en ella afectan directamente a la función del cerebro por su regulación a respuestas inmunitarias, permeabilidad intestinal y los ácidos grasos de cadena corta (AAGC) que se dan por la acción de estos microbios del intestino. Estos ácidos actúan como energía para las células que van a cubrir el epitelio del colon llamados colonocitos y sobre todo regulan la barrera intestinal influyendo en las respuestas inflamatorias.
Según Suganya et al.(18) y Chen et al.(8), afirman que el intestino se va a generar una continuidad de productos dados por la microbiota intestinal donde ejercen su influencia sobre el sistema nervioso central, como los ácidos grasos de cadena corta, los ácidos biliares secundarios o los metabolitos del triptófano, estos hacen su acción de 2 formas, la primera que es disparando señales ascendentes que se activan a nivel local o atravesando la barrera del intestino para poder pasar hacia la circulación sistémica, inclusive queriendo actuar sobre el sistema nervioso central tras haber atravesado la barrera hematoencefálica (BHE).
Mulak et al.(17) mencionan que los ácidos grasos de cadena corta son metabolitos microbianos del intestino, son de importancia ya que se producen a partir de la fermentación de las fibras dietéticas en el tubo digestivo. Acetato, Butirato y propionato que son los principales ácidos grasos dados por bacteroidetes y Firmicutes. Después de esto se da la absorción inmediata en la circulación portal y se transfiere a tejidos periféricos incluyendo el cerebro donde este ejecuta un papel crucial en cuanto a la regulación de las funciones neurológicas
Wang et al.(30) reportan como factores de riesgo para que se presente la Enfermedad del Alzheimer es la presentación de la fenilalanina e isoleucina induce a la diferenciación y proliferación de células proinflamatorias (T helper 1); mientras que Pluta et al.(31), reporta que las células inmunitarias Th1 periféricas que se encuentran en el cerebro al estar mezcladas con la activación de la microglía, dando por efecto la neuroinflamación que se ve asociada a la Enfermedad del Alzheimer.
Limitaciones de estudio
La principal limitación de esta revisión es el hecho que se encontraron estudios principalmente sobre enfermedades neurodegenerativas como la enfermedad de Alzheimer y el Parkinson.
CONCLUSIONES
El eje microbiota-intestino-cerebro incluye como tal un conjunto de microorganismos entre ellos bacterias (Lactobacillus y S. Aureus) de los más comunes, hongos y virus por demás que cumplen un papel importante cuando hablamos del intestino, entre sus funciones está proteger al intestino como efecto barrera y no permitir el paso de bacterias o en si patógenos externos al intestino, también de metabolizar carbohidratos y la producción de vitamina K, B12, B7, sin embargo, cuando la microbiota se ve alterada a causa del estrés, la dieta (principalmente con el consumo de alimentos que contienen fenilalanina o isoleucina) o algún otro factor que daña la flora del intestino este se comunicará con diferentes vías ascendentes para transmitir la información al sistema inmunitario, la endocrino y la nervioso.
Los neurotransmisores como la serotonina y el GABA que detectan y lo responden a manera de inflamación en el caso de la enfermedad del Alzheimer o un aumento de cuerpos de Lewy en la Enfermedad de Parkinson. Basado en estos hallazgos se puede afirmar que si tratamos desde el mejoramiento de la salud del intestino y específicamente la forma en que nos alimentamos (probióticos, prebióticos, simbióticos) la capacidad para realizar de manera correcta las funciones de la misma estarán fortalecidas.
REFERENCIAS BIBLIOGRÁFICAS
1.Rutsch A, Kantsjö JB, Ronchi F. The Gut-Brain Axis: How Microbiota and Host Inflammasome Influence Brain Physiology and Pathology. Front Immunol. 2020;11:604179. https://doi.org/10.3389/fimmu.2020.604179
2. Fung TC. The microbiota-immune axis as a central mediator of gut-brain communication. Neurobiol Dis. 2020;136:104714. https://doi.org/10.1016/j.nbd.2019.104714
3. Kim YK, Shin C. The Microbiota-Gut-Brain Axis in Neuropsychiatric Disorders: Pathophysiological Mechanisms and Novel Treatments. Curr Neuropharmacol. 2018;16(5):559-73. https://doi.org/10.2174/1570159X15666170915141036
4. Ma Q. Impact of microbiota on central nervous system and neurological diseases: the gut-brain axis. J Neuroinflammation. 2019;16:53. https://doi.org/10.1186/s12974-019-1434-32019
5. Chudzik A, Orzyłowska A, Rola R, Stanisz GJ. Probiotics, Prebiotics and Postbiotics on Mitigation of Depression Symptoms: Modulation of the Brain–Gut–Microbiome Axis. Biomolecules. 2021;11(7):1000. https://doi.org/10.3390/biom11071000
6. Lacovich V, Espindola SL, Alloatti M, Devoto VP, Cromberg LE, Cˇarna ME, et al. Tau Isoforms Imbalance Impairs the Axonal Transport of the Amyloid Precursor Protein in Human Neurons. 2017;37(1):58–69. https://doi.org/10.1523/JNEUROSCI.2305-16.2016
7. Garre Olmo J. Epidemiología de la enfermedad de Alzheimer y otras demencias. Rev Neurol. 2018;66(11):377. https://doi.org/10.33588/rn.6611.2017519
8. Chen SJ, Lin CH. Gut microenvironmental changes as a potential trigger in Parkinson’s disease through the gut–brain axis. J Biomed Sci. 2022;29(1):54. https://doi.org/10.1186/s12929-022-00839-6
9. Gómez Eguílaz M, Ramón Trapero JL, Pérez Martínez L, Blanco JR. El eje microbiota-intestino-cerebro y sus grandes proyecciones. Rev Neurol. 2019;68(03):111. https://doi.org/10.1186/s12929-022-00839-6
10. Richarte V, Rosales K, Corrales M, Bellina M, Fadeuilhe C, Calvo E, et al. El eje intestino-cerebro en el trastorno por déficit de atención/hiperactividad: papel de la microbiota. Rev Neurol. 2018;66(S01):109. https://doi.org/10.33588/rn.66S01.2017525
11. Șchiopu CG, Ștefănescu C, Boloș A, Diaconescu S, Gilca-Blanariu GE, Ștefănescu G. Functional Gastrointestinal Disorders with Psychiatric Symptoms: Involvement of the Microbiome–Gut–Brain Axis in the Pathophysiology and Case Management. Microorganisms. 2022;10(11):2199. https://doi.org/10.3390/microorganisms10112199
12. Suganya K, Koo BS. Gut–Brain Axis: Role of Gut Microbiota on Neurological Disorders and How Probiotics/Prebiotics Beneficially Modulate Microbial and 19 Immune Pathways to Improve Brain Functions. Int J Mol Sci. 2020;21(20):7551. https://doi.org/10.3390/ijms21207551
13. Wang X, Sun G, Feng T, Zhang J, Huang X, Wang T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression. Cell Res. 2019;29(10):787-803. https://doi.org/10.1038/s41422-019-0216-x
14. Takiishi T, Fenero CIM, Câmara NOS. Intestinal barrier and gut microbiota: Shaping our immune responses throughout life. Tissue Barriers. 2017;5(4):e1373208. https://doi.org/10.1080/21688370.2017.1373208
15. Strandwitz P. Neurotransmitter modulation by the gut microbiota. Brain Res. agosto de 2018;1693:128-33. https://doi.org/10.1016/j.brainres.2018.03.015
16. Pavón FN, Lorigados PL. Neuroinflamación y Enfermedad de Parkinson. Cuba y Salud. 2019;14(3):44-49.
17. Mulak A. Brain-gut-microbiota axis in Parkinson’s disease. World J Gastroenterol. 2015;21(37):10609. https://doi.org/10.3748%2Fwjg.v21.i37.10609
18. Suganya K, Koo BS. Gut–Brain Axis: Role of Gut Microbiota on Neurological Disorders and How Probiotics/Prebiotics Beneficially Modulate Microbial and Immune Pathways to Improve Brain Functions. Int J Mol Sci. 2020;21(20):7551. https://doi.org/10.3390/ijms21207551
19. Cryan JF, O’Riordan KJ, Cowan CSM, Sandhu KV, Bastiaanssen TFS, Boehme M, et al. The Microbiota-Gut-Brain Axis. Physiol Rev. 2019;99(4):1877-2013. https://doi.org/10.1152/physrev.00018.2018
20. Socała K, Doboszewska U, Szopa A, Serefko A, Włodarczyk M, Zielińska A, et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacol Res. 2021;172:105840. https://doi.org/10.1016/j.phrs.2021.105840
21. Mederos LEA, Martínez WM, Hevia DG. Implicaciones de la microbiota intestinal en la etiología y terapéutica de la enfermedad de Parkinson. Revista Habanera de Ciencias Médicas. 2018;17(1): 48-57.
22. Lotti Mesa RL, Gutiérrez Gacel L. El eje microbiota-intestino-cerebro, futura diana terapéutica en enfermedades neurodegenerativas. Rev Neurol. 2019;69(01):43. https://doi.org/10.33588/rn.6901.2019159
23. Quigley EMM. Microbiota-Brain-Gut Axis and Neurodegenerative Diseases. Curr Neurol Neurosci Rep. 2017;17(12):94. https://doi.org/10.1007/s11910-017-0802-6
24. Tonini IG de O, Vaz DSS, Mazur CE. Eixo intestino-cérebro: relação entre a microbiota intestinal e desordens mentais. Res Soc Dev. 2020;9(7):e499974303. https://doi.org/10.33448/rsd-v9i7.4303
25. Wang L, Zhu L, Qin S. Gut Microbiota Modulation on Intestinal Mucosal Adaptive Immunity. J Immunol Res. 2019;2019:1-10. https://doi.org/10.1155%2F2019%2F4735040
26. Valdés Fernández MV, Rodríguez González M, Olivé González E. Comportamiento clínico de la sepsis nosocomial en CIREN, año 2006. Medwave. 2007; 7(7):2727. http://doi.org/10.5867/medwave.2007.07.2727
27. Castañeda GC. Microbiota intestinal y salud infantil. Rev Cubana Pediatr. 2018;90(1):94-110.
28. Adak A, Khan MR. An insight into gut microbi ota and its functionalities. Cell Mol Life Sci. 2019;76(3):473-93. https://doi.org/10.1007/s00018-018-2943-4
29. Andreo Martínez P, García Martínez N, Quesada Medina J, Sánchez Samper EP, Martínez González AE. Candida spp. en la microbiota intestinal de las personas con autismo: revisión sistemática. Rev Neurol. 2019;68(01):1. https://doi.org/10.33588/rn.6801.2018129
30. Wang X, Sun G, Feng T, Zhang J, Huang X, Wang T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression. Cell Res. 2019;29(10):787-803. https://doi.org/10.1038/s41422-019-0216-x
31. Pluta R, Ułamek-Kozioł M, Januszewski S, Czuczwar SJ. Gut microbiota and pro/prebiotics in Alzheimer’s disease. Aging. 2020;12(6):5539-50. https://doi.org/10.18632%2Faging.102930
FINANCIACIÓN
Sin financiación.
CONFLICTO DE INTERESES
No existen.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: María Paz Valdivieso, Julio Ojeda, Jorge Ochoa.
Investigación: María Paz Valdivieso, Julio Ojeda, Jorge Ochoa.
Metodología: María Paz Valdivieso, Julio Ojeda, Jorge Ochoa.
Administración del proyecto: María Paz Valdivieso, Julio Ojeda, Jorge Ochoa.
Redacción-borrador original: María Paz Valdivieso, Julio Ojeda, Jorge Ochoa.
Redacción- revisión y edición: María Paz Valdivieso, Julio Ojeda, Jorge Ochoa.