REVISIÓN SISTEMÁTICA
Biomarcadores utilizados para el diagnóstico y pronóstico en lupus eritematoso sistémico
Biomarkers used for the diagnosis and prognostic in systemic lupus erythematosus
Karen Michelle Jaramillo Sancho1 ![]() *, Gabriela Paola Valenzuela Sánchez1
*, Gabriela Paola Valenzuela Sánchez1 ![]() *
*
1Universidad Técnica de Ambato. Facultad de Ciencias de la Salud, Carrera de Laboratorio Clínico. Ambato, Ecuador.
Citar como: Jaramillo Sancho K, Valenzuela Sánchez GP. Biomarcadores utilizados para el diagnóstico y pronóstico en lupus eritematoso sistémico. Salud, Ciencia y Tecnología [Internet]. 20 de junio de 2023 [citado 20 de junio de 2023];3:422. https://doi.org/10.56294/saludcyt2023422
Enviado: 10-05-2023 Revisado: 23-05-2023 Aceptado: 01-07-2023 Publicado: 02-07-2023
Editor: Dr.
William Castillo González ![]()
RESUMEN
Introducción: Lupus Eritematoso Sistémico o también denominado LES es una patología catalogada como autoinmune y crónica donde existe una desregulación del sistema inmune provocando que la presencia de autoanticuerpos ataca al propio organismo. Su sintomatología se clasifica en tipo I y II y se asocia a factores de riesgo como ambientales, genéticos hormonales. Dicha enfermedad lo padecen mayoritariamente mujeres en edad fértil de entre 15 a 45 años, no obstante, es menos frecuentes en niños y hombres.
Objetivo: identificar los biomarcadores que ayudan al diagnóstico y pronóstico en Lupus eritematoso sistémico, describir los criterios de clasificación de LES y métodos inmunológicos para su detección.
Métodos: se realizó una investigación descriptiva mediante la búsqueda de información sobre biomarcadores utilizados para el diagnóstico y pronóstico en lupus eritematoso sistémico a través de bases de datos como Google Académico, Pubmed, Elsevier, SciELO, Redalyc durante el periodo 2015-2023. Las fuentes consultadas fueron un total de 35 utilizando palabras clave como lupus eritematoso sistémico, biomarcadores, anticuerpos utilizados en el diagnóstico de lupus eritematoso sistémico.
Resultados: se estableció que para el diagnóstico de LES se utilizan biomarcadores de detección precoz, confirmación, actividad, inespecíficos y otros biomarcadores que están asociados a esta patología. Mientras que para el pronóstico los biomarcadores de confirmación resultan útiles cuando un paciente ha sido diagnosticado con LES.
Conclusiones: los biomarcadores principales empleados en el diagnóstico y pronóstico de LES son: ANA, anti-dsDNA, anti-SM, anti-RNP, anti-Pribosomal, anti-Ro/SSA y también se encuentran los biomarcadores moleculares miR-196 y miR146, así mismo, criterios como EULAR/ACR-2019 son utilizados en el apoyo diagnóstico.
Palabras clave: Lupus Eritematoso Sistémico; Anticuerpos; Biomarcadores; Diagnostico; Pronóstico.
ABSTRACT
Introduction: Systemic Lupus Erythematosus or also called SLE is an autoimmune and chronic pathology where there is a dysregulation of the immune system causing the presence of antibodies to attack the body itself. Its symptomatology is classified as type I and II therefore, it is associated with risk factors such as environmental, genetic, and hormonal. This disease is mostly suffered by women of childbearing age between 15 and 45 years, however it is less frequent in children and men.
Objective: to identify the biomarkers that help the diagnosis and prognostic in SLE, describe the classification criteria of SLE and immunological methods for its detection.
Methods: a descriptive research was carried out by searching information about biomarkers used for diagnosis and prognostic in systemic lupus erythematosus through databases such as: Google Scholar, Pubmed, Elsevier, Scielo, Redalyc during the period 2015-2023. The sources consulted were a total of 35 using keywords such as systemic lupus erythematosus, biomarkers, antibodies using in the diagnosis of systemic lupus erythematosus.
Results: it was established that for the diagnosis of SLE biomarkers of early detection, confirmation, activity, nonspecific and other biomarkers that are associated to this pathology. While for prognosis, confirmation biomarkers are useful when a patient has been diagnosed with SLE.
Conclusions: the main biomarkers used in the diagnosis and prognostic of SLE are ANA, anti-dsDNA, anti-SM, anti-RNP, anti-Pribosomal, anti-Ro/SSA and there are also the molecular biomarkers miR-196 and miR146, likewise, criteria such as EULAR/ACR-2019 are used in diagnostic support.
Keywords: Systemic Lupus Erythematosus; Antibodies; Biomarkers; Diagnosis; Prognosis.
INTRODUCCIÓN
Lupus eritematoso sistémico por sus siglas (LES) en español o en inglés (SLE) se define como patología autoinmune considerada como inflamatoria y crónica, donde el sistema inmunitario ataca a varios órganos sanos como piel, cerebro, corazón, pulmones, riñones, entre otros.(1) Se relaciona con factores de riesgo, entre ellos genéticos ligados en su mayoría al complejo mayor de histocompatibilidad como HLA-A1, HLA-DR2 y HLA-DR3; ambientales a causa de exposición a luz ultravioleta y tabaquismo. También está asociado a la ingesta de medicamentos relacionados con problemas de corazón e hipertensión, tales como hidralazina y procainamida.(2) Por otro lado, los factores hormonales predisponen a padecer LES debido a que estradiol, testosterona y progesterona modulan la expresión de autoinmunidad.(1)
Se describe que la causa principal a nivel inmunológico es la activación irregular y excesiva de glóbulos blancos como linfocitos T y B y células de tipo inmunitario que se encuentran en los tejidos tales como células dendríticas. Factores ambientales inciden en la célula de manera que existe daño en el ADN, donde se genera apoptosis o denominado “muerte celular programada” lo que provoca que a nivel celular los elementos internos de la célula como citoplasma, núcleo, histonas y proteínas se dirijan hacia el espacio extracelular donde se liberan autoantígenos como Ro/SS-A, DNAdc, nucleosomas que pueden ser procesado por células presentadoras de antígenos y células B. De este modo, los péptidos procesados estimulan las células T y se une a los receptores de antígenos de células B, lo que conduce a la producción de autoanticuerpos que pueden unirse a los antígenos para desencadenar respuestas inmunitarias.(3) Por esta razón, existe la presencia de síntomas tanto de tipo 1 y tipo 2. La sintomatología de tipo 1 se caracterizan por presentar dolor muscular específicamente en articulaciones, hinchazón y sensibilidad. Por otra parte, las manifestaciones de tipo 2 se presentan en periodos de actividad que engloban a fatiga, dolor, trastornos de sueño, depresión y ansiedad.(4)
Esta enfermedad autoinmunitaria lo padecen principalmente mujeres en edad reproductiva en un 90 % entre 15 a 40 años, sin embrago, puede desarrollarse en hombres, niños y adultos mayores. La incidencia de LES a nivel mundial se presenta con una tasa elevada en Polonia con 83,51 por 100 000 casos/año, seguido de Barbados 36,46 por 100 000 casos/año, Estados Unidos 12,35 por 100 000 casos/año y China de 8,5 a 8,7 por 100 000 casos/año.(5)
A nivel de América del Norte se estima que la tasa va de 1,5-7,4 por 100 000 casos/año, mientras que en América del Sur es de 1,4-6,3 por 100 000 casos/años.(6) En este contexto, en Ecuador es poco frecuente su incidencia y prevalencia, sin embargo, existen alrededor de 20 mil personas afectadas con LES.(7)
El diagnóstico constituye la exploración de las diferentes características clínicas, signos y síntomas que se presentan en la enfermedad. Los anticuerpos juegan un papel importante para su valoración, puesto que se emplean como biomarcadores en enfermedades autoinmunitarias como es el caso de Lupus Eritematoso Sistémico.(8) Por otra parte, con el propósito de mejorar la capacidad diagnóstica se utilizan criterios de clasificación de European League Against Rheumatism (EULAR) y American College of Rheumatology (ACR) del 2019 (EULAR/ACR-2019) que tienen mayor sensibilidad y especificidad frente a los criterios Clínicos de Colaboración del Lupus Eritematoso Sistémico (SLICC) del 2012.(9) Para la detección a nivel de laboratorio se emplean técnicas de inmunoensayo como inmunoadsorción ligada a enzimas (ELISA) e Inmunofluorescencia indirecta (IFI).(10)
El objetivo de la presente revisión bibliográfica es identificar los biomarcadores que ayudan al diagnóstico y pronóstico en Lupus eritematoso sistémico y además describir los criterios de clasificación de LES y métodos inmunológicos que se emplean actualmente.
MÉTODOS
Para el presente artículo de revisión bibliográfica se desarrolló una investigación exhaustiva de tipo descriptivo donde se utilizó artículos disponibles en inglés y español con un periodo de publicación entre el 2015-2023.
La recopilación de información se realizó en bases de datos como: Google Académico, Pubmed, Science Direct, SciELO, Redalyc donde se indagó temas relacionados a Biomarcadores utilizados para el diagnóstico y pronóstico en lupus eritematoso sistémico.
Las palabras clave utilizadas en la búsqueda fueron: lupus eritematoso sistémico, biomarcadores en lupus eritematoso sistémico, anticuerpos utilizados en el diagnóstico de lupus eritematoso sistémico. Además, se incluyó artículos originales, tesis, guías prácticas clínicas y toda la evidencia sobre la literatura.
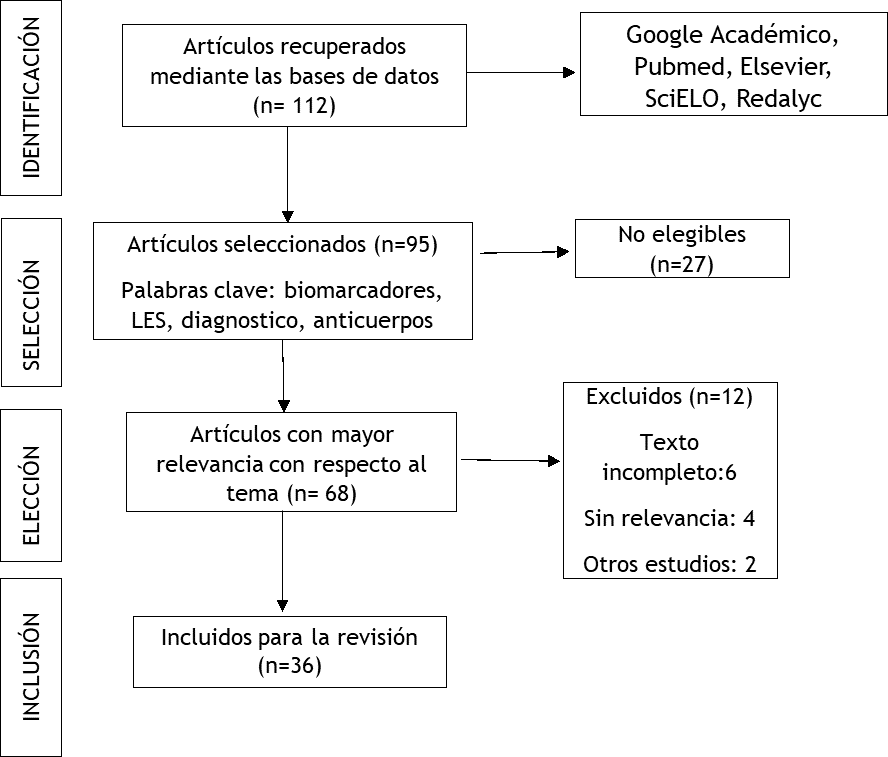
Figura 1. Flujograma utilizado para la búsqueda bibliográfica
DESARROLLO
Según el National Institutes of Health (NIH) un biomarcador se define como una característica que puede ser medible y da a conocer procesos que suceden en una célula o a su vez en un organismo en un momento específico. Una de las características que posee un biomarcador es que permite la identificación y confirmación de enfermedades autoinmunes, cardiovasculares, infecciones o inflamación, por lo que permiten manejar adecuadamente la interpretación diagnóstica.(11) Para el diagnóstico de LES es indispensable evaluar características como el porcentaje de sensibilidad, especificidad y el método donde se analizan los marcadores biológicos.(12)
Biomarcadores utilizados para el diagnóstico en LES
Biomarcadores en detección precoz
El diagnóstico precoz de LES se base específicamente en la detección de anticuerpos cuando existe sintomatología sugestiva por lo que ayudan a reconocer formas tempranas y leves de la enfermedad.
Entre los biomarcadores representativos en detección precoz se encuentran:
Anticuerpos antinucleares (ANA)
Los anticuerpos antinucleares (ANA) son un grupo de autoanticuerpos o inmunoglobulinas que están dirigidos contra diversos antígenos localizados en el núcleo o citoplasma, estos se clasifican dependiendo de la estructura que reconozca ya sea nucleosomas, antígenos nucleares extraíbles, nucleolos y antígenos citoplasmáticos.(13) La detección de ANA representa una prueba primaria para el diagnóstico de LES, pero se ha evidenciado en un 25 % la presencia de ANA positivos en pacientes sanos, por tanto, reduce la precisión de la prueba diagnóstica.(14)
Métodos de detección
Se utiliza inmunofluorescencia indirecta (IFI) y el enzimoinmunoanálisis de adsorción (ELISA). Según el ACR (American College of Rheumatology) la prueba “Gold estándar” para la determinación de ANA es IFI sobre células HEp-2, ya que tiene 98 % sensibilidad y 90 % especificidad.(10)
IFI en la detección de ANA emplea como sustrato células HEp-2 que se obtienen generalmente de línea de carcinoma de laringe humano o de sustratos de hígado o riñón. Si existe la presencia de ANA se forma un complejo llamado antígeno-anticuerpo. Dicho complejo se puede visualizar mediante un microscopio de fluorescencia, donde en muestras positivas se observará el núcleo con fluorescencia de color verde y por esta razón, se deberá realizar otra prueba complementaria como anti-DNA.(15,16)
Para la interpretación de los resultados es importante tomar en cuenta los títulos de dilución y los patrones ANA. Los títulos de dilución se basan en la carga que tiene los anticuerpos antinucleares detectados a través de IFI. Investigaciones previas han demostrado que ANA se encuentra presente en individuos sanos en aproximadamente un 32 % con títulos de 1:40.(17) Por lo tanto, se considera títulos bajos a diluciones de 1:40 a 1:80, intermedio de 1:160 a 1:320, altos de 1:640 en adelante.(10,18,19)
Por otra parte, los patrones identificados por el método IFI representan otra forma de identificar ANA, por lo que se distingue por patrón homogéneo, periférico, moteado, nucleolar y centrómero. Los patrones asociados específicamente en LES son:
Homogéneo: se asocia a LES en un 60 %. Presenta una tinción difusa en el núcleo con presencia o ausencia de coloración en los nucléolos. Está ligado a antígenos nucleares como ADNn (Ácido desoxirribonucleico nuclear) e histona.(15,20)
Periférico: no existe un porcentaje claro de asociación con LES. Este tipo de patrón presenta una tinción irregular y sólida en la parte externa del núcleo y se evidencia una ligera tinción en la parte central. Los antígenos nucleares son ADNn (Ácido desoxirribonucleico nuclear) y ADNmc (Ácido desoxirribonucleico monocatenario).(15,20)
Moteado.
Nucleolar: se caracteriza por presentar tinción gruesa y por lo general se observan hasta 6 manchas por célula. El porcentaje en LES es del 20 % en antígeno Sm (Smith) y 25 % en RNP (ribonucleoproteína U1).(15,20)
Fino: presenta una tinción nuclear fina sin coloración fluorescente en nucleolos. En LES los antígenos asociados representan un 35 % en SSA/Ro (anti-antígeno A relacionado con el síndrome de Sjögren y 15 % en SSB/La (anti-antigeno B relacionado con el síndrome de Sjögren).(15,20)
En cuanto a la detección por ELISA es un método automatizado que emplea como fuente antigénica extractos nucleares absorbidos en el fondo de los pocillos de una microplaca. En este proceso se forma una reacción enzimática que se mide en un lector de ELISA donde el objetivo principal es medir la absorbancia en 450 nm. Los resultados de la prueba se consideran positivas con una absorbancia > 1,2 y negativos < 1,0. En un estudio comparativo entre la concordancia y exactitud entre el método IFI y ELISA para la detección de ANA se demostró que la sensibilidad fue de 93,85 % y especificidad de 95,24 %.(21) Sin embargo, el método IFI es el más recomendado para la detección de anticuerpos antinucleares por su alta sensibilidad (90 %) y fiabilidad frente a la técnica de inmunoadsorción ligado a enzima.
Para una mejor interpretación sobre el diagnostico de LES utilizando anticuerpos antinucleares (ANA) se puede utilizar el siguiente algoritmo (figura 2).
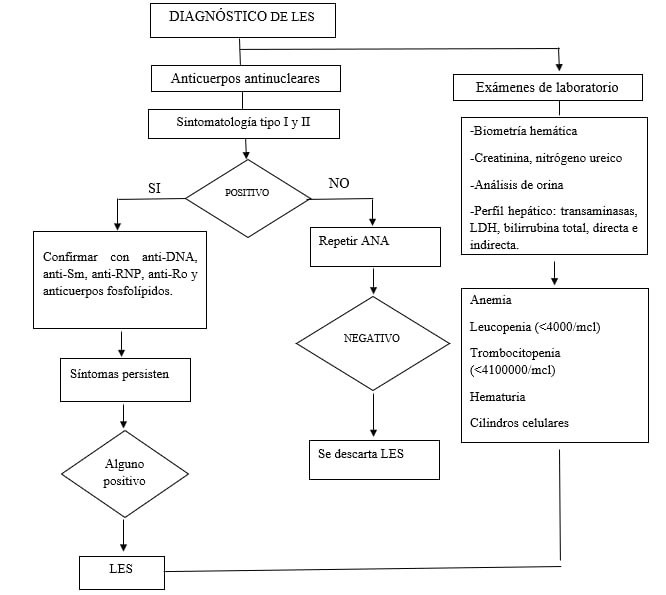
Figura 2. Algoritmo para el diagnóstico de LES. Modificado de Guía práctica clínica (Adopción LES chilena), Ministerio de Salud Pública del Ecuador.(22)
Biomarcadores de actividad
Anticuerpos anti-DNA de doble cadena
Los anticuerpos anti-DNA de doble cadena o inmunoglobulinas pertenecen a la clasificación de ANA y están dirigidos contra el ADN o material genético específicamente del núcleo celular.(13) Está presente en aproximadamente 65 % - 80 % en pacientes diagnosticados con LES y tiene una prevalencia del 70 %. Por lo general, está asociado a LES agresivo, como es el caso de nefritis lúpica donde existe un deterioro renal severo. Además, permite el monitoreo frente a pacientes que reciben tratamiento.(20)
Se clasifica en dos tipos, DNA de cadena simple (anti-ssDNA) y DNA de cadena doble (anti-dsDNA). En el diagnóstico de LES se utiliza anti-dsDNA como un marcador de actividad, ya que la sintomatología es persistente y se confirma luego de un resultado ANA positivo.(20)
Para su detección se emplean dos métodos: IFI, ELISA. La inmunofluorescencia indirecta es la más utilizada, puesto que tiene una alta especificidad (99 – 100 %) y baja sensibilidad (13 – 47 %).(23) Esta técnica emplea como sustrato a Crithidia luciliae (CLIFT) el cual se considera un microorganismo unicelular que en su estructura interna contiene mitocondria con dsDNA circular y condensado denominado cinetoplasto. El procedimiento se basa en reconocer anticuerpos que reaccionan con el DNA del cinetoplasto de CLIFT. Resultados positivos son considerados con títulos > 1:100.(24)
Con respecto a ELISA, emplea un método indirecto con especificidad (71 – 97 %) y sensibilidad (44 – 79 %).(23) De este modo, el fundamento de la técnica se basa en utilizar sustrato anti-DNasa I el cual es conjugado con peroxidasa de rábano picante, posteriormente se incuba a temperatura ambiente durante aproximadamente 15 min para que pueda reaccionar con el ADN residual. Luego se añade un sustrato TMB (3, 3', 5, 5'-tetrametilbencidina) y se mide por espectrofotométricamente a 450 nm. Un resultado positivo es ≥ 10 UI/mL.(24) Sin embargo, los valores referenciales varían debido a que cada laboratorio utiliza diferentes reactivos para la determinación de anti-dsDNA por el método ELISA. No obstante, los resultados se reportan en UI/mL.(25)
Proteínas del complemento C3 Y C4
El sistema del complemento juega un papel importante para establecer el diagnóstico de LES, puesto que está asociado a su inmunopatogénesis. Este sistema contiene una variedad de proteínas que se etiquetan de C1 a C9, las cuales poseen actividad biológica que se estimula mediante inmunocomplejos a través de dos vías: clásica y alternativa. Por una parte, la vía clásica se activa por anticuerpos con isotopos tipo IgG e IgM, mientras que la vía alternativa es modulada por elementos que se encuentran en la pared bacteriana.(26) Según el texto de referencia de pruebas diagnósticas y de laboratorio los valores normales de C3 se encuentran entre: 75 - 175mg/dL y C4 entre 2 - 45 units/mL.(27)
En LES, las proteínas C3 y C4 se encuentran en niveles disminuidos, por tanto, son útiles como marcadores de actividad, mientras que niveles aumentados de C4 indican procesos de inflamación como artritis reumatoide. Por otra parte, el complemento C3 se encuentra en mayor proporción en el plasma, por lo que sería un marcador específico para el diagnóstico.(28)
Proteína C reactiva
Proteína C reactiva (CRP) es considerada como un marcador de procesos inflamatorios o reactante de la fase aguda que se expresa durante daño tisular o inflamación sistémica. En LES es utilizado como un biomarcador para infecciones graves, el cual es estimulado por IL-6 (citocina proinflamatoria) que en niveles séricos se encuentra aumentada. Las infecciones graves representan la principal causa de muerte de LES, por lo que es indispensable la determinación de CRP cuando existe daño tisular. Niveles > 6 mg/dL representan un resultado positivo y se relaciona con LES activo.(28)
Biomarcadores de confirmación
El perfil ENA (antígenos nucleares extraíbles) se emplea tras el hallazgo de ANA positivo como pruebas confirmatorias para el diagnóstico de LES. Se clasifica en dos grupos importantes como proteínas ligadas al ADN y proteínas asociadas al ARN. Dentro del primer grupo se destaca a anti-centrómero (ACA) y anti-scl-70 (anti-topoisomerasa I), mientras que en el segundo grupo se describe a anticuerpos que tienen mayor relevancia en LES. (29) Entre ellos se destaca a:
Anticuerpos anti-Smith
Anti-SM es un tipo de inmunoglobulina que se dirige contra ribonucleoproteínas nucleares pequeñas (snRNP) que pertenecen al espliceosoma, el cual es un complejo multiproteico que se encarga del empalme del ARN.(13) En pacientes con LES está presente en aproximadamente 30-70%. Este tipo de anticuerpo constituye un biomarcador netamente especifico (97 – 99 %), ya que no se ha identificado en otras enfermedades autoinmunes.(29,30) Sin embargo, carece de sensibilidad (10-55%) por lo que es importante el apoyo diagnostico con anticuerpos asociados a anti-SM como anti-RNP.(30)
Anticuerpos anti ribonucleoproteína nuclear U1 (anti-RNP)
Anti-RNP se utiliza tras la presencia de anti-SM positivo y se caracteriza por unirse con proteínas de tipo U1RNA que al igual que anti-Smith forman parte del espliceosoma.(29) Su prevalencia es tan solo del 30 % debido a que está asociado en gran medida a enfermedad mixta del tejido conectivo (EMTC), artritis reumatoide y síndrome de Sjögren (SS).(1) Por lo que, le hace un biomarcador menos específico, pero confirmatorio, puesto que su sensibilidad es de 27 % mientras que su especificidad es 82 %.(26)
Biomarcadores inespecíficos
Forman parte del perfil ENA y son de utilidad en el diagnóstico de LES tras obtener un resultado de anti-dsDNA negativo. Se denominan biomarcadores inespecíficos dado que se encuentran relacionados a afecciones autoinmunes como el síndrome de Sjögren y otras complicaciones clínicas como bloqueo cardiaco, fotosensibilidad y lupus cutáneo subagudo.(31) Dentro de este tipo de anticuerpos se distingue a:
Anti-Ro/SSA y Anti La/SSB
Anti-Ro o también denominado SSA es un anticuerpo que está dirigido contra proteínas Ro o antígenos que se asocian al ARN. Se clasifican en 52kD y 60 kD las cuales contienen ácidos nucleicos que son ricos en uridina. En LES se encuentra con mayor predominio a 60 kD, puesto que tiene una prevalencia de 25 – 50 %, el porcentaje de sensibilidad varía de 10 – 50 % y no se conoce con exactitud su especificidad.(13,30)
De igual modo, el anticuerpo anti-la o SSB es una fosfoproteína que se dirige contra proteínas La que son de tipo 45 kD la cual participa en procesos de transcripción como la terminación de ARN polimerasa II. Esta inmonoglobulina está estrechamente relacionada con SS, por lo tanto, en LES es menos frecuente en un 10 – 20 %. Su sensibilidad es 25,7 % y especificidad de 96 %.(30)
Otros biomarcadores
Anticuerpos anti-P ribosomal
La anti-proteína ribosomal P se emplea como biomarcador en LES cuando existen síntomas relacionados con problemas neuropsiquiátricas como depresión o psicosis.(13) Se dirigen contra proteínas fosforiladas de tipo P0, P1 y P2 que se sitúan en la subunidad 60s del ribosoma. La prevalencia en pacientes con LES es tan solo del 15 %, sin embargo, se considera un biomarcador específico debido a que su porcentaje se hallan en un 95 % mientras que su sensibilidad es 18,2 %.(1,18,29)
Anticuerpos antifosfolípidos (aPL)
Los aPL son un grupo de anticuerpos heterogéneos que se dirigen contra diversas proteínas, las cuales se disponen en la membrana de células endoteliales y en células que participan en la cascada de la coagulación específicamente en plaquetas. Además, los principales aPL reconocidos en LES son anticardiolipina (aCL), anti-beta-2 glicoproteína I (anti-2GPI) y anticoagulante lúpico (LA) los cuales predisponen a padecer riesgo de desarrollar procesos trombóticos. En pacientes con LES el porcentaje de prevalencia es de 30 %.(13,26,30)
Biomarcadores asociados al pronóstico
En cuanto al pronóstico de LES en la mayoría de los casos suele ser favorable debido a que las remisiones suelen ser prolongadas y los pacientes pueden durar hasta 5 años sin ningún tipo de manifestación clínica. Sin embargo, esto dependerá de los síntomas y órganos comprometidos tras el diagnóstico inicial. Además, el tratamiento es indispensable para mejorar la calidad de vida y supervivencia como una opción para mejorar el curso de la enfermedad.(22,26)
Los biomarcadores pronósticos para LES se utilizan para predecir la reaparición de las manifestaciones clínicas donde se emplea a anticuerpos como anti-DNA, anti-Smith, anti-RNP y complemento C3 y C4 debido a que se ha evidenciado que son marcadores de seguimiento y se han relacionado con recaídas futuras de LES.(32)
Sensibilidad, especificidad, prevalencia de biomarcadores según la información recopilada
|
Tabla 1. Biomarcadores empleados en el diagnóstico de LES |
|||
|
Biomarcadores |
Sensibilidad |
Especificidad |
Prevalencia |
|
ANA: -IFI -ELISA |
98 % 93,85 % |
90 % 95,24 % |
25 % |
|
Anti-dsDNA -IFI -ELISA |
13 – 47 % 44 - 79 % |
99 – 100 % 71 - 97 % |
70 % |
|
Anti-SM |
5 – 30 % |
97 – 99 % |
30 - 70 % |
|
Anti-RNP |
27 % |
82 % |
30 % |
|
Anti-Ro/SSA |
10 - 50 % |
- |
25 – 50 % |
|
Anti-La/SSB |
10 – 20 % |
- |
10 - 20 % |
|
Anti-P ribosomal |
18,2 % |
95 % |
15 % |
|
aPL |
- |
- |
30 % |
Nuevos biomarcadores
Las recientes investigaciones han apuntado a la utilización de biomarcadores moleculares como los microARNs (miARNs) para el diagnóstico de LES. De este modo, los miARNs son fragmentos pequeños monocatenarios de ARN no codificante que están involucrados en la regulación de expresión de genes inmunorreguladores que participan en la vía del interferón I.(33) Los miARNS asociados a LES son miR-146a, miR-196a, miR-146a, miR-101, miR-24a, miR-569 y miR-155 los cuales son detectados por PCR (reacción en cadena de la polimerasa). Entre los más relevantes con criterio diagnóstico son miR-196 y miR146 los cuales permiten diferenciar a un paciente con LES de un sano.(34)
Criterios de clasificación para el diagnóstico de LES
Los criterios de clasificación LES actualmente utilizados son EULAR/ACR-2019 desarrollados por la European League Against Rheumatism (EULAR) y el American College of Rheumatology (ACR) (figura 3). Presentan una sensibilidad del 96,1 % y especificidad del 93,4 %. Se clasifican en dos parámetros tanto clínicos e inmunológicos de los cuales se subdividen en 10 dominios. Para que un paciente sea diagnosticado con LES debe cumplir con un importante criterio de entrada en el cual arrojará un resultado ANA positivo con título ≥ 1:80 por el método IFI. Posteriormente, el paciente deberá tener una puntuación mayor a 10 y cumplir con al menos un criterio clínico. Por el contrario, si ANA está ausente o negativo no se clasifica como LES y por lo tanto no se emplean los criterios adicionales expuestos en la figura.(9) Además, es indispensable destacar que hay casos donde un paciente presenta dos o más manifestaciones en un mismo dominio por lo que se toma en cuenta el criterio ponderado más alto para el puntaje total.

Figura 3. CRITERIOS EULAR/ACR-2019. Modificado de “FR- Criterios de clasificación 2019 del lupus eritematoso sistémico”, Mogardo P.(9)
DISCUSIÓN
El diagnóstico de LES en la mayoría de los casos resulta ser complejo puesto que se lleva a cabo a través de varios procesos con la finalidad de llegar a una valoración final. Las diferentes manifestaciones que se presentan en el transcurso de la enfermedad son de vital importancia ya que determinan en cierta medida su progresión. Tras el análisis de los diferentes síntomas es necesario el estudio de los biomarcadores que se emplean para determinar si un paciente padece o no de LES.(22)
La importancia de utilizar anticuerpos (Ac) como biomarcadores principalmente es porque se encuentra presente en el suero de los pacientes con LES lo que conlleva a que se observe las diferentes manifestaciones en la enfermedad. Por este motivo, los Ac resultan útiles para descartar la presencia de otras patologías asociadas como Síndrome de Sjögren o S. Fosfolipidico.(25)
La detección inicial se basa en utilizar ANA puesto que tiene alta sensibilidad (98 %) si se lo detecta por IFI obteniendo como resultado positivo a títulos > 1:80. Este tipo de anticuerpo sirve como prueba de cribado o screening puesto que es útil siempre y cuando un paciente presente signos y síntomas que sean sugestivos para LES, por lo que si solo se emplea ANA como diagnostico no determinaría la presencia de esta. Por este motivo, recomiendan analizar otros biomarcadores específicos como anti-dsDNA para dar una validez diagnostica.(22)
Sin embargo, para la confirmación de LES, el Ministerios de Salud Pública del Ecuador (MSP) a través de la guía práctica clínica recomienda la utilización de autoanticuerpos más específicos como el perfil anti-ENA utilizando a anti-Smith, ya que se ha evidenciado que son específicos para esta enfermedad por lo que no se detectan en personas sanas como en el caso de ANA. De este modo, resulta útil para el pronóstico debido a que se detecta cuando hay periodos de remisión.(22,26)
No obstante, la determinación de estos anticuerpos no engloba el diagnóstico definitivo por lo que es indispensable realizar pruebas de laboratorio complementarias como hemograma con el objetivo de identificar leucopenia, trombocitopenia y anemia, proteína C reactiva, creatinina y sedimento urinario. En particular, leucopenia, linfopenia con valores < 500 células/mm3 y proteína C reactiva está asociado con infecciones en personas con LES, mientras que la trombocitopenia tiene relación con afectación en órganos y un pronóstico grave. Mientras que proteinuria > 0,5 ug/día es un indicativo para que un paciente tenga afección renal en LES. Por esta razón, es importante el acompañamiento de los exámenes anteriormente mencionados con la finalidad de que el curso de LES no siga avanzando.(35)
Para un diagnóstico definitivo de LES, es recomendable la utilización de los criterios de clasificación de EULAR/ACR del 2019 que muestra mayor sensibilidad y especificidad frente a SLICC. Los SLICC han dejado de utilizarse debido a que se detallan manifestaciones poco frecuentes y no existe un puntaje específico para cada dominio ya que solo se toma en cuenta a 4 o más criterios clínicos e inmunológicos para determinar si un paciente es indicativo para LES. La diferencia de los parámetros inmunológicos entre los dos criterios de clasificación es que SLICC no emplea como criterio de entrada a ANA y el paciente debe presentar VDRL (prueba que se emplea para el tamizaje de sifilis) falso positivo y prueba de Coombs directa positiva cuando el paciente no presente anemia hemolítica. Mientras que la similitud entre ambos es que utilizan parámetros hematológicos donde se toma en cuenta a anemia hemolítica, leucopenia y trombocitopenia como características importantes para el diagnóstico de LES.(9,22)
Por último, es importante analizar el uso de los miARNs para el diagnóstico y pronóstico de LES puesto que resultan ser muy específicos. Sin embargo, no se han incluido dentro de los criterios de clasificación por lo que sería adecuado continuar analizando su funcionalidad dentro del diagnóstico como nuevos biomarcadores.
Dentro de las limitaciones encontradas en la presente revisión, se destaca la falta de información actualizada en las diferentes bases de datos, por este motivo se consideró integrar investigaciones desde el 2015. Además, varios artículos no son de acceso libre por este motivo, la información no fue tomada en cuenta dentro de la revisión. Por otra parte, la falta de estudios previos sobre biomarcadores a nivel de Latinoamérica hace que la revisión de la literatura se enmarque a nivel global. Así mismo, en gran parte se encontró artículos que nos hablan sobre biomarcadores asociados al diagnosticó de LES, mientras que para el pronóstico no se encontraron datos concluyentes. Por otra parte, una de las importantes implicaciones prácticas de esta revisión es que se pueda evaluar todos los criterios para el diagnóstico oportuno de Lupus y de este modo dar un seguimiento adecuado.
CONCLUSIONES
El diagnóstico corresponde a la evaluación de los diferentes síntomas que presenta un paciente en el transcurso de la enfermedad. En LES se ha identificado que los anticuerpos son utilizados como biomarcadores donde el más representativo es ANA al utilizarse como un criterio inicial para la detección precoz donde alcanza una sensibilidad de 98 % si se lo realiza por el método IFI.
Sin embargo, tras el hallazgo de ANA positivo es indispensable utilizar a otros anticuerpos para su confirmación donde la detección de anti-SM tiene especificidad de 97 – 99 % por que es útil si se desea conocer si un paciente padece LES u otras patologías asociadas a esta. Por otra parte, anti-RNP se lo realiza tras obtener un resultado de anti-SM positivo por lo que estos dos biomarcadores van de la mano como pruebas confirmatorias.
Por otra parte, se emplean otro tipo de anticuerpos como anti-dsDNA, complemento C3 y C4 y proteína C reactiva los cuales representan marcadores biológicos de actividad y de procesos inflamatorios. Luego de la recopilación de información se concluye que estos biomarcadores pueden ser empleados para el seguimiento de los pacientes con la finalidad de obtener un pronóstico adecuado y evitar recaídas.
Se debe tomar en cuenta a los criterios de clasificación que tengan mayor sensibilidad y especificidad por lo tanto es indispensable considerar que EULAR/ACR-2019 da un diagnóstico más acertado debido a que es el más actualizado y proporciona parámetros tanto clínicos e inmunológicos relacionado con las manifestaciones que presentan los pacientes en el transcurso de la enfermedad.
Finalmente, las pruebas hematológicas que se realizan en el laboratorio sirven como apoyo para el diagnóstico y permiten observar la relación que existe entre citopenias con LES, ya que son parámetros que se encuentran dentro de los criterios de clasificación y están relacionadas con el compromiso de las líneas celulares y con la presencia de alteraciones de la coagulación. Así, mismo es importante tomar en cuenta a los nuevos biomarcadores como miARNS (miR-196 y miR-146) para el diagnosticó, aunque su detección es costosa en comparación a otros métodos utilizados para la determinación de biomarcadores resultan ser muy específicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Rubio ER, Emperiale V, Ruiz PP, Castañeda NG. Lupus eritematoso sistémico (I). Medicine - Programa de Formación Médica Continuada Acreditado. abril de 2021;13(31):1739-50. https://doi.org/10.1016/j.med.2021.04.001
2. Tsokos GC. Autoimmunity and organ damage in systemic lupus erythematosus. Nat Immunol. 4 de junio de 2020;21(6):605-14.
3. Diamond B, Lipsky PE. CAPÍTULO 355: Autoinmunidad y enfermedades autoinmunitarias. https://accessmedicina.mhmedical.com/content.aspx?bookid=3118§ionid=268882104
4. Pisetsky DS, Clowse MEB, Criscione-Schreiber LG, Rogers JL. A Novel System to Categorize the Symptoms of Systemic Lupus Erythematosus. Arthritis Care Res (Hoboken). 2019;71(6):735-41. https://doi.org/10.1002/acr.23794
5. Tian J, Zhang D, Yao X, Huang Y, Lu Q. Global epidemiology of systemic lupus erythematosus: A comprehensive systematic analysis and modelling study. Ann Rheum Dis. 2022;351-6.
6. Barber MRW, Drenkard C, Falasinnu T, Hoi A, Mak A, Kow NY, et al. Global epidemiology of systemic lupus erythematosus. Nat Rev Rheumatol. 2021;17(9):515-32.
7. Diario Salud. EL LUPUS UNA ENFERMEDAD SILENCIOSA QUE CAUSA MUCHO DAÑO. https://diariosalud.com.ec/2022/05/09/el-lupus-una-enfermedad-silenciosa-que-causa-mucho-dano/. 2022.
8. Kokuina Elena. Autoanticuerpos como biomarcadores de actividad de la enfermedad del lupus eritematoso sistémico. 2014. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232014000200009
9. Morgado PJB. ARTICLE IN PRESS FR-Criterios de clasificación 2019 del lupus RF-2019 Classification Criteria for Systemic Lupus Erythematosus. 2021; 113:3-5. https://www.actasdermo.org/es-fr-criterios-clasificacion-2019-del-lupus-avance-S0001731021003720
10. Pisetsky DS. Evolving story of autoantibodies in systemic lupus erythematosus. J Autoimmun. junio de 2020; 110:102356. https://doi.org/10.1016/j.jaut.2019.102356
11. NIH. Biomarkers [Internet]. [citado 11 de abril de 2023]. Disponible en: https://www.niehs.nih.gov/health/topics/science/biomarkers/index.cfm
12. González LA, Ugarte-Gil MF, Alarcón GS. Systemic lupus erythematosus: The search for the ideal biomarker. Vol. 30, Lupus. SAGE Publications Ltd; 2021. p. 181-203.
13. Mendez-Rayo T, Ochoa-Zárate L, Posso-Osorio I, Ortiz E, Naranjo-Escobar J, Tobón GJ. Interpretation of autoantibodies in rheumatological diseases. Vol. 25, Revista Colombiana de Reumatologia. Asociacion Colombiana de Reumatologia; 2018. p. 112-25.
14. Lazar S, Kahlenberg JM. Annual Review of Medicine Systemic Lupus Erythematosus: New Diagnostic and Therapeutic Approaches. 2022. https://doi.org/10.1146/annurev-med-043021-
15. Alcántara H, González M, Cruz M, Silva R, Vilchis Landeros L, Mayoral PC, et al. Comité Editorial: González Andrade Anticuerpos antinucleares por inmunofluorescencia indirecta. Antinuclear antibodies by indirect immunofluorescence. MENSAJE BIOQUÍMICO. Vol. 46, Mens. Bioquím. 2022. http://biosensor.facmed.unam.mx/tab/wp-content/uploads/2022/06/6-Perez-Campos.pdf
16. Alarcón I, Aparicio MaB, García José. APORTACIÓN DEL LABORATORIO CLÍNICO EN EL ESTUDIO DEL LUPUS ERITEMATOSO SISTÉMICO. SEQC. 2016. https://www.seqc.es/download/tema/13/4407/62065/902068/cms/tema-2-aportacion-del-laboratorio-clinico-en-el-estudio-del-lupus-eritematoso-sistemico.pdf/
17. Vázquez Castillo TV, Solís Martínez RA. Frecuencia de patrones de anticuerpos antinucleares en pacientes con sospecha de enfermedades sistématicas reumáticas autoinmunes. Horizonte Sanitario. 23 de septiembre de 2020;19(3):385-92.
18. Juárez-Dobjanschi C, Ferrándiz-Pulido C, Marín-Sánchez A, García-Patos Briones V. Role of autoantibodies in the diagnosis of systemic autoimmune rheumatic diseases with skin involvement. Antinuclear antibodies and extractable nuclear antigens. (Part 1). Piel. 1 de marzo de 2015;30(3):169-80.
19. Tenesaca J, Pasato M. FRECUENCIA DE PATRONES DE ANTICUERPOS ANTINUCLEARES ANA MEDIANTE INMUNOFLUORESCENCIA INDIRECTA Y SU RELACIÓN CON EL DESARROLLO DE ENFERMEDADES AUTOINMUNES EN PACIENTES ATENDIDOS EN EL HOSPITAL VICENTE CORRAL MOSCOSO. ENERO 2019 - DICIEMBRE 2020. [Ecuador]: Universidad de Cuenca; 2023.
20. Rosales C. BETA 2 MICROGLOBULINA, 25 OH VITAMINA D Y FERRITINA CON LA REACTIVACION CLINICA DE LUPUS ERITEMATOSO SISTEMICO Y NEFROPATIA LUPICA. [La Paz]: Universidad Mayor de San Andres; 2019.
21. Pedano V, Pascual C, Silvera É, Vaca A. CONCORDANCIA Y EXACTITUD DIAGNÓSTICA ENTRE INMUNOFLUORESCENCIA INDIRECTA Y ENZIMOINMUNOENSAYO PARA EL CRIBADO DE ANTICUERPOS ANTI-NUCLEARES. Argentina; 2019.
22. Ministerio de Salud Pública. Guia-lupus-eritematoso. Quito; 2013. https://www.salud.gob.ec/wp-content/uploads/2016/09/Guia-lupus-eritematoso.pdf
23. Amengual J, Mozo L, Rodriguez C. Protocolos de diagnóstico inmunológico en enfermedades autoinmunes. SOCIEDAD ESPAÑOLA DE INMUNOLOGÍA GRUPO ESPAÑOL DE AUTOINMUNIDAD (GEAI); 2015. https://atlasautoinmunidad.org/wp-content/uploads/2018/06/Protocolos-de-Diagn%C3%B3stico-Autoinmunidad-GEAI-1.pdf
24. Vancevska A, Nikolic A, Bonaci-Nikolic B, Skiljevic D, Radojkovic D. Assessment of Deoxyribonuclease Activity in Serum Samples of Patients With Systemic Lupus Erythematosus: Fluorescence-Based Method Versus ELISA. J Clin Lab Anal. noviembre de 2016;30(6):797-803.
25. O. CB, G. FS, M. CR. LABORATORIO DE INMUNOLOGÍA EN LA PRÁCTICA CLÍNICA. Revista Médica Clínica Las Condes. noviembre de 2015;26(6):764-75.
26. Dolores M, Mesonero A. TESIS DOCTORAL LUPUS ERITEMATOSO SISTÉMICO. EPIDEMIOLOGÍA Y PRESENTACIÓN CLÍNICA EN EL NOROESTE DE ESPAÑA. 2017.
27. Deska Pagana K, Pagana TJ, Noel Pagana T. Mosby’s Diagnostic and Laboratory Test Reference. Mosby’s Diagnostic and Laboratory Test Reference. 2019.
28. Aringer M. Inflammatory markers in systemic lupus erythematosus. J Autoimmun. junio de 2020;110:102374. https://doi.org/10.1016/j.jaut.2019.102374
29. García M. Biomarcadores no invasivos de actividad en lupus eritematoso sistémico. Universidad de Valladolid; 2015. https://uvadoc.uva.es/bitstream/handle/10324/18033/Tesis1073-160720.pdf?sequence=1&isAllowed=y
30. Ortego N. Cuadernos-Autoinmunidad-Año-12-num-2. Asociación Andaluza de Enfermedades Autoinmunes (AADEA), con periodicidad cuatrimestral y carácter multidisciplinario. 2019;2. https://aadea.es/wp-content/uploads/2019/07/Cuadernos-Autoinmunidad-A%C3%B1o-12-num-2.pdf
31. Mendez-Rayo T, Ochoa-Zárate L, Posso-Osorio I, Ortiz E, Naranjo-Escobar J, Tobón GJ. Interpretation of autoantibodies in rheumatological diseases. Vol. 25, Revista Colombiana de Reumatologia. Asociacion Colombiana de Reumatologia; 2018. p. 112-25.
32. Kokuina E, Estévez M, Toro D, Rojas G, Labrada AO, Bruzón S, et al. Identification of relapse aerological predictors in patients with systemic lupus erythematous: a prospective study of 12 months. Vol. 55, Revista Cubana de Medicina. 2016. https://www.medigraphic.com/cgi-bin/new/resumenI.cgi?IDARTICULO=65336
33. Tan G, Baby B, Zhou Y, Wu T. Emerging Molecular Markers Towards Potential Diagnostic Panels for Lupus. Front Immunol. 13 de enero de 2022;12.
34. Motawi TK, Mohsen DA, El-Maraghy SA, Kortam MA. MicroRNA-21, microRNA-181a and microRNA-196a as potential biomarkers in adult Egyptian patients with systemic lupus erythematosus. Chem Biol Interact. diciembre de 2016;260:110-6.
35. León C, Rojas R, Fuentes F, Hernandez A. Las citopenias en el lupus eritematoso sistémico. Revista Clínica de la Escuela de Medicina UCR-HSJD. 2019.
FINANCIACIÓN
Ninguna
CONFLICTO DE INTERESES
No existen conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Karen Michelle Jaramillo Sancho.
Investigación: Karen Michelle Jaramillo Sancho.
Metodología: Karen Michelle Jaramillo Sancho, Gabriela Paola Valenzuela Sánchez.
Administración del proyecto: Gabriela Paola Valenzuela Sánchez.
Supervisión: Gabriela Paola Valenzuela Sánchez.
Redacción – borrador original: Karen Michelle Jaramillo Sancho, Gabriela Paola Valenzuela Sánchez.
Redacción – revisión y edición: Karen Michelle Jaramillo Sancho, Gabriela Paola Valenzuela Sánchez.