REVISIÓN BIBLIOGRÁFICA
Carbapenem-resistant Klebsiella pneumoniae in nosocomial infections, a review in Latin America
Klebsiella pneumoniae resistentes a los carbapenémicos en infecciones intrahospitalarias, una revisión en Latinoamérica
Jennifer Dayana Erazo Bravo1 ![]() *, Evelyn
Katherine Jaramillo Ruales1
*, Evelyn
Katherine Jaramillo Ruales1
![]() *
*
1Universidad Técnica de Ambato. Facultad de Ciencias de la Salud, Carrera de Laboratorio Clínico. Ambato, Ecuador.
Citar como: Erazo Bravo JD, Jaramillo Ruales EK. Klebsiella pneumoniae resistentes a los carbapenémicos en infecciones intrahospitalarias, una revisión en Latinoamérica. Salud, Ciencia y Tecnología. 2023; 3:478. https://doi.org/10.56294/saludcyt2023478
Enviado: 01-06-2023 Revisado: 10-06-2023 Aceptado: 23-07-2023 Publicado: 24-07-2023
Editor: Dr. William
Castillo González ![]()
ABSTRACT
Objective: this study aimed to determine the presence of carbapenem-resistant Klebsiella pneumoniae in nosocomial infections in Latin America and to analyze its frequency and tendency in Latin America.
Methods: this study is a literature review; it was carried out through exhaustive research in different databases, Analytical and descriptive cohort studies, meta-analysis, and some clinical trials related to the presence of nosocomial infections caused by carbapenem-resistant K. pneumoniae and the genes responsible for this resistance were included.
Results: twenty-two articles were selected from different databases from Latin American countries; In addition, the percentages of resistance to carbapenems in K. pneumoniae in these countries and its trend before and during the COVID-19 pandemic were identified.
Conclusions: resistance to carbapenems in K. pneumoniae was determined as a public health problem in Latin America, considered a limiting factor in treating patients with infections caused by Enterobacter. In addition, it was identified that KPC is the main gene responsible for carbapenem resistance.
Keywords: Klebsiella pneumoniae; Carbapenem-resistant Enterobacteriaceae; Imipenem; Meropenem; Clinical Epidemiology.
RESUMEN
Objetivo: determinar la presencia de Klebsiella pneumoniae resistente a los carbapenémicos en infecciones intrahospitalarias en Latinoamérica, analizando su frecuencia y tendencia en países pertenecientes a América Latina.
Métodos: este estudio de tipo revisión bibliográfica, se llevó a cabo mediante una exhaustiva investigación en diversas bases de datos. Se extrajeron estudios de cohorte analíticos, descriptivos, metaanálisis y algunos ensayos clínicos relacionados con la presencia intrahospitalaria de K. pneumoniae resistente a los carbapenémicos y los genes responsables de esta resistencia.
Resultados: se seleccionaron 22 artículos extraídos de diversas bases de datos donde se hace mención a países latinoamericanos; además se identificó los porcentajes de resistencia a carbapenémicos en K. pneumoniae en estos países y su tendencia en relación a los años anteriores y durante la pandemia por COVID-19.
Conclusiones: se determinó la resistencia a los carbapenémicos en K. pneumoniae como un problema de salud pública en Latinoamérica, considerado un limitante en el tratamiento de pacientes con infecciones causadas por esta Enterobacteria, así mismo se identificó que KPC es el principal gen responsable de conferir dicha resistencia.
Palabras clave: Klebsiella pneumoniae; Enterobacteriaceae Resistentes a los Carbapenémicos; Imipenem; Meropenem; Epidemiología Clínica
INTRODUCCIÓN
Las infecciones nosocomiales causadas por Klebsiella pneumoniae se han convertido en un problema de salud pública, aumentando la mortalidad, morbilidad y estancias hospitalarias,(1) es un bacilo gram negativo perteneciente a la familia de los Enterobacterales, fermentador de lactosa y glucosa que forma parte de la microbiota intestinal normal del ser humano, por lo cual se lo considera un patógeno oportunista,(2) este bacilo al igual que otras bacterias gram negativas representan el 45% de infecciones de tipo comunitarias y un 30 % de infecciones nosocomiales. Las infecciones por este microorganismo se asocian a pacientes inmunodeprimidos con largas estancias hospitalarias, en infecciones del tracto urinario, digestivo, sepsis generalizada, infecciones en tejidos blandos y en pacientes con neumonía sometidos a procesos invasivos como ventilación mecánica.(3)
El cultivo de K. pneumoniae se realiza en agares selectivos como el agar MacConkey y agar no selectivo como el agar Sangre; estos agares permitirán visualizar el crecimiento de las colonias, forma y características macroscópicas, entre las que se incluye su color rosado debido a la fermentación de lactosa, apariencia brillante causada por una capsula y olor por lo general dulce,(2) además se realizarán pruebas bioquímicas las cuales obtendrán los siguientes resultados: Ureasa (+), Indol (-), PH Alanina deaminasa (-), Citrato de Simmons (+), Manitol (+), Sacarosa (+), Salisilina (+), Rojo de metilo (-), Voges Proskauer (+).(2)
Para realizar las pruebas de susceptibilidad antimicrobiana se utiliza el método de Kirby Bauer que se basa en la difusión de discos impregnados con antibióticos; por otro lado, para identificar la concentración mínima inhibitoria, se realiza el método de microdilución en caldo donde se observara la presencia o ausencia del crecimiento del microorganismo ante una determinada concentración del antimicrobiano, identificando la turbidez del medio.(2)
Este microorganismo presenta dos tipos de mecanismos de resistencia intrínseca y adquirida,(2) la resistencia intrínseca forma parte natural del microorganismo,(4) como a ampicilina y ticarcilina,(5) por otro lado, la resistencia adquirida es la capacidad bacteriana para adaptarse a diversos ambientes y condiciones que podrían poner en riesgo la integridad de la bacteria,(4) en este tipo de resistencia se puede encontrar mecanismos como intercambio de material genético a través de transformación, transducción, transposición, conjugación; expulsión de antibióticos mediante el uso de bombas de eflujo; hidrolización del antibiótico por medio de enzimas (carbapenemasas, betalactamasas); modificación del sitio activo evitando la penetración del antibiótico (modificación ribosomal, alteración en la permeabilidad de la membrana, biofilmes, sobreexpresión del sitio activo.
Los Enterobacterales resistente a los carbapenémicos fueron detectados por primera vez en 1996 en Estados Unidos, sin embargo, ha sido en los años 2020-2022 donde se ha evidenciado su diseminación en gran medida debido al uso indiscriminado de antibióticos de alto espectro para combatir las infecciones asociadas a COVID-19,(6) se ha logrado identificar genotipos comunes en Latinoamérica que se encuentran asociados a Enterobacterales resistentes a los carbapenémicos en K. pneumoniae como: KPC, VIM, OXA, IMP, NDM.(7)
Las diversas pruebas utilizadas para la identificación especifica de una bacteria determinada se verán seguidas de un screening y pruebas confirmatorias de tipo fenotípico o genotípico; las pruebas automatizadas se basan en inmunocromatográfia, métodos colorimétricos, citometría de flujo y diluciones en caldo, realizados en equipos tales como: Phoenix, Vitek, Sensititre, MicroScan, MALDI-TOF;(2,8) además para la confirmación fenotípica de mecanismos de resistencia también se pueden utilizar técnicas como Test de Hodge modificado, Beta-Carba test, medios cromogénicos, discos combinados con inhibidores y algunas pruebas bioquímicas adicionales, estos métodos pueden tardar un promedio de 18 a 48 horas para su correcta lectura e interpretación.(2)
En esta revisión se describe la frecuencia de K. pneumoniae resistente a los carbapenémicos en infecciones intrahospitalarias en Latinoamérica, su tendencia años antes y durante la pandemia por COVID-19 y los genes específicos que confieren dicha resistencia a carbapenémicos.
METODOS
Búsqueda de artículos
Se ha llevado a cabo una revisión bibliográfica de los últimos cinco años de artículos relacionados a la presencia intra hospitalaria de K. pneumoniae resistente a los carbapenémicos y los genes causantes de la misma, en diferentes bases de datos como: Pubmed, Scopus, Google Schoolar y repositorios de instituciones de educación superior; se hizo uso de términos MeSH como: (“carbapenemase”) OR (“Carbapenem-Resistant Enterobacteriaceae”] AND [“South American”], [“Latinoamérica”], (“resistant Enterobacteriaceae”), (“Klebsiella pneumoniae”), (“gene expresión”),[(“gene resistant”)]. Además, para el análisis de la resistencia por año se realizó una prueba T-Student para identificar la significancia de los datos obtenidos por medio del planteamiento de dos hipótesis una nula donde se menciona que no existe diferencia significativamente estadística entre los valores de resistencia antes y durante la pandemia por COVID-19 en cada país y una hipótesis alternativa que por el contrario menciona la existencia de valores estadísticamente significativos.
Criterios de Inclusión y Exclusión
Se incluyeron estudios de cohorte analíticos, descriptivos, metaanálisis y algunos ensayos clínicos donde se estudiará infecciones nosocomiales causadas por K. pneumoniae resistente a los carbapenémicos en Latinoamérica; por el contrario, se excluyeron estudios que no se encuentre dentro de la región de Latinoamérica o aquellos estudios que reporten otros mecanismos de resistencia.
Selección de los Artículos
El proceso de selección de los artículos para la realización de este estudio se basó en la lectura analítica por parte de dos investigadores, asegurándose de que estos cumplan de manera estricta con los criterios de inclusión previamente mencionados.
RESULTADOS Y DISCUSION
Se realizó una revisión bibliográfica acerca de K. pneumoniae resistente a los carbapenémicos en infecciones intrahospitalarias en Latinoamérica, seleccionando 22 artículos extraídos de bases de datos Pubmed, Scielo, Google Schoolar, Scopus donde se hace mención a países latinos como: México, Guatemala, Costa Rica, Venezuela, El Salvador, Chile, Argentina, Uruguay, Paraguay, Brasil, Perú, Bolivia, Ecuador y Colombia (tabla 1); además se identificó el porcentaje de K. pneumoniae resistentes a los carbapenémicos como imipenem y meropenem, en diferentes países Latinoamericanos y su tendencia antes y durante la pandemia por COVID-19; estos datos fueron obtenidos desde los institutos de vigilancia de cada país y de la Organización Panamericana de la Salud.

Figura 1. Reporte de resistencia a imipenem en K. pneumoniae
*: t-Student p<0.05 (estadísticamente significativo, tomando en cuenta la población reportada de cada año por país).
Extraído de: “Plataforma de Información en Salud para las Américas (PLISA)”(9)
Los reportes de resistencia a imipenem antes y durante la pandemia por COVID-19 representados en la figura 1, describe que Perú en el año 2018 presenta un elevado pico de resistencia (52,9 %) y años durante la pandemia se reporta una ligera disminución (41,5 %); Ecuador así mismo en años anteriores a la pandemia refleja valores entre 30-40 % no obstante durante la pandemia aumentó la resistencia a un 50,9 %, por otro lado en países como Republica Dominicana, Bolivia y Panamá se observan valores porcentuales bajos, incluso muchos de ellos por debajo del 10 % y cinco por ciento manteniendo estos mismos en periodos anteriores y posteriores a la infección ocasionada por COVID-19.
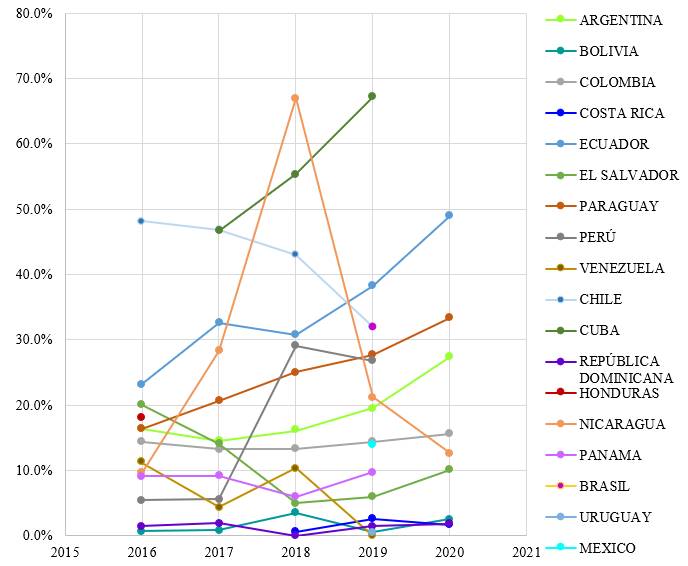
Figura 2. Reporte de Resistencia a meropenem en K. pneumoniae
*: t-Student p≤0.05 (estadísticamente significativo, tomando en cuenta la población reportada de cada año por país).
Extraído de: “Centros de Referencia Nacional de Cada País” y “Plataforma de Información en Salud para las Américas (PLISA)” (9)
En el caso de las resistencias a Meropenem representadas en la se puede observar que Nicaragua en el año 2018 presenta un pico elevado en el porcentaje de resistencias (67 %), no obstante en los años pertenecientes a la pandemia su resistencia a carbapenémicos es bajo con un porcentaje del 12,7 %; Ecuador, reporta un aumento del 18% de resistencia en los años de pandemia, en países como Paraguay y Argentina ocurre algo similar, pero con un porcentaje mucho menor de un seis por ciento aproximadamente entre los años relacionados a la pandemia por COVID 19, por otro lado países como República Dominicana, Bolivia y Costa Rica conservan porcentajes menores o iguales a cinco por ciento tanto en años anteriores como durante la pandemia.
Se logró identificar mediante de la prueba estadística t-Student, comparando años antes y durante la pandemia, que Colombia, Perú y Nicaragua, presentan un aumento de la resistencia a imipenem, estadísticamente significativo (p≤0,05); Por otro lado, Perú y Nicaragua presentan un aumento de la resistencia a meropenem estadísticamente significativo (p≤0,05); El resto de países latinoamericanos no mencionados confirmarían la hipótesis nula (p>0,05), es decir, no presentaron un aumento de la resistencia a los carbapenémicos significativamente estadístico.

Figura 3. Distribución geográfica de genes de K. pneumoniae reportados en Latinoamérica
Además, se identificó los genes más descritos en Latinoamérica en K. pneumoniae, véase en la tabla 1: KPC, NDM, VIM y OXA , estos fueron reportados con mayor frecuencia en países como Argentina, Brasil, Colombia, México y Ecuador y en menor medida en países como Bolivia, Uruguay, Paraguay, Venezuela y algunos países pertenecientes al Caribe; además es importante mencionar que no fue hasta los años 2020 y 2021, que se reportó por primera vez variantes de genes que confieren resistencia a los carbapenémicos en países como Chile (OXA-48), Guatemala (OXA-48) y Belice (NDM).(10)
Se logró identificar mediante estudios publicados por países, la distribución de los genes que confieren resistencia a los carbapenémicos en Latinoamérica, como se describe en la figura 3. Los países que reportan con mayor frecuencia la presencia de este microorganismo son Argentina y Brasil, donde Argentina reporta mayoritariamente la presencia del gen KPC(11) y en Brasil el gen KPC y NDM(1,12,13), otro país con alta frecuencia de K. pneumoniae resistente a carbapenémicos es Colombia con un alta frecuencia de KPC y NDM;(14,15) por otro lado, en México el gen más prevalente es NDM, sin embargo, también hay la presencia de genes como OXA, VIM y KPC.(16,17) El análisis de artículos publicados en Ecuador, describen que el gen más frecuente es KPC, seguido de NDM, OXA-48, VIM e IMP ;(18) en países como Perú, Bolivia, Cuba, Costa Rica, Panamá, El Salvador, Nicaragua, Honduras, Venezuela, Guatemala, Uruguay, Paraguay el gen predominante es KPC seguido por NDM, OXA y por ultimo VIM.(19,20,21,22,23)
|
Tabla 1. Reporte de publicaciones de Klebsiella pneumoniae productora de carbapenemasas |
||||||
|
País |
Año |
Tipo de muestra |
Servicio |
Frecuencia de mecanismos de resistencia (n=total de población estudiada) |
Mecanismos de resistencia |
Referencia |
|
Brasil |
2017 - 2018 |
Hisopado rectal |
Cirugía (trasplante de órganos / medula ósea) |
71 (n=80) 9 (n=80) |
KPC-2 NDM-1 |
(1) |
|
Ecuador |
2022 |
Hisopado Rectal |
UCI |
1 (n=1) |
NDM |
(6) |
|
Ecuador |
2016 |
Liquido ascítico |
Oncología |
1 (n=1) |
OXA-48 |
(24) |
|
Brasil |
2018 - 2021 |
Orina, Sangre, Secreción respiratoria, Hisopado Rectal, Lavado bronqueo alveolar, Secreción de heridas, fluidos peritoneales |
UCI, Pacientes hospitalizados fuera de cuidados intensivos |
8 (n=21)
13 (n=21) |
NDM-1 NDM-7 |
(12) |
|
Argentina y Brasil |
2018 - 2019 |
N/R |
Consulta externa |
12 12 |
NDM-1; KPC-2 KPC-2; NDM-1 |
(25) |
|
Uruguay |
2019 |
Orina |
Consulta externa y Hospitalizados |
477 |
OXA-48 |
(23) |
|
Chile |
2014 - 2017 |
Hisopado rectal |
Hospitalizados |
1 |
NDM-1 |
(13) |
|
Argentina |
2022 |
Orina, Aspirado traqueal, cultivo de catéter, hisopado rectal |
UCI |
6 6 6 |
KPC-115 KPC-3 KPC-31 |
(11) |
|
Colombia |
2017 - 2018 |
Orina, Respiratorias, Sangre, Piel y tejidos blandos, abdomen. |
Hospitalizados |
159 (n=209) 2 (n=209) 2 (n=209) |
KPC NDM VIM-1 |
(14) |
|
Colombia |
2012 - 2017 |
Sistema renal, Vías respiratorias, Sangre, Tejidos blandos, Secreción abdominal, líquidos corporales, ulcera |
Pacientes Ambulatorios y pacientes hospitalizados |
21 (n=279) 3 (n=279) 5 (n=279) 1 (n=279) 4 (n=279) |
KPC VIM-1 KPC-NDM KPC-VIM NDM |
(15) |
|
México |
2020 |
Hemocultivos |
Paciente hospitalizado |
1 (n=1) |
NDM-1 |
(26) |
|
México |
2016 |
Diversos cultivos de puntos infectados |
Pacientes de UCI pediatría |
1 (n=243) 1 (n=243) |
KPC-2 NDM-1 |
(16) |
|
México |
2015 |
hemocultivos |
Pacientes hospitalizados |
10 (n=80) |
NDM-1 |
(17) |
|
Ecuador |
2017 |
hemocultivos, cultivo de catéter central |
Paciente hospitalizado |
1 (n=1) |
NDM |
(27) |
|
México |
2019 |
Cultivo de acceso |
UCI |
1 (n=1) |
KPC2 |
(28) |
|
Venezuela México |
2020 |
N/R |
Pacientes Hospitalizados |
N/R N/R |
OXA-48 |
(22) |
|
Argentina |
2015 - 2017 |
Orina, Sangre, Aspirado Traqueal, hisopado rectal, piel y tejido blando, liquido abdominal, liquido cerebro espinal, heces |
Gastroenterología, oncología, cardiovascular, trasplantes, urología, UCI, medicina interna |
72 (n=76) |
KPC-2 |
(29) |
|
Argentina |
2016 |
Orina |
Pacientes Hospitalizados |
18 (n=42) |
KPC |
(30) |
|
Brasil |
2014 - 2015 |
Sangre, Orina, Aspirado traqueal, Hisopado rectal, |
UCI |
111 (n=188) |
KPC |
(31) |
|
Argentina, Colombia, Ecuador, Venezuela, Guatemala, México |
2013 - 2014 |
Hemocultivos |
Pacientes Hospitalizados |
44(n=255) 44(n=255) 44(n=255) 44(n=255) 4 (n=255) 5 (n=255) |
KPC KPC KPC KPC NDM VIM |
(21) |
|
Perú |
2000 - 2019 |
Hemocultivos, Aspirado bronquial, Secreción de herida, Orina, Catéter venoso central, Secreción bronquial, Secreción abdominal |
Pacientes Hospitalizados |
39 (n=103) 61 (n=103) |
KPC NDM |
(19) |
|
Ecuador |
2018 |
Orina, Sangre, Secreción, Esputo, Aspirado Traqueal, Abscesos, Catéter, Fluidos Abdominales, Vagina, Liquido cerebro espinal, Liquido Pleural, Catéter Central |
Hospitalizados y Ambulatorios |
496 1 |
KPC NDM |
(32) |
En este estudio se ha analizado la frecuencia de Klebsiella pneumoniae resistente a los carbapenémicos en infecciones intrahospitalarias en países latinoamericanos, así como sus tendencias antes y durante la pandemia por COVID-19, además se identificó que KPC, VIM, NDM y OXA son los genes más comunes que se encuentran distribuidos en Latinoamérica capaces de conferir resistencia a los carbapenémicos.(21)
América Latina, ha evidenciado un aumento de la resistencia a los carbapenémicos, una de las causas para que se presenten estos niveles de resistencia puede ser que los pacientes no logran acceder a una atención medica oportuna y recuren a fuentes no oficiales, paginas no verificadas, consulta popular y automedicación lo que supone un riesgo para el paciente y su entorno;(10) Además, algunos países ya reportan coproducción de carbapenemasas lo que vuelve más difícil la terapéutica y resolución de infecciones con este tipo de microorganismo; en Argentina en el año 2021 se reportó un 57,69% de cepas de K. pneumoniae coproductoras de KPC + NDM,(33) así mismo Ecuador y Paraguay reportan por primera vez a K. pneumoniae productoras de doble carbapenemasas (KPC + NDM) durante el 2021, año que se asocia a la pandemia.(10)
Además, esta revisión permitió analizar, investigar y establecer la distribución de los genes responsables de conferir resistencia a los carbapenémicos en K. pneumoniae como: KPC (Klebsiella pneumoniae carbapenemase), VIM (Verona integron-encoded metallo-β-lactamase), OXA (oxacilinasa) y NDM (New Delhi metallo-beta-lactamase) debido a la capacidad de modificación genética que forma parte de K. pneumoniae y le permite adaptarse a diversos ambientes o condiciones facilitando su supervivencia.(14,34) En este mismo contexto la Organización Panamericana de la Salud hizo referencia a diversos factores que contribuyen a generar estas resistencias, entre los cuales se destaca el uso indiscriminado de antibióticos de alto espectro para tratar infecciones de tipo viral o por automedicación;(10,35) Además, en el caso de países con alta densidad poblacional como Brasil, Argentina, Chile y Colombia la atención hospitalaria y el correcto control de infecciones juega un papel fundamental en la diseminación de estas cepas a nivel intra hospitalario donde la sobrepoblación de pacientes en las casas de salud y sus unidades de cuidados intensivos representa un peligro en épocas de COVID-19 siendo este un canal para la diseminación de cepas de K. pneumoniae.(35)
Es por ello que, a través de los resultados de este estudio véase tabla 1, nos permite ponderar a Argentina y Brasil como los principales países latinos con la presencia de K. pneumoniae resistente a los carbapenémicos siendo así este un gran problema en el sistema de salud debido a la limitación de las opciones terapéuticas, aumentando la mortalidad, morbilidad y estancias hospitalarias, representando así la brecha medica que significa no solo K. pneumoniae si no todas las bacterias resistentes a los carbapenémicos y los problemas actuales y futuros que ocasionan en una atención medica de calidad;(3,10) por otro lado, países como Republica Dominicana, Panamá, Bolivia y Costa Rica presentan un menor porcentaje de resistencias relacionado a un oportuno sistema de vigilancia epidemiológica y atención médica, o del mismo modo se puede relacionar a estos porcentajes con la falta de detección por parte de las unidades de vigilancia de estos países.(10,21)
Dentro de este estudio la principal limitación metodológica fue la falta de acceso a bases de datos en algunos países limitando la representatividad geográfica, la disponibilidad de datos actualizados y la inclusión de estudios no publicados. Esto, a su vez, puede limitar la capacidad de los médicos para tomar decisiones basadas en la evidencia y afectar negativamente la práctica médica al no contar con información completa y actualizada que permita ofrecer un tratamiento y diagnostico adecuado a los pacientes.
Estas limitaciones pueden tener consecuencias negativas en la práctica médica, ya que los médicos dependen de la evidencia científica para tomar decisiones clínicas. Sin acceso a bases de datos completas y actualizadas, los médicos pueden enfrentarse a desafíos al seleccionar el tratamiento adecuado para pacientes con infecciones resistentes a los carbapenémicos. Esto puede llevar a un aumento de la morbilidad y la mortalidad, así como a un mayor uso de antibióticos de amplio espectro, lo que contribuye al problema de la resistencia antimicrobiana.
En consecuencia, es fundamental abordar estas limitaciones y promover el acceso abierto a la información científica y las bases de datos en todos los países. Esto permitirá una revisión más completa y actualizada, así como una toma de decisiones clínicas más informada, lo que en última instancia mejorará la práctica médica y contribuirá a abordar el problema de la resistencia a los carbapenémicos de manera más eficaz.
CONCLUSIONES
Se determinó la resistencia a los carbapenémicos en K. pneumoniae como un problema de salud pública en Latinoamérica, sobre todo en pandemia por la falta de recursos, donde las casas de salud se han visto afectados ocasionando problemas en el tratamiento de infecciones causadas por este microorganismo, cuya frecuencia de resistencia se identificó en mayor porcentaje en países con altas densidades poblacionales como Argentina, Brasil, Colombia, México, y Perú, por el contrario en países como República Dominicana, El Salvador, Costa Rica, Bolivia Guatemala y Panamá se evidenció una frecuencia baja de resistencia a los carbapenémicos en K. pneumoniae. Así mismo se encontró un común denominador en ganes capaces de conferir resistencia a K. pneumoniae siendo KPC (Klebsiella Pneumoniae Carbapenemese) el más frecuente en diversos países latinos, seguido por genes como NDM, VIM, OXA e IMP. Por ello La resistencia a los carbapenémicos en Klebsiella pneumoniae es una preocupación significativa en países en vías de desarrollo y tiene un impacto importante en la salud pública, debido a que los carbapenémicos son antibióticos de último recurso, utilizados cuando otros tratamientos han fallado.
En los países en vías de desarrollo, la resistencia a los carbapenémicos en Klebsiella pneumoniae puede ser más prevalente debido a diversos factores. Estos incluyen el acceso limitado a los antibióticos más nuevos y más efectivos, el uso inapropiado y excesivo de antibióticos, la falta de regulación en la venta y distribución de medicamentos, la falta de infraestructura sanitaria adecuada y la falta de programas de control de infecciones, llevando a la rápida propagación rápidamente en entornos de atención médica, aumentando la carga de infecciones nosocomiales. Además, la resistencia a los carbapenémicos limita las opciones de tratamiento, lo que puede resultar en un aumento de las tasas de morbilidad y mortalidad.; además K. pneumoniae resistente a carbapenémicos también puede tener implicaciones en la comunidad, ya que estas bacterias pueden transmitirse entre personas y causar infecciones difíciles de tratar en entornos no hospitalarios, resultando en un aumento de las infecciones adquiridas en la comunidad y contribuir aún más a la carga de enfermedades.
En resumen, la resistencia a los carbapenémicos en Klebsiella pneumoniae en países en vías de desarrollo representa un desafío significativo para la salud pública. La falta de opciones de tratamiento efectivas y la propagación de bacterias resistentes pueden tener un impacto negativo en la morbilidad y la mortalidad, así como en los costos de atención médica. Es fundamental implementar estrategias integrales de control de infecciones, promover el uso racional de antibióticos, fortalecer los sistemas de salud y mejorar el acceso a opciones terapéuticas efectivas para abordar este problema de manera eficaz.
REFERENCIAS BIBLIOGRÁFICAS
1. Raro OHF, da Silva RMC, Filho EMR, Sukiennik TCT, Stadnik C, Dias CAG, et al. Carbapenemase-Producing Klebsiella pneumoniae From Transplanted Patients in Brazil: Phylogeny, Resistome, Virulome and Mobile Genetic Elements Harboring bla KPC- 2 or bla NDM1. Front Microbiol. 2020. https://doi.org/10.3389/fmicb.2020.01563
2. Murray P, Roshental K, Pfaller M. Microbiología médica. Vol. 7. 2013. 109–350 p.
3. Reyes JA, Melano R, Cárdenas PA, Trueba G. Mobile genetic elements associated with carbapenemase genes in South American Enterobacterales. Braz J Infect Dis. 2020 May 1; 24(3):231–238. https://doi.org/10.1016/j.bjid.2020.03.002
4. Universidad Autónoma de Coahuila Facultad de Medicina Unidad Torreón. Mecanismos De Resistencia Intrínseca y Adquirida a Antibióticos En Bacterias. Revista Medicina de Torreón. 2016;8(2).
5. Clinical and Laboratory Standards Institute (CLSI). M100 PERFORMANCE STANDARDS FOR ANTIMICROBIAL SUSCEPTIBILITY TESTING. Vol. 33. CLSI; 2023.
6. Gómez BJP, Pazmiño JPR, Quinde GSG, Viejó JFG, Amaguaña MJM, Neira ÉIR, et al. Multidrug-Resistant Klebsiella pneumoniae in a Patient with SARS-Cov-2 Pneumonia in an Intensive Care Unit in Guayaquil, Ecuador: A Case Report. Am J Med Case Rep. 2022;23. https://doi.org/10.12659/AJCR.936498
7. Pan American Health Organization. Epidemiological Alert Emergence and increase of new combinations of carbapenemases in Enterobacterales in Latin America and the Caribbean. Rev Panam Salud Publica. 2021. http://www.paho.org
8. Organización Panamericana de la Salud. Guía para el uso correcto de los equipos automatizados para identificación bacteriana y su correspondiente prueba de susceptibilidad. 2011. 5–35 p.
9. Organización Panamericana de la Salud. Resistance percentages for selected pathogens [Internet]. https://www3.paho.org/data/index.php/en/mnu-topics/antimicrobial-resistance/571-amr-vig-en.html
10. Organización Panamericana de la Salud. Alerta Epidemiológica: Emergencia e incremento. Rev Panam Salud Publica. 2021;1–8.
11. Nicola F, Cejas D, González-Espinosa F, Relloso S, Herrera F, Bonvehí P, et al. Outbreak of Klebsiella pneumoniae ST11 Resistant To Ceftazidime-Avibactam Producing KPC-31 and the Novel Variant KPC-115 during COVID-19 Pandemic in Argentina. Microbiol Spectr. 2022;10(6). https://doi.org/10.1128/spectrum.03733-22
12. Rodrigues YC, Lobato ARF, Quaresma AJPG, Guerra LMGD, Brasiliense DM. The Spread of NDM-1 and NDM-7-Producing Klebsiella pneumoniae Is Driven by Multiclonal Expansion of High-Risk Clones in Healthcare Institutions in the State of Pará, Brazilian Amazon Region. Antibiotics (Basel). 2021;10(12). https://doi.org/10.3390/antibiotics10121527
13. Quezada-Aguiluz M, Opazo-Capurro A, Lincopan N, Esposito F, Fuga B, Mella-Montecino S, et al. Novel Megaplasmid Driving NDM-1-Mediated Carbapenem Resistance in Klebsiella pneumoniae ST1588 in South America. Antibiotics (Basel). 2022 Sep 1; 11(9). https://doi.org/10.3390/antibiotics11091207
14. Remolina G. SA, Conde M. CE, Escobar C. JC, Leal C. AL, Bravo O. JS, Saavedra R. SY, et al. Carbapenemases produced in Klebsiella spp., and Pseudomonas aeruginosa in six hospitals in Bogotá - Colombia. Rev Chilena Infectol. 2021; 38(5):720–723. https://doi.org/10.4067/s0716-10182021000500720
15. Guerra-Sarmiento M, Ruíz-Martin-Leyes F, Arzuza-Ortega L, Maestre-Serrano R, Guerra-Sarmiento M, Ruíz-Martin-Leyes F, et al. Caracterización de bacilos gramnegativos multi-resistentes, aislados en pacientes hospitalizados en instituciones de salud de Barranquilla (Colombia). Rev Chilena Infectol. 2021; 38(2):189–196. https://doi.org/10.4067/S0716-10182021000200189
16. Aquino-Andrade A, Merida-Vieyra J, Arias De La Garza E, Arzate-Barbosa P, De Colsa Ranero A. Carbapenemase-producing Enterobacteriaceae in Mexico: report of seven non-clonal cases in a pediatric hospital. BMC microbiol. 2018;18(1):38. https://doi.org/10.1186/s12866-018-1166-z
17. Toledano-Tableros JE, Gayosso-Vázquez C, Jarillo-Quijada MD, Fernández-Vázquez JL, Morfin-Otero R, Rodríguez-Noriega E, et al. Dissemination of bla NDM- 1 Gene Among Several Klebsiella pneumoniae Sequence Types in Mexico Associated With Horizontal Transfer Mediated by IncF-Like Plasmids. Front Microbiol. 2021;12. https://doi.org/10.3389/fmicb.2021.611274
18. Instituto Nacional de Investigación en Salud Pública. Centro de Referencia Nacional de Resistencia a los Antimicrobianos Resumen Ejecutivo. 2022.
19. Angles-Yanqui E, Huaringa-Marcelo J, Sacsaquispe-Contreras R, Pampa-Espinoza L. Panorama of carbapenemases in Peru. Rev Panam Salud Publica. 2020;44(1):61. https://doi.org/10.26633/RPSP.2020.61
20. Carrasco-Anabalón S, Vera-Leiva A, Quezada-Aguiluz M, Morales-Rivera MF, Lima CA, Fernández J, et al. Genetic Platforms of blaCTX-M in Carbapenemase-Producing Strains of K. pneumoniae Isolated in Chile. Front Microbiol. 2018;9:324. https://doi.org/10.3389/fmicb.2018.00324
21. Villegas MV, Pallares CJ, Escandón-Vargas K, Hernández-Gómez C, Correa A, Álvarez C, et al. Characterization and Clinical Impact of Bloodstream Infection Caused by Carbapenemase-Producing Enterobacteriaceae in Seven Latin American Countries. PLoS One. 2016;11(4). https://doi.org/10.1371/journal.pone.0154092
22. Pitout JDD, Peirano G, Kock MM, Strydom KA, Matsumura Y. The Global Ascendency of OXA-48-Type Carbapenemases. Clin Microbiol Rev. 2019;33(1). https://doi.org/10.1128/CMR.00102-19
23. Salazar C, Antelo V, Vieytes M, Dávila C, Grill F, Galiana A, et al. First detection and origin of multi-drug resistant Klebsiella pneumoniae ST15 harboring OXA-48 in South America. J Glob Antimicrob Resist. 2022 Sep 1; 30:480–484. https://doi.org/10.1016/j.jgar.2022.08.005
24. Villacís JE, Reyes JA, Castelán-Sánchez HG, Dávila-Ramos S, Lazo MA, Wali A, et al. microorganisms OXA-48 Carbapenemase in Klebsiella pneumoniae Sequence Type 307 in Ecuador. Microorganisms journal. 2020; 8(435). https://doi.org/10.3390/microorganisms8030435
25. Vásquez-Ponce F, Dantas K, Becerra J, Melocco G, Esposito F, Cardoso B, et al. Detecting KPC-2 and NDM-1 Coexpression in Klebsiella pneumoniae Complex from Human and Animal Hosts in South America. Microbiol Spectr. 2022;10(5). https://doi.org/10.1128/spectrum.01159-22
26. Bocanegra-Ibarias P, Camacho-Ortiz A, Garza-González E, Flores-Treviño S, Kim H, Perez-Alba E. Aztreonam plus ceftazidime-avibactam as treatment of NDM-1-producing Klebsiella pneumoniae bacteraemia in a neutropenic patient: Last resort therapy? J Glob Antimicrob Resist. 2020;23:417–419. https://doi.org/10.1016/j.jgar.2020.10.019
27. Romero-Alvarez D, Reyes J, Quezada V, Satán C, Cevallos N, Barrera S, et al. First case of New Delhi metallo-β-lactamase in Klebsiella pneumoniae from Ecuador: An update for South America. Int J Infect Dis. 2017; 65:119–121. https://doi.org/10.1016/j.ijid.2017.10.012
28. Aguilar-Zapata D, Duran-Bedolla J, López-Jácome LE, Barrios-Camacho H, Garza-Ramos U, Valdez-Vázquez R. Klebsiella pneumoniae K2 producer of pyogenic liver abscess associated with biliary communication. J Infect Dev Ctries. 2022;16(9):1524–1529. https://doi.org/10.3855/jidc.15914
29. Cejas D, Elena A, Guevara Nuñez D, Sevilla Platero P, De Paulis A, Magariños F, et al. Changing epidemiology of KPC-producing Klebsiella pneumoniae in Argentina: Emergence of hypermucoviscous ST25 and high-risk clone ST307. J Glob Antimicrob Resist. 2019;18:238–242. https://doi.org/10.1016/j.jgar.2019.06.005
30. Sanctis G De, Ferraris A, Ducatenzeiler L, Benso J, Fernández-Otero L, Angriman F, et al. Factores predictores de mortalidad intrahospitalaria en pacientes adultos con infecciones por Klebsiella pneumoniae resistente a carbapenémicos y colistín: un estudio de cohorte retrospectivo. Rev Chilena Infectol. 2018; 35(3):239–245. https://doi.org/10.4067/s0716-10182018000300239
31. Rossi Gonçalves I, Ferreira ML, Araujo BF, Campos PA, Royer S, Batistão DWF, et al. Outbreaks of colistin-resistant and colistin-susceptible KPC-producing Klebsiella pneumoniae in a Brazilian intensive care unit. Journal of Hospital Infection. 2016;94(4):322–329. https://doi.org/10.1016/j.jhin.2016.08.019
32. Satán C, Satyanarayana S, Shringarpure K, Mendoza-Ticona A, Palanivel C, Jaramillo K, et al. Epidemiology of antimicrobial resistance in bacteria isolated from inpatient and outpatient samples, Ecuador, 2018. Rev Panam Salud Publica. 2023;47:14. https://doi.org/10.26633/RPSP.2023.14
33. Servicio Antimicrobianos E. Programa Nacional De Control De Calidad En Bacteriología Boletín Informativo Nro. 4-Abril 2021. 2021. http://antimicrobianos.com.ar/category/alerta/
34. Marquez C, Ingold A, Echeverría N, Acevedo A, Vignoli R, García-Fulgueiras V, et al. Emergence of KPC-producing Klebsiella pneumoniae in Uruguay: infection control and molecular characterization. New Microbes New Infect. 2014;2(3):58–63. https://doi.org/10.1002/nmi2.40
35. Organización Panamericana de la Salud. El impacto de la COVID-19 en la resistencia antimicrobiana. 2021. https://www.paho.org/es/noticias/17-11-2021-impacto-covid-19-resistencia-antimicrobiana
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación
CONFLICTO DE INTERESES
No existen conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Erazo Bravo Jennifer Dayana.
Investigación: Erazo Bravo Jennifer Dayana.
Metodología: Erazo Bravo Jennifer Dayana., Jaramillo Rúales Evelyn Katherine.
Administración del proyecto: Jaramillo Rúales Evelyn Katherine.
Supervisión: Jaramillo Rúales Evelyn Katherine.
Redacción – borrador original: Erazo Bravo Jennifer Dayana, Jaramillo Rúales Evelyn Katherine.
Redacción – revisión y edición: Erazo Bravo Jennifer Dayana, Jaramillo Rúales Evelyn Katherine.