REVISIÓN SISTEMÁTICA
Cardiometabolic effect of sodium and glucosa cotransporter inhibitors type 2
Efecto cardiometabólico de los inhibidores del cotransportador de sodio y glucosa tipo 2
Melissa Olmedo-Muñoz1 ![]() *, Ricardo Recalde-Navarrete1
*, Ricardo Recalde-Navarrete1 ![]() *
*
1Universidad Técnica Ambato, Ambato, Ecuador.
Citar como: Olmedo-Muñoz M, Recalde-Navarrete R. Cardiometabolic effect of sodium and glucosa cotransporter inhibitors type 2. Salud, Ciencia y Tecnología 2023;3:563. https://doi.org/10.56294/saludcyt2023563.
Enviado: 10-08-2023 Revisado: 03-09-2023 Aceptado: 15-10-2023 Publicado: 16-10-2023
Editor: Dr.
William Castillo-González ![]()
ABSTRACT
Introduction: type 2 diabetes mellitus has emerged as a leading cause of premature death and a growing threat to the healthcare system due to the high costs of medical care in the context of cardiovascular complications.
Methods: we conducted a systematic electronic search of clinical trials published from 2015 to January 2023 in PubMed, Scopus, Web of Science and ScieLO databases, which evaluated the efficacy and safety of the use of type 2 sodium-glucose cotransporter inhibitors in patients with type 2 diabetes mellitus and established cardiovascular disease on routine treatment and their cost-effectiveness.
Results: significantly lower rates of acute myocardial infarction, stroke, cardiovascular death and hospitalization due to heart failure were observed when the study drugs were added to standard therapy. In addition, it was evidenced that the reduction in cardiovascular clinical events manages to offset the cost of type 2 sodium-glucose cotransporter inhibitors resulting in a cost-effective use of resources at the health care level.
Conclusions: as the transition to a new evidence-based era of managing patients with type 2 diabetes mellitus and cardiovascular disease progresses, it is imperative that new therapies are developed that not only improve glycemic control, but also improve cardiovascular outcomes, because these events represent the major cause of mortality in this population.
Keywords: Diabetes; Cotransporter; Sodium; Glucose; Cardioprotection; Cost Effectiveness.
RESUMEN
Introducción: la diabetes mellitus tipo 2 se ha constituido como una de las principales causas de muerte prematura y una amenaza creciente para el sistema sanitario, debido a los altos costos que conlleva la atención médica en el contexto de las complicaciones cardiovasculares.
Métodos: se llevó a cabo una búsqueda electrónica sistemática de ensayos clínicos publicados desde el 2015 hasta enero del 2023 en las bases de datos PubMed, Scopus, Web of Science y ScieLO, los cuales evaluaron la eficacia y seguridad del uso de los inhibidores del cotransportador de sodio y glucosa tipo 2 en pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida en tratamiento habitual y su costo-efectividad.
Resultados: se observaron tasas significativamente más bajas de infarto agudo de miocardio, accidente cerebrovascular, muerte por causa cardiovascular y hospitalización debido insuficiencia cardiaca cuando los fármacos en estudio se añadieron a la terapia estándar. Además, se evidenció que la reducción de los eventos clínicos cardiovasculares logra compensar el costo de los inhibidores del cotransportador de sodio y glucosa tipo 2 dando lugar a un uso costo-efectivo de los recursos a nivel salud.
Conclusiones: a medida que avanza la transición a una nueva era basada en la evidencia del manejo de pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular, es imperativo que se desarrollen nuevas terapias que no solo mejoren el control glucémico, sino que también mejoren los resultados cardiovasculares, debido a que estos eventos representan la mayor causa de mortalidad en esta población.
Palabras clave: Diabetes; Cotransportador; Sodio; Glucosa; Cardioprotección; Costo-Efectividad.
INTRODUCCIÓN
La diabetes mellitus (DM) se define como un estado de hiperglucemia persistente debido a diferentes mecanismos. La diabetes mellitus tipo 1 (DM1), se caracteriza por la agresión autoinmune a las células beta pancreáticas en individuos con alta susceptibilidad genética y afecta principalmente a la población joven. Por otra parte, la diabetes mellitus tipo 2 (DM2) es causada por la resistencia insulínica a nivel celular provocando un estado hiperglucémico persistente. Junto a los eventos cardiovasculares, la DM2 se cataloga como la mayor crisis sanitaria mundial del siglo XXI, convirtiéndose en una de las principales causas del aumento del riesgo de muerte prematura, por lo que representa una amenaza creciente para la salud.(1,2)
La incidencia de la DM está aumentando dramáticamente en todo el mundo. En las últimas tres décadas, la carga mundial de diabetes aumentó de 30 millones en 1985 a 382 millones en 2014, y las tendencias actuales sugieren que estas tasas seguirán aumentando. Las últimas estimaciones de la Federación Internacional de Diabetes predicen que para 2035, 591 millones de personas en todo el mundo, o 1 de cada 10, tendrán diabetes.(3)
Si bien las tasas de DM1 y DM2 están aumentando, la DM2 tiene una contribución desproporcionadamente mayor al aumento de la prevalencia de la DM a nivel mundial en comparación con la DM1. Una consecuencia del crecimiento de las tasas de DM es una carga económica considerable tanto para el paciente como para el sistema sanitario.(3)
En los Estados Unidos, el costo total de la DM promedia $2108 por paciente cada año, que es casi el doble que el de los pacientes no diabéticos. La carga económica asociada es sustancial tanto en términos de los costos directos de la atención médica como de los costos indirectos de la disminución de la productividad relacionada con la morbilidad y la mortalidad relacionadas con la diabetes.(3)
En el Ecuador, la DM se constituye como la segunda causa de muerte luego de las enfermedades isquémicas del corazón, evidenciándose un total de 2533 defunciones para el año 2000 y 4895 hasta el 2017 con una tendencia de crecimiento para los próximos años.(4)
De acuerdo con el documento “Costeo de la Enfermedad Diabetes Mellitus Tipo 2” publicado por el Ministerio de Salud Pública del Ecuador (MSP) en el 2013, se estima que en un paciente con DM sin complicaciones y con un tratamiento farmacológico simple, el estado invierte aproximadamente $826 al año y $27 600 por esperanza de vida. Por otra parte, en un paciente que ha desarrollado complicaciones crónicas a partir de la diabetes, el costo es alrededor de $22 520 al año y $296 005 por esperanza de vida.(5)
Los costos directos de esta patología se atribuyen a las complicaciones tanto macrovasculares como microvasculares como la enfermedad de las arterias coronarias, el infarto de miocardio, la hipertensión, la enfermedad vascular periférica, la retinopatía, la nefropatía terminal y la neuropatía.(3,6)
La glucotoxicidad cardiaca acompañada de un inadecuado control metabólico puede llegar a comprometer en gran medida la calidad de vida de un paciente diabético con altas tasas de ausentismo laboral, hospitalizaciones recurrentes y alta mortalidad. De esta manera, las principales enfermedades cardiovasculares (ECV) que se encuentran asociadas a la DM2 incluyen, la cardiopatía isquémica, la insuficiencia cardiaca, el accidente cerebrovascular y la enfermedad arterial coronaria y periférica llegando a provocar la muerte en el 50 % de los casos.(7,8)
Esta estrecha relación fisiopatológica ha hecho que surja la necesidad de estudiar fármacos con efecto pleiotrópico. Así, múltiples trabajos de investigación han informado que los inhibidores del cotransportador de sodio glucosa tipo 2 (SGLT2), un grupo farmacológico de antidiabéticos orales, no solo inhiben la reabsorción de glucosa en los túbulos renales, sino que además, disminuyen el riesgo de eventos cardiovasculares minimizando el desarrollo o la progresión de la insuficiencia cardiaca.(7)
De forma particular, el uso de los inhibidores del SGLT2 ha demostrado ser beneficioso en el manejo de la insuficiencia cardiaca y enfermedad renal en ausencia de diabetes como patología central.(9,10)
El objetivo de esta revisión sistemática es evaluar la eficacia y seguridad de los inhibidores del SGLT2 en los pacientes con DM2 y enfermedad cardiovascular establecida en tratamiento habitual y su costo-efectividad.
MÉTODOS
Criterios de elegibilidad
Se incluyeron ensayos clínicos aleatorizados que evaluaron la eficacia y seguridad del uso de los inhibidores del SGLT2 en pacientes con DM2 y enfermedad cardiovascular establecida en tratamiento habitual y su costo-efectividad. Se consideraron estudios en inglés y español de los últimos 5 años. Se excluyeron los estudios realizados en animales y pacientes sin DM2 con enfermedad cardiovascular establecida. Además, no se consideraron estudios que no valoraban estadísticamente los efectos adversos de estos hipoglicemiantes orales.
Estrategias de búsqueda
Se llevó a cabo una búsqueda electrónica sistemática de artículos publicados desde el 2015 hasta enero del 2023 en las bases de datos PubMed, Scopus, Web of Science y ScieLO. Se utilizaron términos MeSH en inglés y español: cardiomatabolic, inhibitors, cotransporter, sodium-glucose type 2, diabetes, acute myocardial infarction, stroke, hospitalization, cardiovascular death, cost-efectiveness, randomized controlled trial, original article.
Selección de estudios
Se eligieron ensayos clínicos aleatorizados y artículos originales, los cuales proporcionan el cociente de riesgo instantáneo (HR), intervalo de confianza (IC) y nivel de significancia (p) de infarto agudo de miocardio, accidente cerebrovascular, muerte por causa cardiovascular y hospitalización debido insuficiencia cardiaca en pacientes diabéticos al añadir un inhibidor del SGLT2 al tratamiento estándar valorando los efectos adversos de estos fármacos.
Extracción y síntesis de resultados
Se realizó mediante el uso de un formulario que incluye: autores, año de publicación, diseño, uso de inhibidores del SGLT2, muestra, país, edad y sexo del grupo de estudio, presencia de diabetes, hemoglobina glicosilada, riesgo cardiovascular, duración del seguimiento. Además, se utilizó otro formulario para la identificación del tratamiento habitual de los pacientes.
RESULTADOS
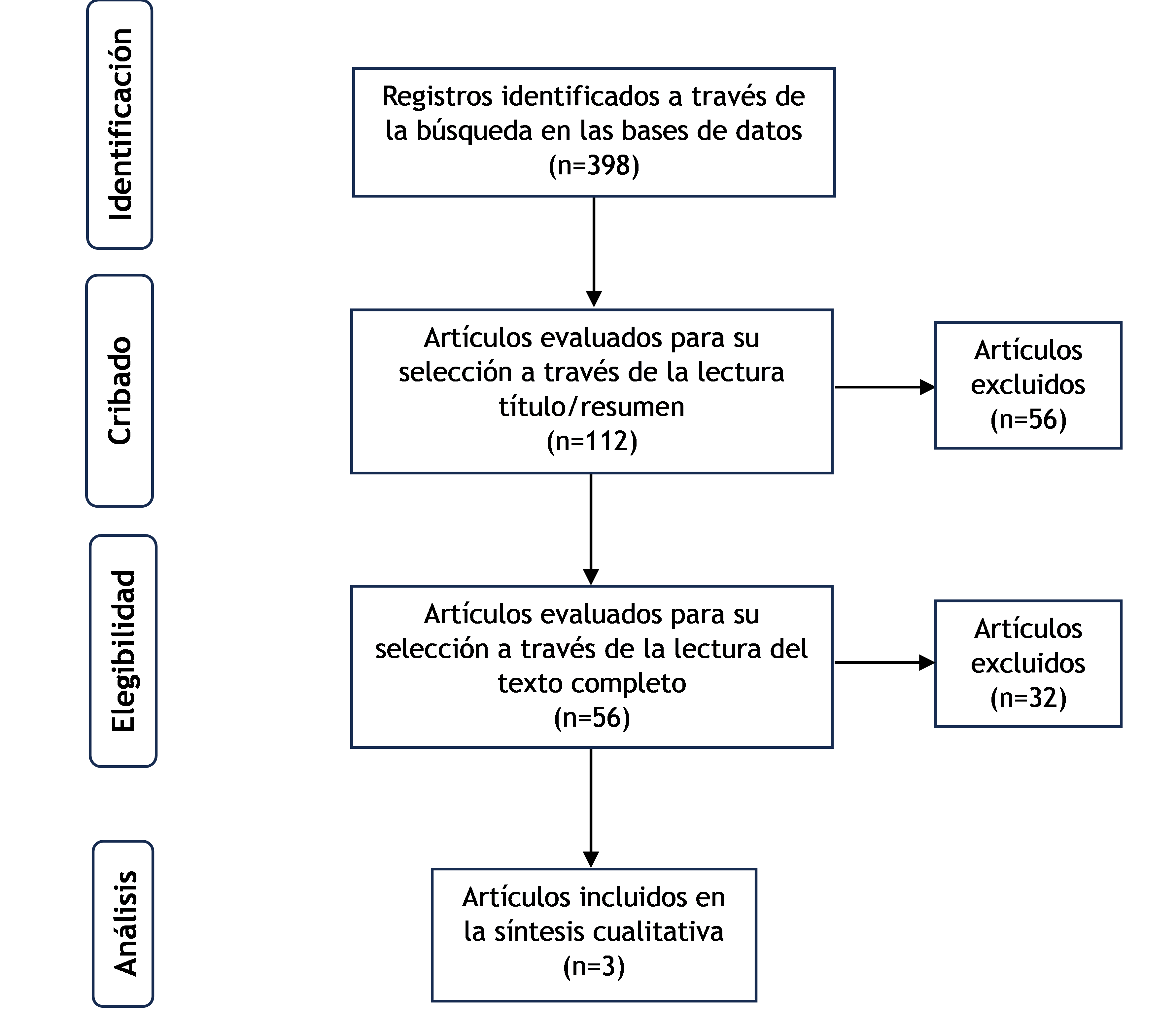
Figura 1. Diagrama de flujo de selección de los estudios PRISMA
Análisis de los efectos cardioprotectores de los inhibidores del SGLT2 en pacientes con DM2
|
Tabla 1. Principales estudios que se incluyeron en la revisión sistemática |
|||
|
Nº |
1 |
2 |
3 |
|
Autores |
Zinman et al |
Neal et al |
Wiviott et al |
|
Titulo |
EMPA-REG OUTCOME |
CANVAS |
DECLARE TIMI-58 |
|
Año |
2015 |
2017 |
2018 |
|
Tipo de estudio |
Ensayo clínico aleatorizado |
Ensayo clínico aleatorizado |
Ensayo clínico aleatorizado |
|
Inhibidores del SGLT2 |
Empaglifozina 10-25 mg/día |
Canaglifozina 100-300 mg/día |
Dapaglifozina 10 mg/día |
|
Muestra |
7020 ISGLT2: 4687 Placebo: 2333 |
10142 |
17160 ISGLT2: 8582 Placebo: 8578 |
|
País |
Multicéntrico |
Multicéntrico |
Multicéntrico |
|
Edad |
ISGLT2: 64,5 ± 8,8 Placebo: 64,5 ± 8,9 |
63,3 ± 8,3 |
|
|
Sexo |
ISGLT2 Mujeres: 30,7 % Hombres: 69,3 % Placebo Mujeres: 28,3 % Hombres: 71,7 % |
Mujeres: 36 % Hombres: 64 % |
Mujeres: 33,5 % Hombres: 66,5 % |
|
Diabetes |
100 % |
100 % |
100 % |
|
Hemoglobina glicosilada |
<8,5 % ISGLT2: 3212 Placebo: 1607 >8,5 % ISGLT2: 1475 Placebo: 726 |
<8 % ISGLT2: 24,7 Placebo: 29,6 >8 % ISGLT2: 28,8 Placebo: 35,3 |
8,3 ± 1,2 |
|
Riesgo cardiovascular |
|||
|
Enfermedad cerebrovascular |
ISGLT2: 635 Placebo: 325 |
ISGLT2: 34,1 Placebo: 41,3 |
ISGLT2: 653 Placebo: 648 |
|
Enfermedad coronaria |
ISGLT2: 2732 Placebo: 1340 |
ISGLT2: 42,2 Placebo: 51,4 |
ISGLT2: 2824 Placebo: 2834 |
|
Arteriopatía periférica |
ISGLT2: 412 Placebo: 191 |
ISGLT2: 33,9 Placebo: 41,3 |
ISGLT2: 522 Placebo: 503 |
|
2 o 3 categorías de alto riesgo |
ISGLT2: 878 Placebo: 451 |
- |
- |
|
Tiempo de seguimiento |
162 semanas |
188 semanas |
219 semanas |
|
Tabla 2. Tratamiento habitual |
|||
|
Tratamiento estándar |
1 |
2 |
3 |
|
Insulina |
No ISGLT2: 2435 Placebo: 1198 Si ISGLT2: 2252 Placebo: 1135 |
No ISGLT2: 21,9 Placebo: 25,6 Si ISGLT2: 32,0 Placebo: 37,4 |
ISGLT2: 3567 Placebo: 3446 |
|
Estatinas o ezetimiba |
No ISGLT2: 1029 Placebo: 551 Si ISGLT2: 3658 Placebo: 1782 |
No ISGLT2: 28,7 Placebo: 31,1 Si ISGLT2: 26,3 Placebo: 31,6 |
|
|
Inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARA II) |
No ISGLT2: 889 Placebo: 465 Si ISGLT2: 3798 Placebo: 1868 |
- |
ISGLT2: 6977 Placebo: 5242 |
|
Betabloqueante |
No ISGLT2: 1631 Placebo: 835 Si ISGLT2: 3056 Placebo: 1868 |
No ISGLT2: 24,4 Placebo: 31,8 Si ISGLT2: 29,5 Placebo: 39,0 |
ISGLT2: 4498 Placebo: 4532 |
|
Diurético |
No ISGLT2: 2640 Placebo: 1345 Si ISGLT2: 2047 Placebo: 988 |
No ISGLT2: 26,4 Placebo: 24,0 Si ISGLT2: 27,6 Placebo: 41 |
ISGLT2: 3488 Placebo: 3479 |
Zinman et al.(11) evaluaron la seguridad cardiovascular de empaglifozina en pacientes con DM2 mayor a 10 años y riesgo de eventos cardiovasculares. El resultado primario consistió en una combinación de muerte por causas cardiovasculares, infarto de miocardio o accidente cardiovascular no fatal con empaglifozina frente al placebo y fue de 10,5 % a 12,1 %, (HR 0,86; intervalo de confianza (IC) 95%: 0,72 a 1,01; p<0,001 para la no inferioridad; p=0,04 para la superioridad). En lo que respecta al resultado secundario que incluye el resultado primario y la hospitalización por angina inestable, se observó un porcentaje de 12,8 % con empaglifozina frente a 14,3 % con placebo (HR 0,89; IC 95%: 0,73 a 1,02; p<0,001 para no inferioridad; p=0,08 para superioridad).(12)
Luego de 12 semanas durante las cuales el tratamiento hipoglicemiante debía permanecer inalterado, el cambio medio de la hemoglobina glicosilada (HbA1c) con empaglifozina 10 mg en comparación con placebo fue de -0,5 % mientras que con empaglifozina 25 miligramos de -0,6 % Por otro lado, el uso de empaglifozina se asoció a pequeñas reducciones del peso, perímetro de cintura, ácido úrico y presión arterial sistólica y diastólica sin incremento de la frecuencia cardiaca.(11)
Las reacciones adversas fueron similares en el grupo de pacientes con empaglifozina y en el grupo con placebo. Así, se evidenció infección de vías urinas en 18 % de los pacientes en tratamiento con empaglifozina y en 18,1 % con placebo. Sin embargo, la infección genital apareció en 6,4 % frente a 1,8 %. Otro de los efectos adversos fue la hipoglicemia, que se presentó en 27,8 % de pacientes con empaglifozina y en 27,9 % con placebo. La cetoacidosis diabética tuvo lugar en 0,1 % de pacientes frente a <0,1 %. Los estados de depleción de volumen se presentaron en 5,9 % con el inhibidor del SGLT2 y en 4,9 % con placebo.(11)
Por su parte, el estudio CANVAS, llevado a cabo por Neal et al.(13), incluyó como resultado primario un compuesto de muerte por causas cardiovasculares e infarto de miocardio o accidente cerebrovascular no fatal, el cual se presentó en 26,9 % de los pacientes que usaron canaglifozina frente a 31,5 % con placebo (HR 0,86; IC 95%: 0,75 a 0,97; p<0,001 para no inferioridad; p=0,02 para superioridad). Por otro lado, el resultado secundario para la prueba de hipótesis condicional secuencia fue muerte por cualquier causa, muerte por causa cardiovascular, progresión de la albuminuria (aumento mayor al 30 %) y el compuesto de muerte por causas cardiovasculares y hospitalización por insuficiencia cardiaca. Sin embrago, no se demostró superioridad para muerte por cualquier causa (p=0,24) interrumpiéndose el resultado de la hipótesis. De esta manera, los resultados de mortalidad que incluyen la muerte por cualquier causa (HR 0,87; IC del 95 %: 0,74 a 1,01) y la muerte por causas cardiovasculares (HR 0,87; IC del 95 %: 0,72 a 1,06) no fueron considerados significativos.
Por su parte, la regresión de la albuminuria se presentó en 293,4 pacientes con canaglifozina frente a 187,5 con placebo (HR 1,70; IC del 95 %: 1,51 a 1,91).(13)
La diferencia media en los niveles de HbA1c en el grupo de canaglifozina y el grupo con placebo fue -0,5 % (IC 95%: 0,61 a 0,56). La diferencia del peso corporal fue -1,60 kg, IC 95%:1,70 a 1,51). Además, se hallaron beneficios directos a nivel cardiovascular, los cuales incluyen la disminución de la presión arterial sistólica en -3,9 mmHg (IC 95%: 4,30 a 3,56) y de la presión diastólica en -1,3 mmHg (IC 95%: 1,61 a 1,17; p < 0,001) para todas las comparaciones. El uso de otros agentes hipoglicemiantes fue 9,3 % menor en el grupo de canaglifozina (IC 95%: 11,0 a 7,6).(13)
Se observaron eventos adversos previamente informados como infección genital y depleción de volumen y diuresis. Sin embargo, existió mayor riesgo de amputación de extremidades inferiores y dedos de los pies con canaglifozina que con el placebo en 6,3 pacientes frente a 3,4, respectivamente (HR 1,97; IC 95%: 1,41 a 2,75).(13)
DECLARE-TIMI-58 fue un estudio llevado a cabo por Wiviott et al.(14) con el objetivo de evaluar el efecto cardiovascular en pacientes con riesgo o enfermedad cardiovascular aterosclerótica. Los resultados principales fueron un resultado de seguridad primario de eventos cardiovasculares adversos mayores y muerte por causa cardiovascular u hospitalización por insuficiencia cardiaca. Así, la tasa de muerte por causa cardiovascular u hospitalización por insuficiencia cardiovascular fue más baja con dapaglifozina en 4,9 % de los pacientes frente a 5,8 % con placebo (HR 0,83; IC del 95 %: 0,73 a 0,95; p = 0,005). Cabe recalcar que este resultado compuesto fue más bajo en el grupo que usó el inhibidor del SGLT2 debido a la baja tasa de hospitalización por insuficiencia cardiaca. No se evidenció una diferencia significativa entre los dos grupos en la tasa de muerte cardiovascular (HR 0,98; IC del 95%: 0,82 a 1,17). Esta eficacia fue similar en el grupo de pacientes con múltiples factores de riesgo y enfermedad cardiovascular aterosclerótica establecida. Además, dapaglifozina no resulto ser superior en el resultado de seguridad primario de eventos cardiovasculares adversos frente al placebo (IC del 95 %, 0,71 a 0,98).
En cuanto a los resultados clave de seguridad, las tasas de amputación, fractura, depleción de volumen e hipersensibilidad fueron similares en los dos grupos. Sin embargo, la cetoacidosis diabética, se presentó mayormente en el grupo de dapaglofozina en un 0,3 % frente a 0,1 % (HR 2,18; IC del 95 %:1,10 a 4,30; p=0,02). Las infecciones genitales fueron más frecuentes en el grupo de dapaglifozina en un 0,9 % frente a 0,1 % o (HR 8,36; IC del 95 %: 4,19 a 16,68; p<0,001) tanto en hombres como mujeres. Además, se informó 1 caso de gangrena de Fournier con dapaglifozina y 5 con placebo.(14)
DISCUSIÓN
El presente trabajo de investigación incluyó 3 ensayos clínicos aleatorizados que evalúan la seguridad del uso de los inhibidores del SGLT2 en pacientes con DM2 y enfermedad cardiovascular establecida en tratamiento habitual frente al placebo considerando la muerte por causa cardiovascular, la hospitalización por insuficiencia cardiaca y los efectos adversos relacionados con estos fármacos evidenciándose buenos resultados en cuanto a la cardioprotección.
En 2019, McMurray et al.(15), valoraron el riesgo de una primera hospitalización por insuficiencia cardiaca y muerte por causa cardiovascular independientemente de la presencia o ausencia de DM2 a través del ensayo clínico denominado DAPA-HF. De esta manera, se concluyó que el riesgo fue menor en el grupo que recibía dapaglifozina frente al placebo.
En 2020, en el ensayo clínico VERTIS CV, Consentino et al.(16), describieron los resultados acerca de la eficacia de la ertuglifozina en eventos relacionados con la insuficiencia cardiaca en pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica establecida evidenciándose que es el cuarto inhibidor del SGLT2 con efecto cardiometabólico. Se observó una reducción de hospitalizaciones por insuficiencia cardiaca, sin embargo, los eventos cardiacos adversos mayores no fueron estadísticamente significativos a comparación de empaglifozina y canaglifozina.
En 2021, Bhatt et al.(17), realizaron un ensayo multicéntrico llamado SCORED con el fin de evaluar el efecto cardiometabólico de sotaglifozina en pacientes con DM2 y enfermedad renal crónica con o sin albuminuria. Así, se evidenció una menor tasa de riesgo de hospitalización por insuficiencia cardiaca, visitas médicas urgentes por insuficiencia cardiaca y muerte por causa cardiovascular. Sin embargo, se informó que los eventos adversos más frecuentes con sotaglifozina fueron la diarrea, cetoacidosis diabética, infecciones genitales de origen micótico y depleción de volumen. No se observó diferencias entre el grupo del inhibidor del SGLT2 y del placebo con respecto a las fracturas óseas, infecciones del tracto urinario e hipoglicemia grave. En el mismo año, Bhatt et al.(18), realizaron otro estudio denominado SOLOIST-WHF para evaluar la eficacia y seguridad de sotaglifozina cuando se inicia poco después de un episodio de insuficiencia cardiaca descompensada. Se encontró que la tasa de una nueva hospitalización y muerte por causa cardiovascular fue significativamente menor en el grupo del inhibidor del SGLT2.
En el 2020, un metaanálisis confirmo la reducción constante del riesgo de hospitalizaciones por insuficiencia cardiaca independientemente de los antecedentes de enfermedad cardiovascular aterosclerótica o la función renal al inicio del tratamiento.(19)
De acuerdo con varios estudios que evalúan la relación costo-eficacia de los inhibidores del SGLT2, estos fármacos han logrado reducir los costos sanitarios que conllevan las complicaciones cardiovasculares si se añaden a la terapia habitual de los pacientes con DM2 y alto riesgo. De esta manera, Kansal et al.(20) desarrollaron un modelo económico con el fin de extrapolar los resultados clínicos y costos de las personas con DM2 y enfermedad cardiovascular establecida que participaron en el ensayo EMPA-REG OUTCOME y se concluyó que los resultados cardiovasculares observados en el estudio se convirtieron en beneficios clínicos a largo plazo con costos aceptables. El ahorro se deriva de menores eventos clínicos que compensan parcialmente el costo de empaglifozina, dando lugar a un uso costo-efectivo de los recursos del Servicio Nacional de Salud en Reino Unido (£4083 por años de vida ajustados por calidad, muy por debajo del umbral británico de £30 000 por años de vida ajustados por calidad).
En 2019, Kaku K. et al.(21), publicaron el análisis de rentabilidad de la terapia con empaglifozina más el tratamiento estándar frente al tratamiento estándar solo en los pacientes asiáticos incluidos en el ensayo EMPAREG-OUTCOME, además de los costos médicos de la diabetes y las complicaciones relacionadas con esta patología. Así, se evidenció que añadir el inhibidor del SGLT2 a la terapia estándar obtuvo 10,7 años de vida ajustados por calidad mientras que la terapia estándar sola 8,0 años de vida ajustados por calidad. Esto supone un aumento de 2,7 años de vida ajustados por calidad con empaglifozina a lo largo de la vida. Por otro lado, el costo medio de los eventos cardiovasculares disminuyó en 118 997 yenes, debido a que el número de estos acontecimientos se redujo con el inhibidor del SGLT2.
Abushanab D. et al.(22), desarrollaron un modelo Markov de análisis de decisiones con ciclos de un año y un horizonte temporal de por vida desde la perspectiva del sistema sanitario qatarí en 2019 para comparar la empagliflozina combinada con metformina frente a la monoterapia con metformina en pacientes de 50 a 79 años con DM2 y ECV existente. Así, el modelo logro predecir que añadir empagliflozina al tratamiento estándar daba lugar a 1,9 años de vida salvados y 1,5 años de vida ajustados por calidad adicionales por persona, y un coste incremental de 56 869 QAR (15 619 USD), lo que equivalía a una razón coste-efectividad incremental de 30 675 QAR (8 425 USD) por años de vida salvados y 39 245 QAR (10 779 USD) por años de vida ajustados por calidad. Por lo tanto, empagliflozina combinada con metformina parece ser una opción terapéutica coste-efectiva para los pacientes con DM2 y ECV.
De acuerdo con los resultados del análisis económico realizado con datos del ensayo clínico DECLARE-TIME 58 por McEwan P. et al.(23), se estimó que en Reino Unido que el tratamiento con dapaglifozina era dominante evidenciándose un incremento en los años de vida ajustados por calidad de 10,43 a 10,48 y una disminución de los costos totales a lo largo de la vida de £39 451 a £36 899. De esta manera, se redujo la carga económica de la DM2 y sus complicaciones asociadas.
Estos resultados se relacionan con los obtenidos en un estudio previo llevado a cabo por el mismo autor y otros colaboradores a partir de datos de los 3 ensayos clínicos principales EMPAREG-OUTCOME, CANVAS y DECLARE-TIME 58, donde se observó que los inhibidores del SGLT2 son rentables frente a los hipoglicemiantes orales o placebo, además del tratamiento estándar. Esta afirmación es válida para pacientes con y sin insuficiencia cardiaca previa y pacientes con enfermedad cardiovascular aterosclerótica establecida. Los inhibidores del SGLLT2 también resultaron ser costo-efectivos en el subgrupo de múltiples factores de riesgo en el Reino Unido y China. Sin embargo, los resultados de los análisis en Estados Unidos fueron menos favorables que los presentados para el Reino Unido y China. Esto se debe en gran medida al elevado precio de catálogo del tratamiento con este tipo de fármacos en Estados Unidos en comparación con otros países.(24)
La limitación de esta revisión sistemática radica en que no existen estudios realizados en nuestro país acerca del tema, debido a que los ensayos clínicos requieren de altos costos de intervención y aprobaciones ética y regulatorias, lo cual puede llegar a ser un proceso muy complejo.
Por otra parte, dentro de las implicancias prácticas, la reducción de los eventos clínicos cardiovasculares podría compensar en forma parcial el costo de la adquisición de los inhibidores del SGLT2 ahorrando recursos en la atención de las posibles complicaciones al sistema de salud. Conociendo la relación entre la fisiopatología de la DM2 y sus implicaciones en la producción de eventos cardiovasculares, se seguirán investigando nuevas terapéuticas focalizadas en inhibir fuentes comunes en la génesis de las complicaciones.
CONCLUSIÓN
A medida que hacemos la transición a una nueva era basada en la evidencia del manejo de pacientes con DM2 y enfermedad cardiovascular, es imperativo que se desarrollen nuevas terapias que no solo mejoren el control glucémico, sino que también mejoren los resultados cardiovasculares, debido a que estos eventos representan la mayor causa de mortalidad en esta población. De esta manera, grandes estudios observacionales han demostrado la seguridad y eficacia de los inhibidores del SGLT2 reduciendo la mortalidad por causa cardiovascular, la hospitalización por insuficiencia cardiaca y el infarto de miocardio y accidente cerebrovascular no fatal en los pacientes con DM2 y alto riesgo. Por otra parte, los análisis económicos han evidenciado que añadir un inhibidor del SGLT2 a la terapia habitual es más rentable que asumir costos derivados de las complicaciones cardiovasculares.
REFERENCIAS BIBLIOGRÁFICAS
1. Syed-Z F. Type 1 Diabetes Mellitus. Annals of Internal Medicina. 2022;175(3). doi: https://doi.org/10.7326/AITC202203150
2. Cheng-Xu M, Xiao-Ni M, Cong-Hui G., Ying-Dong L, Dídac M, Song-Bo F. Enfermedad cardiovascular en la diabetes mellitus tipo 2: avances hacia el manejo personalizado. Diabetología cardiovascular. 2022;21(74):1-15. doi: https://doi.org/10.1186/s12933-022-01516-6
3. Sharma A, Mittal S, Aggarwal R. Diabetes and cardiovascular disease: inter-relation of risk factors and treatment. Future Journal of Pharmaceutical Sciencies. 2020;6(130):1-19. doi: https://doi.org/10.1186/s43094-020-00151-w
4. Zavala-Calahorrano A, Fernández E. Diabetes mellitus tipo 2 en el Ecuador. MEDICIENCIAS UTA. 2018;2(4):3-9. doi: https://doi.org/10.31243/mdc.uta.v2i4.132.2018
5. Jonathan V. [Internet]. Quito. 2017 [citado el 13 de jun 2023]. Disponible en: https://www.edicionmedica.ec/secciones/salud-publica/-cu-nto-cuesta-la-atenci-n-de-los-pacientes-con-diabetes-tipo-2--91250
6. DeFronzo R, Inzucchi S, Abdul-Ghani M, Nissen S. Pioglitazone: The forgotten, cot-effective cardioprotective drug for type 2 diabetes. Sage Journals. 2019;16(2):133-143. doi: https://doi.org/10.1177/1479164118825376
7. García-Arias M, Gonzaga-López T, González-Fernández N, Guzmán-Ramírez P, Ángeles-Acuña A, Enríquez-Peregrino K, et al. Efecto cardiometabólico de los inhibidores del cotransportador sodio glucosa tipo 2 (SGLT2). Med Int Mex. 2018;34(6):924-932. doi: https://doi.org/10.24245/mim. v34i6.2140
8. Rovalino-Castro M, Betancourt Constante M. Revisión bibliográfica sobre diagnóstico y tratamiento de diabetes mellitus tipo 2 en pacientes con síndrome metabólico. RECIMUNDO. 2022;6(1):319-330. doi: 10.26820/recimundo/6.(suppl1).junio.2022.319-330
9. Fonseca-Correa J, Correa Rotter R. Sodium-Glucose Cotransporter 2 Inhibitors Mechanisms of Action: A Review. Front Med. 2021;8 (77):1-7. doi: 10.3389/fmed.2021.777861
10. Morrillas H, Galcera E, Alania E, Seller J, Larumbe A, Nuñez J, Valle A. Sodium-glucose Co-transporter 2 Inhibitors in Acute Heart Failure: A Review of the Available Evidence and Practical Guidance on Clinical Use. Rev. Cardiovasc. Med. 2022;23(4):1-13. doi: 10.31083/j.rcm2304139
11. Zinman B, Wanner C, Lachin J, Fitchett D, Bluhmin E, Hantel S, et al. Empaglifozina, Cardiovascular Outcomes, and Mortality en Type 2 Diabetes. NEJM. 2015,373(22):2117-28. doi: 10.1056/NEJMoa1504720
12. Fitchett D, Inzucchi S, Cannon C, McGuire D, Scirica B, Johansen O, et al. Empagliflozin Reduced Mortality and Hospitalization for Heart Failure Across the Spectrum of Cardiovascular Risk in the EMPA-REG OUTCOME Trial. Circulation. 2019;139(11):1384-95. doi: 10.1161/CIRCULATIONAHA.118.037778
13. Neal B, Perkovic V, Mahaffey K, de Zeeuw D, Fulcher G, Erondu N, et al. Canaglifozina and Cardiovascular and Renal Events in Type 2 Diabetes. NEJM. 2017;377(7):644-57. doi: 10.1056/NEJMoa1611925
14. Wiviott S, Raz I, Bonaca M, Mosenzon O, Kato E, Cahn A, et al. Dapaglifozina and Cardiovascular Outcomes in Type 2 Diabetes. NEJM. 2019;380(4):347-57. Disponible en: doi: 10.1056/NEJMoa1812389
15. McMurray J, Solomon S, Inzucchi S, Kober L, Kosiborod M, Martinez F, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. NEJM. 2019,381(21)1995-2008. doi: 10.1056/NEJMoa1911303
16. Consentino F, Cannon C, Cherney D, Masiukiewicz U, Pratley R, Dagogo-Jack S, et al. Efficacy of Ertugliflozin on Heart Failure–Related Events in Patients With Type 2 Diabetes Mellitus and Established Atherosclerotic Cardiovascular Disease. Circulation. 2020;142 (23):2205-15. doi: 10.1161/CIRCULATIONAHA.120.050255
17. Bhatt D, Szarek M, Pitt B, Cannon C, Leiter L, McGuirre D, et al. Sotagliflozin in Patients with Diabetes and Chronic Kidney Disease. NEJM. 2021;384(2):129-39. doi: 10.1056/NEJMoa2030186
18. Bhatt D, Szarek M, Steg P, Cannon C, Leiter L, McGuire D, et al. Sotagliflozin in Patients with Diabetes and Recent Worsening Heart Failure. NEJM. 2021;384(2):117-28. doi: 10.1056/NEJMoa2030183
19. McGuire D, Shih W, Consentino F, Charbonnel B, Cherney D, Dagogo-Jack S, et al. Association of SGLT2 Inhibitors With Cardiovascular and Kidney Outcomes in Patients With Type 2 Diabetes. JAMA Cardiol. 2021;6(2):148-58. doi: 10.1001/jamacardio.2020.4511
20. Kansal A, Reifsnider S, Proskorovsky I, Zheng Y, Pfarr E, George J, et al. Cost-effectiveness analysis of empagliflozin treatment inpeople with Type 2 diabetes and establishedcardiovascular disease in the EMPA-REG OUTCOME trial. Diabetic Medicine. 2019;36(11):1494-1502. doi: 10.1111/dme.14076
21. Kaku K, Haneda M, Sakamaki H, Atsutaka Y, Murata T, Ustiugova A, et al. Cost-effectiveness Analysis of Empagliflozin in Japan Based on Results From the Asian subpopulation in the EMPA-REG OUTCOME Trial. Clinical Therapeutics. 2019;41(10):2021-40. doi: https://doi.org/10.1016/j.clinthera.2019.07.016
22. Abushanab D, Al-Badriyen D, Lee D, Ademi Z. First-line Treatment with Empagliflozin and Metformin Combination Versus Standard Care for Patients with Type 2 Diabetes Mellitus and Cardiovascular Disease in Qatar. A Cost-Effectiveness Analysis. Curr Probl Cardioll. 2021;47(6):1-20. doi: 10.1016/j.cpcardiol.2021.100852
23. McEwan P, Morgan A, Boyce R, Bergenheim K, Gause-Nilsson I, Bhatt D, et al. The cost-effectiveness of dapagliflozin in treating high-risk patients with type 2 diabetes mellitus: An economic evaluation using data from the DECLARE-TIMI 58 trial. Diabetes Obes Metab. 2021;23(4):1020-29. doi: 10.1111/dom.14308
24. McEwan P, Bennett H, Khunti K, Wilding J, Edmonds C, Thuresson M, et al. Assessing the cost-effectiveness of sodium–glucose cotransporter-2 inhibitors in type 2 diabetes mellitus: A comprehensive economic evaluation using clinical trial and real-world evidence. Diabetes Obes Metab. 2020;22(12):2364-74. doi: 10.1111/dom.14308
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Melissa Olmedo-Muñoz.
Investigación: Melissa Olmedo-Muñoz.
Metodología: Ricardo Recalde-Navarrete.
Redacción – borrador original: Ricardo Recalde-Navarrete.
Redacción – revisión y edición: Melissa Olmedo-Muñoz, Ricardo Recalde-Navarrete.