REVISIÓN
Bibliographic review on hepatopancreatic microsporidiosis in white shrimp penaeus vannamei: a current emerging disease
Revisión bibliográfica sobre microsporidiosis hepatopancreática en camarón blanco penaeus vannamei: una enfermedad emergente actual
Raúl González Salas1 ![]() *, Mildre Mercedes Vidal
del Río1
*, Mildre Mercedes Vidal
del Río1 ![]() *, Marco Paul Medina
Valencia1
*, Marco Paul Medina
Valencia1 ![]() *, Matías Gabriel Jaramillo López1
*, Matías Gabriel Jaramillo López1 ![]() *
*
1Universidad Regional Autónoma de Los Andes, Matriz Ambato, Ecuador.
Citar como: González Salas R, Vidal del Río MM, Medina Valencia MP, Jaramillo López MG. Bibliographic review on hepatopancreatic microsporidiosis in white shrimp penaeus vannamei: a current emerging disease. Salud, Ciencia y Tecnología. 2023; 3:601. https://doi.org/10.56294/saludcyt2023601
Enviado: 07-06-2023 Revisado: 28-09-2023 Aceptado: 19-12-2023 Publicado: 20-12-2023
Editor: Prof.
Dr. William Castillo-González ![]()
ABSTRACT
Aquaculture plays a key role in meeting the growing global demand for food, and shrimp farming in particular plays an important role in the global economy and food security. However, the industry faces formidable challenges, mainly attributed to disease outbreaks. The objective of this review was to reflect on hepatopancreatic microsporidiosis, taxonomy, biological cycle, transmission and diagnosis as an emerging pathology that affects the white shrimp Litopenaeus vannamei. A descriptive bibliographic review study was carried out, with a qualitative and exploratory approach, through the search of scientific articles, books and government documents relevant to the topic of shrimp farming and hepatopancreatic microsporidiosis (HPM). The microsporidium parasite Enterocytozoon hepatopenaei infects the hepatopancreas of its host and causes hepatopancreatic microsporidiosis, a condition that has been associated with slow animal growth and large economic losses. This review addresses the biology and pathophysiology of this disease, the dynamics of transmission and infection by this pathogenic agent and practical control measures that are being applied to limit its negative impact on shrimp farming.
Keywords: White Shrimp; Microsporidium; Hepatopancreas; Intracellular Parasite; Enterocytozoon Hepatopenaei.
RESUMEN
La acuicultura asume un papel fundamental para satisfacer la creciente demanda mundial de alimentos, y el cultivo de camarón, en particular, desempeña un papel importante en la economía y la seguridad alimentaria mundial. No obstante, la industria enfrenta desafíos formidables, atribuidos principalmente a los brotes de enfermedades. El objetivo de esta revisión fue reflexionar sobre la microsporidiosis hepatopancreática, taxonomía, ciclo biológico, transmisión y diagnóstico, como patología emergente que afecta al camarón blanco Litopenaeus vannamei. Se realizó un estudio de revisión bibliográfica de tipo descriptivo, con enfoque cualitativo y de nivel exploratorio, a través de la búsqueda de artículos científicos, libros y documentos gubernamentales relevantes para la temática del cultivo del camarón y microsporidiosis hepatopancreática (HPM). El parásito microsporidio Enterocytozoon hepatopenaei infecta el hepatopáncreas de su huésped y causa microsporidiosis hepatopancreática, una condición que se ha asociado con un crecimiento lento del animal y cuantiosas perdidas económicas. En esta revisión se aborda la biología y fisiopatología de esta enfermedad, sobre la dinámica de transmisión e infección por este agente patógeno y medidas prácticas de control que se están aplicando para limitar su impacto negativo en el cultivo de camarón.
Palabras clave: Camarón Blanco; Microsporidio; Hepatopáncreas; Parásito Intracelular; Enterocytozoon Hepatopenaei.
INTRODUCCIÓN
La justificación para realizar este estudio sobre la microsporidiosis hepatopancreática en Penaeus vannamei, el camarón blanco, radica en su importancia económica y ecológica. Esta enfermedad emergente representa una amenaza significativa para la acuicultura global, dado que P. vannamei es una de las especies más cultivadas y comercializadas en la industria. La enfermedad, causada por microsporidios, conlleva una disminución en la tasa de crecimiento y una mayor mortalidad, lo que resulta en pérdidas económicas considerables.
Además, los brotes recientes indican una posible adaptación y propagación de los patógenos a nuevas áreas, complicando aún más los esfuerzos de manejo sostenible y bioseguridad en cultivos. Un estudio detallado proporcionará un mejor entendimiento de la patología, epidemiología y métodos de control efectivos, esencial para desarrollar estrategias de mitigación y tratamiento, y para asegurar la viabilidad a largo plazo de la industria del camarón
El camarón blanco, Penaeus vannamei, es una especie de importancia económica que representa el 52,9 % de la producción total de la acuicultura de crustáceos (9,4 millones de toneladas) a nivel mundial.(1) Aunque la producción ha aumentado constantemente en los últimos años, la acuicultura de camarón está en constante desafío por la aparición y propagación de nuevas enfermedades como la microsporidiosis hepatopancreática (MHP) causada por un patógeno emergente Enterocytozoon hepatopenaei (EHP).(2)
El parásito Enterocytozoon hepatopenaei (EHP) es un patógeno microsporidiano emergente en la acuicultura de camarón, que se caracteriza formalmente en 2009 como una rara infección del camarón tigre negro Penaeus monodon. Permanece relativamente sin estudiar hasta mediados de 2010, después de lo cual la infección por EHP se vuelve cada vez más común en el camarón blanco del Pacífico Penaeus vannamei, para entonces la especie de camarón más común cultivada en Asia. EHP infecta el hepatopáncreas (HP) de su huésped, hepatopáncreas, órgano implicado en el metabolismo y la inmunidad humoral del camarón, causando microsporidiosis hepatopancreática (HPM), una condición que se ha asociado con el crecimiento lento del huésped en entornos de acuicultura.
A diferencia de otros agentes de enfermedades infecciosas que han causado pérdidas económicas en la acuicultura mundial de camarón, EHP ha demostrado ser más desafiante porque aún se sabe muy poco sobre sus reservorios ambientales y modos de transmisión durante el proceso de producción industrial de camarón.(3)
La primera evidencia de una alta prevalencia de EHP en P. vannamei cultivado provino de un estudio de cohorte integral de 196 estanques de cultivo en Tailandia que se lleva a cabo durante 2013-2014 para determinar los factores de riesgo asociados con otra afección llamada síndrome de mortalidad temprana.(4)
Como parte de esta encuesta, también se analiza HP del camarón para detectar la presencia de EHP mediante PCR, lo que lleva a la revelación de que el 60 % de los estanques en todo el estudio dan positivo para la infección por EHP. Este resultado lleva a una escalada urgente en la importancia percibida de EHP como una amenaza para el sector mundial de la acuicultura de camarón, incluida la publicación de una advertencia sobre la posible propagación de este patógeno por parte de la Red de Centros de Acuicultura en Asia-Pacífico.(5)
Varios experimentos han demostrado que los microsporidios pueden transmitirse horizontalmente entre camarones a través del agua,(6) permitiendo así que el patógeno se propague. Recientemente, se ha informado de EHP en Venezuela, así como en Tailandia, China, India, Vietnam, Indonesia y Malasia.(7)
Los diagnósticos de laboratorio realizados en la última década han permitido encontrar una prevalencia relativamente alta de los tres patógenos, incluido el virus de la necrosis hipodérmica y hematopoyética infecciosa (IHHNV), el virus del síndrome de la mancha blanca (WSSV) y la enfermedad de necrosis hepatopancreática aguda (AHPND). Sin embargo, actualmente no existen medicamentos específicos para el tratamiento de la EHP y la única forma de evitar el daño es detectarlos tempranamente. Por tanto, se necesitan con urgencia medidas preventivas eficaces para la detección temprana y rápida de patógenos.(8)
La infección por EHP puede actuar como un factor predisponente de otras enfermedades, como la enfermedad de necrosis hepatopancreática aguda y la necrosis hepatopancreática séptica.(9) Esto puede deberse al hecho de que la infección con EHP afecta la capacidad de los camarones para utilizar energía para el crecimiento y dificulta el proceso de muda, lo que está relacionado con la invasión de patógenos del animal. El objetivo de esta revisión es reflexionar sobre la microsporidiosis hepatopancreática, taxonomía, ciclo biológico, transmisión y diagnóstico como patología emergente que afecta al camarón blanco Litopenaeus vannamei.
MÉTODOS
Se realizó un estudio de revisión bibliográfica de tipo descriptivo, con enfoque cualitativo y de nivel exploratorio, a través de la búsqueda de artículos científicos, libros y documentos gubernamentales relevantes para la temática del cultivo del camarón y microsporidiosis hepatopancreática (HPM).
La búsqueda bibliográfica abarcó el período de 2009 a 2023. Los criterios de inclusión se basaron en publicaciones ISI/Scopus en las bases de datos WoS (Web of Science) y Scopus. Los registros se identificaron primero mediante la búsqueda de datos, seguida de la eliminación de duplicados. A continuación, se realizó un cribado y extracción de datos, lo que implicó eliminar los artículos que no cumplían los criterios de elegibilidad. Los criterios de elegibilidad requirieron evaluar los artículos restantes si estaban relacionados con el tema de interés navegando por sus resúmenes o contenidos.
El último paso fue la selección de los estudios que se incluirán en la revisión sobre la base de los artículos que pasaron la evaluación de elegibilidad. La búsqueda de los artículos que se incluirían en esta revisión utilizó términos clave, como "cultivo de camarón en América Latina", "Cultivo de camarón en Ecuador", "impactos del cambio climático en la pesca de camarón", "enfermedades virales en camarones", y también incluía artículos publicados por autores sobre las enfermedades micóticas en camarón blanco.
El estudio utilizó una amplia revisión de la literatura en sincronía con las bases de datos de la Organización Mundial de Sanidad Animal, información del Ministerio de Agricultura, Ganadería Acuacultura y Pesca de Ecuador, otros datos de la FishStatJ de la FAO, a su vez información procedente de la base Aquatic Sciences and Fisheries Abstracts (ASFA).
La estrategia de búsqueda se centró en la recolección de 98 publicaciones de las cuales se aceptaron 27 artículos que cumplieron los criterios de inclusión consistentes en artículos originales revisados por pares, relacionados con la manifestación de la microsporidiosis hepatopancreática en el cultivo de camarón, revisiones sistemáticas y metaanálisis, libros y artículos publicados en español e inglés que incluyeran principalmente la base de datos seleccionadas. Se descartaron 71 artículos que no clasificaron para los criterios de búsqueda, relativos a cartas al editor, artículos en base de datos regionales, documentos no revisados por pares y que no abordaron los aspectos relacionados al cultivo del camarón y su impacto medioambiental.
RESULTADOS
Aspectos generales sobre la taxonomía y distribución geográfica del microsporidio
El parásito Enterocytozoon hepatopenaei pertenece a la familia Enterocytozoonidae, phylum Microsporidia, que comprenden a los hongos formadores de esporas de pequeño tamaño y especializados, parásitos unicelulares de animales, incluidos humanos, insectos y crustáceos. Según Stentiford(10) el phylum Microsporidia pertenece al subgrupo Holomycota relacionado con un gran grupo de hongos denominado Opisthokonta.
Al menos la mitad de la diversidad conocida dentro de los Microsporidios reside en huéspedes acuáticos, y los que infectan a los crustáceos a veces infectan peces como huéspedes alternativos, por ejemplo, la especie de microsporidio Agmasoma penaei, que causa la enfermedad conocida como “camarón de algodón”.(11) Otras especies de microsporidios que afectan a este tipo de crustáceo son el Pleistophora, con la especie P. penaei y el Ameson (anteriormente llamado Nosema), con la especie A. nelsoni.(11)
En la actualidad, se han identificado más de 1 500 especies de microsporidios a nivel mundial, y se pronostica que con el descubrimiento de nuevos huéspedes e infecciones, se encontrará e identificará un número cada vez mayor de microsporidios, que han sido caracterizados como patógenos oportunistas peligrosos (12) que infectan muy fácilmente a pacientes inmunodeprimidos, en este caso las personas con VIH, los pacientes trasplantados de órganos y los pacientes que toman medicamentos inmunosupresores son particularmente vulnerables a la encefalitis y la diarrea causadas por Microsporidia spp.
Además, los microsporidios infectan a gusanos de seda, abejas, salmones, camarones y otros animales de granja y de importancia económica y han causado importantes pérdidas económicas a las industrias de la agricultura y la acuicultura. Se han informado más de 63 géneros que infectan a los crustáceos.(13)
Históricamente, el grupo ha tenido una taxonomía basada en la morfología/ecología mediante la cual su complejo ciclo de vida intracelular, sus características morfológicas únicas y su variedad de huéspedes (incluido el tropismo tisular) se utilizaron para proporcionar información taxonómica. Estas características siguen siendo importantes, pero las tecnologías moleculares y genómicas están proporcionando mayor nivel de rapidez y eficacia en el diagnóstico de los microsporidios, convirtiéndose en el estándar de oro para la identificación de especies y una ubicación filogenética más amplia.(14)
Ciclo biológico del microsporidio
Según Chaijarasphong et al.(5) el ciclo de vida de los microsporidios puede ser simple o muy complejo y las etapas de vida pueden involucrar a una, dos o más especies hospedadoras diferentes. En el caso de EHP tiene una fase de esporas infecciosa (madura) extracelular y numerosas etapas de vida intracelular (figura 1). La infección de la célula huésped se inicia cuando la espora germina y extruye explosivamente su tubo polar [Fase 1], perforando la membrana plasmática de la célula huésped y permitiendo que el contenido de la espora (el esporoplasma) llegue directamente al citoplasma de la célula huésped, donde madura mediante crecimiento físico y división nuclear por mitosis secuencial o merogonía, dando como resultado un plasmodio ramificado [Fase 2].
Los precursores de extrusión de esporas [Fase 3] se forman dentro del plasmodio, [Fase 4] luego el Plasmodium se escinde para generar esporoblastos. [Fase 5] La célula huésped se rompe para libera esporas maduras, resultando esta la fase infecciosa. Durante este proceso, las células epiteliales infectadas del HP se hinchan y eventualmente se rompen para liberar esporas maduras, lo que facilita la autoinfección de otras células HP o la liberación de esporas maduras al ambiente a través de las heces, para luego infectar a otros camarones.
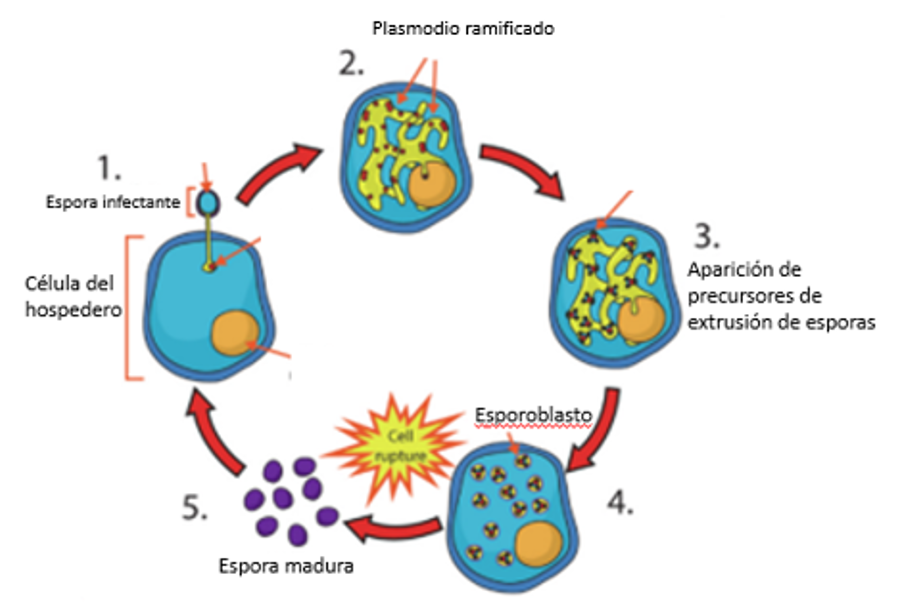
Figura. 1. Esquema que ilustra el ciclo de vida de Enterocytozoon hepatopenaei
Fuente: Chaijarasphong et al (2021)
Mecanismo de transmisión de EHP
A diferencia de otros microsporidios, EHP no necesita un huésped intermediario, ya que puede completar su ciclo de vida en el tracto gastrointestinal del camarón, transmitiéndose de forma horizontal y directa de camarón a camarón por vía oral y fecal, canibalismo o exposición a agua contaminada. La investigación de Tang et al.(7) demostraron que las infecciones podrían propagarse progresivamente a medida que se desarrollara el cultivo de camarón (figure 2)
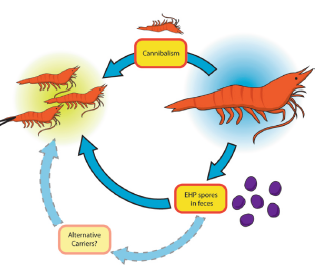
Figura 2. Mecanismo de transmisión de Enterocytozoon hepatopenaei
Fuente: Chaijarasphong et al (2021)
Las pruebas orales demostraron que las esporas de EHP son infecciosas por ingestión. Dado que la alimentación forzada inversa se acepta como una ruta sin obstáculos que permite la exposición directa del HP del camarón a bacterias y toxinas, se demostró que las esporas producidas en el HP (similares en tamaño a las bacterias) podrían propagarse internamente a las células epiteliales de los túbulos del HP no infectados (autoinfección).(7)
La transmisión horizontal a postlarvas también se ha logrado mediante la adición de homogeneizado de tejido infectado con EHP en agua de cultivo. Estos resultados indican que EHP puede propagarse rápidamente entre camarones infectados de todas las etapas de su vida a través de esporas o por canibalismo, constituyendo a su vez otra posible fuente de transmisión los depósitos o transportadores mecánicos, pero esta variante no ha sido confirmada.(6)
La transmisión vertical de EHP ha sido referida por Vu-Khac et al.(15) quienes obtuvieron resultados positivos en la prueba de PCR para EHP en nauplios, zoeas 1 y zoeas 2, obtenidos de reproductores hembras infectados con EHP. Desafortunadamente, esta afirmación no fue acompañada de un examen histológico claro. Tampoco se informó la etapa de los nauplios, lo que hace posible que las infecciones se produjeran mediante la ingestión de esporas liberadas en las heces de los animales reproductores y no a través de las células gonadales.
Se ha informado sobre el potencial de transmisión vertical de otros microsporidios mediante la demostración de su presencia en el tejido gonadal. Sin embargo, los resultados de las pruebas de hibridación in situ (ISH) con camarones juveniles y reproductores infectados con EHP han mostrado señales positivas para EHP en el tejido HP, pero ninguna en los ovarios o testículos de los mismos especímenes, lo que hace que la transmisión transgonadal sea poco probable. Sin embargo, dado que este trabajo no se llevó a cabo de manera integral utilizando un mayor número de muestras y todas las etapas de la vida, no es posible en esta etapa descartar la posibilidad de transmisión de EHP a través de rutas verticales.(16)
Sin embargo, incluso sin transmisión vertical, las hembras de camarón reproductor que están infectadas con EHP aún pueden transmitir infecciones horizontalmente a sus crías en los criaderos mediante la liberación de heces que contienen esporas en los tanques de desove. Dado que los nauplios probablemente se infectan cuando comienzan a alimentarse de plancton en la etapa N6, el lavado de los huevos o de los nauplios en las primeras etapas (N1-N5) con agua limpia del criadero puede ayudar a reducir la transmisión.(17)
Esto ha tenido éxito en el tratamiento del virus de la necrosis de la glándula del intestino medio (BMNV) baculovirus y del baculovirus monodon o MBV (ahora llamado Penaeus monodon nudivirus o PMNV). Estos virus HP también se transmiten a estadios larvarios N6 o posteriores a través de las heces de las hembras en desove. Por supuesto, las infecciones en los criaderos también pueden surgir de la contaminación debida a fallas en la bioseguridad del criadero. Una vez que algunas de las larvas se infectan, transmitirán rápidamente la infección horizontalmente a través de esporas en sus heces o mediante canibalismo.(17)
Diagnóstico y métodos utilizados para detectar EHP
La técnica histológica podría usarse muy bien para identificar el sitio de infección y puede ayudar en el diagnóstico de EHP, debido a que no existen signos clínicos específicos para esta infección. Se han empleado métodos de detección molecular para ayudar a la detección de diversos patógenos acuáticos y se ha descubierto que son rápidos y fiables si se emplean con cuidado. Con métodos mejorados de extracción de ADN para muestras ambientales y con controles adecuados, la PCR se está utilizando para el diagnóstico de rutina.
Behera et al.(18) estudiaron la tasa de prevalencia de EHP en Litopenaeus vannamei procedentes de las camaroneras de Bengala Occidental, costa este de la India, observándose en las preparaciones histológicas degeneración y necrosis en los túbulos hepatopancreáticos con desprendimiento de la membrana basal (figura 3b). A su vez la estructura del hepatopáncreas de los animales infectados mostró inclusiones eosinófilas a basófilas en las células epiteliales,(19) con evidencia de microsporidios y esporas en el citoplasma de las células tubulares epiteliales (figure 3a).

Figura 3. Histopatología de EHP en L. vannamei que muestra (imagen a) etapas de desarrollo/esporas en las células epiteliales tubulares (*) (H&E; x 600). (Imagen b) inclusiones basófilas (X) y cuerpos granulares, con túbulos completamente desprendidos y seno hemal agrandado en el tejido hepatopancreático (Y) (H&E; 400 X).
Fuente: Behera et al (2019)
Se han informado otros métodos mucho más específicos para detectar EHP, como la reacción en cadena de la polimerasa (PCR) convencional, la PCR en tiempo real, la amplificación isotérmica mediada por bucle (LAMP) y el ensayo de hibridación in situ con una sonda de ADN marcada con digoxigenina. Sin embargo, estos enfoques dependen de un control preciso de la temperatura o de una variedad de procedimientos experimentales que requieren mucho tiempo. La detección basada en PCR es un método común en el campo de la detección molecular, pero requiere termocicladores costosos para un control preciso de la temperatura. Aunque el tiempo de reacción de LAMP es de solo 45 minutos, la temperatura de reacción sigue siendo de hasta 65 °C.(20)
Zhou et al.(21) refieren la aplicación de un método de amplificación de polimerasa recombinasa (RPA) altamente sensible y específico para la detección de EHP en camarones, se trata de una técnica de amplificación de genes isotérmica cuyos ensayos se pueden ejecutar en 20 a 40 minutos a una temperatura de 20 a 37 °C, los productos de amplificación se prueban simultáneamente con electroforesis en gel de agarosa al 1 %, respuesta inmune marcada con oro, fluorescencia en tiempo real y otros métodos.
En comparación con otros métodos de detección conocidos, incluidos PCR, PCR en tiempo real y LAMP, RPA ha demostrado una mayor precisión y tiempos de reacción más cortos, a su vez es un método sensible para la detección de EHP, por lo que se verificó la aplicación práctica del método EHP-RPA mediante la detección de muestras clínicas.
Principales enfermedades que afectan el cultivo del camarón
Las principales enfermedades del camarón son causadas principalmente por patógenos bacterianos, virales y fúngicos, como el virus del síndrome de la mancha blanca (WSSV), el microsporidiano Enterocytozoon hepatopenaei (EHP) y Vibrio parahaemolyticus (patógeno de la necrosis hepatopancreática aguda (AHPND), lo que resulta en mortalidades masivas de camarones.(22) Es importante destacar que se ha informado que las primeras etapas de desarrollo de los animales tienen un mayor riesgo de infección por microorganismos patógenos que la etapa adulta. En el camarón, AHPND causa una mortalidad grave en las primeras etapas del camarón, incluido P. monodon.(23)
En condiciones estresantes, L. vannamei es susceptible a diversos patógenos, incluidos el virus de la mancha blanca, el virus de la cabeza amarilla y bacterias patógenas como Vibrio spp. (p. ej., V. harveyi, V. alginolyticus, V. parahaemolyticus, V. vulnificus y V. cholerae) que causan vibriosis.(24) Los camarones enfermos exhiben un crecimiento lento, bajas tasas de supervivencia, baja tolerancia al estrés, menor resistencia a las enfermedades y síntomas como letargo, calambres en la cola y comportamientos de giro desorientados, particularmente en niveles bajos de salinidad. Enfermedades inducidas por Vibrio spp. ocasionalmente conducen a episodios de mortalidad masiva, provocando caídas de la producción y graves pérdidas económicas en muchos países asiáticos.(25)
DISCUSIÓN
Como los camarones infectados con EHP no presentan síntomas externos hasta unos meses después del cultivo, la vigilancia periódica es esencial para garantizar que los animales que parecen normales estén realmente libres de EHP. Además, el descubrimiento temprano de EHP en camarones asintomáticos puede impulsar una intervención oportuna, como el cambio regular del agua del estanque para eliminar las heces y liberar las esporas de EHP, lo que puede permitir que los camarones continúen creciendo sin síntomas hasta la cosecha.(26)
Según Tang et al.(7) en 2016 se analizan muestras de camarón blanco del Pacífico Penaeus vannamei procedentes de granjas en Venezuela. La recolección se hace de poblaciones de camarones que muestran signos de enfermedad, específicamente grandes variaciones en tamaños y crecimiento reducido, aplicándose procedimientos de diagnóstico de rutina, incluidos análisis de PCR y exámenes histológicos, se diagnostica que los camarones están infectados con dos patógenos, Enterocytozoon hepatopenaei (EHP) y el virus del síndrome de Taura (TSV). Esto es de interés por dos razones: 1) EHP no es reportado previamente en esta región, y 2) no hay informes de TSV en Venezuela en más de 10 años.
Los efectos de la infección por EHP en los camarones es el resultado del daño al hepatopáncreas y al intestino medio, un órgano digestivo y tejido de absorción que acumula y almacena cantidades sustanciales de nutrientes y energía necesarios para sustentar el crecimiento y otras funciones metabólicas. Con diferentes grados de infección entre camarones individuales, los signos de infección por EHP aparecen como variación de tamaño dentro de la población, crecimiento lento general y producción reducida.(7)
Hasta ahora, se han desarrollado varios métodos de detección para EHP, incluida la amplificación isotérmica mediada por bucle (LAMP), la reacción en cadena de la polimerasa anidada (PCR anidada) y la PCR de un solo paso junto con la detección de flujo lateral (PCR-LFD). Cada uno de estos métodos tiene ventajas y limitaciones. Por ejemplo, PCR-LFD es moderadamente sensible y produce una señal visible a simple vista, pero el requisito de un costoso ciclador térmico impide su adopción en entornos con recursos limitados.
Por otro lado, LAMP es muy sensible e isotérmica y sólo requiere un baño de agua como fuente de calor, pero la técnica ocasionalmente produce amplicones no específicos. La PCR anidada es 1 000 veces más sensible que su contraparte de un solo paso en la detección de EHP, pero, además de requerir un termociclador, una elección inapropiada del objetivo supuestamente arroja resultados falsos positivos con microsporidios estrechamente relacionados. Por lo tanto, todavía se necesita un diagnóstico rápido, implementable en el campo que también ofrezca alta sensibilidad y especificidad.(26)
Según Kanitchinda et al.(26) el método CRISPR (repeticiones palindrómicas cortas agrupadas, regularmente interespaciadas) surge como una poderosa herramienta para la edición del genoma de organismos en todos los ámbitos de la vida. Evolucionado como un sistema inmunológico adaptativo en bacterias y arqueas, CRISPR en su contexto nativo emplea una familia de proteínas llamadas endonucleasas Cas para escindir ácidos nucleicos extraños o el genoma de patógenos invasores. Empleándose una variante mucho más avanzada que se basa en la aplicación de la nucleasa CRISPR/Cas12a guiada por ARN, método prometedor para la detección de ácidos nucleicos. Sin embargo, en los métodos actuales, la amplificación del ADN y la posterior escisión de Cas12a se separan y todo el proceso dura hasta 2 h.
Tomando en consideración las desventajas del factor tiempo del método CRISPR/Cas12a Wang et al.(27) propone un método basado en CRISPR/Cas12a llamado "Cas12aVDet" para la detección rápida de ácidos nucleicos. Al integrar la amplificación de la polimerasa recombinasa (RPA) con la escisión de Cas12a en un único sistema de reacción, la detección se puede lograr en 30 minutos y se puede evitar la contaminación por destapado. Este método pudo detectar ADN a nivel de una sola molécula y demuestra una precisión del 100 % en la detección de contaminación por micoplasmas, lo que presenta un gran potencial para una variedad de aplicaciones de detección de ácidos nucleicos.
La necesidad de abordar la microsporidiosis hepatopancreática en Penaeus vannamei con herramientas analíticas innovadoras se hace evidente ante la complejidad y el impacto de la enfermedad en la acuicultura. Los autores proponen un estudio futuro que incorpore análisis neutrosóficos, un enfoque que permite manejar la incertidumbre y la indeterminación, para evaluar la variabilidad en la respuesta del camarón a los microsporidios bajo diferentes condiciones ambientales y de manejo. Esta metodología es pertinente debido a su capacidad para modelar y interpretar datos donde la información es contradictoria o incompleta, lo cual es común en estudios epidemiológicos y de patogenicidad.
Aunque el uso de análisis neutrosóficos ya ha sido explorado en Ecuador para otros fines en estudios recientes,(28,29) su aplicación en la investigación de enfermedades en acuicultura es todavía incipiente y prometedora. Este estudio no solo avanzaría en la comprensión de la microsporidiosis sino también en el desarrollo de estrategias más eficaces y adaptativas para el manejo de la salud en cultivos de camarón, considerando las complejidades del sistema y las interacciones bióticas y abióticas que influyen en la propagación y severidad de la enfermedad.
CONCLUSIONES
Enterocytozoon hepatopenaei (EHP) es el agente de la microsporidiosis hepatopancreática en camarones cultivados, constituyendo un microsporidio intracelular obligado formador de esporas que se replica dentro del citoplasma de las células epiteliales de los túbulos en el hepatopáncreas. EHP se asocia con un retraso significativo en el crecimiento del camarón que puede no ser claramente evidente hasta el segundo mes de cultivo.
El EHP se puede transmitir directamente por vía oral y no requiere un huésped intermediario. Actualmente este microorganismo se diagnostica mediante examen histológico y frotis, pero la infección debe diagnosticarse de manera confirmatoria mediante métodos moleculares como el denominado "Cas12aVDet". El tratamiento de las infecciones por EHP en camarones no es eficaz, ya que no existe ningún fármaco para controlar directamente este parásito en el órgano objetivo. La combinación de una bioseguridad adecuada y buenas prácticas de manejo es la mejor manera de prevenir infecciones por EHP en el sistema de cría.
REFERENCIAS BIBLIOGRÁFICAS
1. FAO. El estado mundial de la pesca y la acuicultura 2020: la sostenibilidad en acción (Organización de las Naciones Unidas para la Alimentación y la Agricultura, 2020).
2. López-Carvallo, JA, Cruz-Flores, R. y Dhar, AK. The emerging pathogen Enterocytozoon hepatopenaei drives a degenerative cyclic pattern in the hepatopancreas microbiome of the shrimp (Penaeus vannamei). Scientific Reports, 2022, vol. 12, no 1, p. 14766.
3. Chaijarasphong, T., Munkongwongsiri, N., Stentiford, GD, Aldama-Cano, DJ, Thansa, K., Flegel, TW, Itsathitphaisarn, O. The shrimp microsporidian Enterocytozoon hepatopenaei (EHP): Biology, pathology, diagnostics and control. Journal of Invertebrate Pathology, 2021, vol. 186, p. 107458.
4. Pattarayingsakul, W., Munkongwongsiri, N., Thitamadee, S., Sritunyalucksana, K., & Aldama-Cano, D. J. Shrimp microsporidian EHP spores in culture water lose activity in 10 days or can be inactivated quickly with chlorine. Aquaculture, 2022, vol. 548, p. 737665.
5. Chaijarasphong, T., Munkongwongsiri, N., Stentiford, G. D., Aldama-Cano, D. J., Thansa, K., Flegel, T. W., Itsathitphaisarn, O. The shrimp microsporidian Enterocytozoon hepatopenaei (EHP): Biology, pathology, diagnostics and control. Journal of Invertebrate Pathology, 2021, vol. 186, p. 107458.
6. Karthikeyan, K., & Sudhakaran, R. Experimental horizontal transmission of Enterocytozoon hepatopenaei in post‐larvae of whiteleg shrimp, Litopenaeus vannamei. Journal of fish diseases, 2019, vol. 42, no 3, p. 397-404.
7. Tang, K. F., Aranguren, L. F., Piamsomboon, P., Han, J. E., Maskaykina, I. Y., Schmidt, M. M. Detection of the microsporidian Enterocytozoon hepatopenaei (EHP) and Taura syndrome virus in Penaeus vannamei cultured in Venezuela. Aquaculture, 2017, vol. 480, p. 17-21.
8. Zhou, S., Wang, M., Liu, M., Jiang, K., Wang, B., Wang, L. Rapid detection of Enterocytozoon hepatopenaei in shrimp through an isothermal recombinase polymerase amplification assay. Aquaculture, 2020, vol. 521, p. 734987.
9. Aranguren Caro, L. F., Mai, H. N., Cruz-Florez, R., Marcos, F. L. A., Alenton, R. R. R., Dhar, A. K. Experimental reproduction of White Feces Syndrome in whiteleg shrimp, Penaeus vannamei. PloS one, 2021, vol. 16, no 12, p. e0261289.
10. Stentiford, G.D., Bass, D., Williams, B.A.P. Ultimate opportunists — the emergent Enterocytozoon group Microsporidia. PLoS Pathog. 2019; 15, 1–6. https://doi.org/10. 1371/journal.ppat.1007668
11. Laisutisan, K., Prasertsri, S., Chuchird, N., Limsuwan, C. Ultrastructure of the microsporidian Thelohania (Agmasoma) penaei in the Pacific white shrimp Litopenaeus vannamei). Kasetsart Univ. Fish Res. 2009; Bull. 33, 41–48.
12. González Salas R, Pimienta Concepción I. El enfoque “Una sola salud” y las zoonosis reemergentes. Universidad y Sociedad [Internet]. 1abr. 2022 [citado 20oct.2023]; 14(S2):385-90. Available from: https://rus.ucf.edu.cu/index.php/rus/article/view/2800
13. Jiang, H., Chen, Y., Bao, J., Li, X., Feng, C., Xing, Y., & Chen, Q. Isolation of the parasite Enterocytospora artemiae from Chinese grass shrimp (Palaemonetes sinensis)—first report in Asia. Frontiers in Cellular and Infection Microbiology, 2020, vol. 10, p. 580088.
14. Chauvet, M., Debroas, D., Moné, A., Dubuffet, A., Lepère, C. Temporal variations of Microsporidia diversity and discovery of new host–parasite interactions in a lake ecosystem. Environmental Microbiology, 2022, vol. 24, no 3, p. 1672-1686.
15. Khac, H. V., Thanh, T. N. T., Thu, G. N. T., Le, C. H., Nguyen, V. D. Vertical transmission and early diagnosis of the microsporidian Enterocytozoon hepatonaei in whiteleg shrimp Penaeus vannamei. Journal of Pure and Applied Microbiology, 2018, vol. 12, no 3.
16. Fu, J., Zhu, W., Wang, L., Luo, M., Song, F., Dong, Z. Dynamic transcriptome sequencing and analysis during early development in the bighead carp (Hypophthalmichthys nobilis). BMC genomics, 2019, vol. 20, p. 1-14.
17. Dewangan, N. K., Pang, J., Zhao, C., Cao, C., Yin, B., Weng, S., He, J. Host and transmission route of Enterocytozoon hepatopenaei (EHP) between dragonfly and shrimp. Aquaculture, 2023, vol. 574, p. 739642.
18. Behera, B. K., Das, A., Paria, P., Sahoo, A. K., Parida, P. K., Abdulla, T., & Das, B. K. Prevalence of microsporidian parasite, Enterocytozoon hepatopenaei in cultured Pacific White shrimp, Litopenaeus vannamei (Boone, 1931) in West Bengal, East Coast of India. Aquaculture International, 2019, vol. 27, p. 609-620.
19. Raj, M., Sathiyaraj, G., Narayanan, B., Babu, B., Varkey, M., Karthickkannan, K. Kandan, S. Characterization of Enterocytozoon hepatopenaei causing Hepatopancreatic microsporidiosis in L. vannamei and a new molecular method for its detection in shrimps, and other environmental samples. Journal of Invertebrate Pathology, 2023, p. 107951.
20. Ma, C., Fan, S., Wang, Y., Yang, H., Qiao, Y., Jiang, G., Gao, S. Rapid detection of Enterocytozoon hepatopenaei infection in shrimp with a real-time isothermal recombinase polymerase amplification assay. Frontiers in cellular and infection microbiology, 2021, vol. 11, p. 631960.
21. Zhou, S., Wang, M., Liu, M., Jiang, K., Wang, B., Wang, L. Rapid detection of Enterocytozoon hepatopenaei in shrimp through an isothermal recombinase polymerase amplification assay. Aquaculture, 2020, vol. 521, p. 734987.
22. Habib, Y. J., Wan, H., Sun, Y., Shi, J., Yao, C., Lin, J., Zhang, Z. Genome-wide identification of toll-like receptors in Pacific white shrimp (Litopenaeus vannamei) and expression analysis in response to Vibrio parahaemolyticus invasion. Aquaculture, 2021, vol. 532, p. 735996.
23. Angthong, P., Uengwetwanit, T., Arayamethakorn, S., & Rungrassamee, W. Transcriptomic analysis of the black tiger shrimp (Penaeus monodon) reveals insights into immune development in their early life stages. Scientific Reports, 2021, vol. 11, no 1, p. 13881.
24. Ringø, E., Doan, H. V., Lee, S., Song, S. K. Lactic acid bacteria in shellfish: possibilities and challenges. Reviews in Fisheries Science & Aquaculture, 2020, vol. 28, no 2, p. 139-169.
25. El-Saadony, M. T., Swelum, A. A., Ghanima, M. M. A., Shukry, M., Omar, A. A., Taha, A. E., Abd El-Hack, M. E. Shrimp production, the most important diseases that threaten it, and the role of probiotics in confronting these diseases: a review. Research in veterinary science, 2022, vol. 144, p. 126-140.
26. Kanitchinda, S., Srisala, J., Suebsing, R., Prachumwat, A., & Chaijarasphong, T. CRISPR-Cas fluorescent cleavage assay coupled with recombinase polymerase amplification for sensitive and specific detection of Enterocytozoon hepatopenaei. Biotechnology reports, 2020, vol. 27, p. e00485.
27. Wang, B., Wang, R., Wang, D., Wu, J., Li, J., Wang, J., Wang, Y. Cas12aVDet: a CRISPR/Cas12a-based platform for rapid and visual nucleic acid detection. Analytical chemistry, 2019, vol. 91, no 19, p. 12156-12161.
28. Álvarez Gómez ME, Méndez Cabrita M, Coka Flores DF, Rodríguez Reyes CG. Neutrosociology for Analyzing Public Procurement in Ecuador around the Health Emergency. Neutrosophic Sets and Systems. 2021;44(1). Disponible en: https://digitalrepository.unm.edu/nss_journal/vol44/iss1/37
29. Guallpa Zatán LG, Paillacho Chicaiza HJ, Yaguar Mariño J, Aguilar Carrión M. Neutrosophic Iadov for measuring user satisfaction in a virtual learning environment at UNIANDES Puyo. Neutrosophic Sets and Systems. 2020;34(1). Disponible en: https://digitalrepository.unm.edu/nss_journal/vol34/iss1/16
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Ninguno.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Raúl González Salas, Mildre Mercedes Vidal del Río, Marco Paul Medina Valencia, Matías Gabriel Jaramillo López.
Investigación: Raúl González Salas, Mildre Mercedes Vidal del Río, Marco Paul Medina Valencia, Matías Gabriel Jaramillo López.
Redacción – borrador original: Raúl González Salas, Mildre Mercedes Vidal del Río, Marco Paul Medina Valencia, Matías Gabriel Jaramillo López.
Redacción – revisión y edición: Raúl González Salas, Mildre Mercedes Vidal del Río, Marco Paul Medina Valencia, Matías Gabriel Jaramillo López.