REVISIÓN BIBLIOGRÁFICA
Carbapenem-resistant Acinetobacter baumannii complex: a review in Latin America
Acinetobacter baumannii complex resistente a los carbapenémicos una revisión en Latinoamérica
Christian Ivan Manobanda Nata1 ![]() *, Evelyn Katherine Jaramillo Ruales1
*, Evelyn Katherine Jaramillo Ruales1 ![]() *
*
1Universidad Técnica de Ambato, Facultad Ciencias de la Salud. Ambato, Ecuador.
Citar como: Manobanda Nata CI, Jaramillo Ruales EK. Acinetobacter baumannii complex resistente a los carbapenémicos una revisión en Latinoamérica. Salud, Ciencia y Tecnología. 2023;3:479. https://doi.org/10.56294/saludcyt2023479
Enviado: 04-06-2023 Revisado: 10-07-2023 Aceptado: 08-09-2023 Publicado: 09-09-2023
Editor: Dr.
William Castillo González ![]()
ABSTRACT
Introduction: Acinetobacter baaumannii complex is a pathogen that causes nosocomial infections in immunocompromised patients, the microorganism is resistant to carbapenemics and is difficult to control in health units.
Methods: this is a literature review on carbapenemics resistance of Acinetobacter baaumannii complex in Latin America. Different databases were used: Pubmed, Google Scholar, Scielo, Dialnet and Redalyc, for the selection of articles the inclusion and exclusion criteria were applied. In addition, the t-Student test was used to find significant values.
Results: resistance to carbapenemics in A. baumannii complex is reported in all Latin American countries, predominantly the group of oxacillin family genes (OXA-23 and OXA-51), in contrast metallo-beta-lactamases are not very frequent and has been identified in fewer isolates; however, Peru and Argentina showed high percentages of resistance; also the samples that present more isolates of this microorganism are tracheal aspirates.
Conclusions: this literature review shows the situation of resistance to carbapenemics in Latin America, the different genes identified have conferred high resistance to this microorganism. It is necessary to maintain surveillance of this microorganism in order to investigate new therapeutic alternatives against this pathogen.
Keywords: Acinetobacter Baumannii; Carbapenems; Acinetobacter Infections; Clinical Epidemiology.
RESUMEN
Introducción: Acinetobacter baaumannii complex es un patógeno capaz de producir infecciones intrahospitalarias, en pacientes inmunodeprimidos, el microorganismo es resistente a los carbapenémicos y dentro de las unidades de salud es difícil de controlarlo.
Métodos: es un estudio de revisión bibliográfica tipo documental sobre la resistencia a los carbapenémicos de Acinetobacter baaumannii complex en Latinoamérica, utilizando diferentes bases de datos: Pubmed, Google Académico, Scielo, Dialnet y Redalyc para la selección de artículos se aplicó los criterios de inclusión y exclusión, además para encontrar valores significativos se realizó la prueba t-Student.
Resultados: la resistencia a los carbapenémicos en A. baumannii complex se reporta en todos los países de Latinoamérica, predominando el grupo de genes de familia de las oxacilinas (OXA-23 y OXA-51), a diferencia de las metalo- beta-lactamasas no son muy frecuentes y se ha identificado en menor cantidad de aislamientos, no obstante, Perú y Argentina mostraron altos porcentajes de resistencia, además la mayoría de los aislamientos positivos del microorganismo proviene de aspirados traqueales.
Conclusiones: la revisión permite conocer la situación de la resistencia a los carbapenémicos en Latinoamérica, los diferentes genes identificados han otorgado gran variedad de resistencia al microorganismo, es necesario mantener la vigilancia de este microorganismo con el fin de investigar nuevas alternativas terapéuticas frente a este patógeno.
Palabras clave: Acinetobacter Baumannii; Carbapenémicos; Infecciones Por Acinetobacter; Epidemiología Clínica.
INTRODUCCIÓN
Acinetobacter baumannii complex es un coco bacilo gramnegativo, generalmente considerado un patógeno capaz de producir infecciones adquiridas dentro de los ambientes hospitalarios, el microorganismo puede infectar a personas inmunodeprimidas y pacientes ingresados a unidad de cuidado intensivos.(1) Por ello, también es considerado un patógeno nosocomial y oportunista; es el agente causal de neumonía, bacteriemia asociada con ventilación mecánica, infecciones de piel, tejidos blandos, infecciones del tracto urinario y meningitis.(2)
El microrganismo pertenece al grupo de bacterias ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, A. baumannii, Pseudomonas aeruginosa y Enterobacter spp) los patógenos representan un problema a nivel global, siendo un desafío terapéutico debido a los mecanismos de resistencia que adquieren, Acinetobacter baumannii complex fue clasificado por la OMS como prioridad critica número uno para el desarrollo y análisis de nuevos antibióticos.(3,4) La bacteria es capaz de sobrevivir a condiciones extremas durante tiempos prolongados debido a que puede formar una biopelícula, que permite su fácil adherencia a los dispositivos médicos y perdurar a los cambios de ambiente, pH y temperatura.(5)
En un inicio el complejo Acinetobacter baumannii (complejo ACB) estaba comprendido por 4 especies: A. calcoaceticus, A. baumannii, A. pittii y A. nosocomialis, poco después aparecieron dos nuevas especies A. seifertii y A. dijkshoorniae; Sin embargo, solo cinco especies están relacionadas con enfermedades humanas: A. baumannii, A. pittii, A. nosocomialis, A. seifertti y A. dijkshoorniae, todas las especies muestran características fenotípicas y bioquímicas similares, por lo tanto, la identificación de cada especie es complicada a nivel fenotípico, por lo que se pueden utilizar métodos moleculares.(6)
Durante la pandemia con la aparición del coronavirus (COVID-19), la mayoría de los pacientes presentaban síntomas respiratorios, por ello, el uso de la ventilación mecánica fue esencial para controlar a los pacientes ingresados en UCI, sin embargo, el uso prolongado ocasiona neumonía asociada con ventilación mecánica (NAV), vinculada con una bacteria multirresistente como lo es Acinetobacter baumannii complex, ocasionando altas tasas de mortalidad.(7) Los carbapenémicos han sido utilizados ampliamente para tratar infecciones, pero cada vez es más difícil de controlar, debido a la aparición de cepas multirresistentes que se asocian a altas tasas de mortalidad y ocasiona en las unidades de salud costos elevados de hospitalización.(8)
Este microorganismo presenta resistencia intrínseca por la presencia de carbapenemasas de clase D como, OXA-51, mismo que confiere resistencia a los carbapenémicos, además pueden adquirir genes como OXA-23, OXA-24/40, OXA-58, OXA-143, OXA-235, así mismo existen genes que codifican cabapenemasas de clase B metalo-beta-lactamasas (MBLs): IMP, VIM, NDM, SPM y finalmente por las de clase A: KPC o GES, todos estos genes hacen que el microorganismo no presente susceptibilidad a los carbapenémicos.(9,10)
Para la identificación del microorganismo puede ser cultivado en agar MacConkey y utilizar pruebas bioquímicas como: oxidasa (-), catalasa (+), fermentación de glucosa (-), motilidad (-) y citrato (+). Así mismo, existen equipos como MALDI Biotyper® que permiten la identificación del tipo de bacteria.(11,12) Para las pruebas de susceptibilidad antimicrobiana se utilizan dos métodos de acuerdo al Instituto de Normas Clínicas y de Laboratorio (CLSI), difusión de disco en agar y para la identificación de la concentración mínima inhibitoria el método de micro dilución en caldo.(13) Los equipos utilizados en el laboratorio de microbiología para la identificación y determinación de susceptibilidad antimicrobiana son: VITEK® 2 Compact, sistema BD Phoenix™, Accelerate Pheno®.(6,11)
Para la detección de carbapenemasas en Acinetobacter baumannii complex se han propuesto varios métodos fenotípicos en el laboratorio de microbiología propuestos por el CLSI como la prueba CarbAcineto NP que es una modificación proveniente de la prueba Carba NP, su principio es el cambio de pH ante la presencia de una carbapenemasa, por otro lado, se puede utilizar la inactivación del carbapenem modificado (mCIM) e inactivación del carbapenem modificado con EDTA (eCIM), los cuales determinan la presencia de una carbapenemasa mediante el halo de inhibición del disco,(14) y se han desarrollado protocolos automatizados como el equipo MALDI-TOF para la identificación de las mismas.(15)
Además, existen métodos moleculares para detectar genes de carbapenemasas, el ensayo Xpert Carba-R es un método automatizado para el diagnóstico in vitro de los diferentes genes por medio del instrumento GeneXpert.(16) Otro de los equipos es FilmArray, permite la detección de ácidos nucléicos mediante la amplificación de ADN y detección de las secuencias mediante sondas, así mismo, los microarrays permiten la detección de ADN mediante su hibridación y adherencia sobre soportes sólidos.(17)
En esta revisión, se identificó la frecuencia de Acinetobacter baumannii complex resistente a los carbapenémicos en Latinoamérica, antes y durante la pandemia. Además, se investigó los genes asociados a esta resistencia, con el fin de proporcionar información actualizada y relevante sobre la epidemiologia de este microorganismo, la información será necesaria para que cada país pueda abordar el problema de resistencia a los antimicrobianos y desarrolle medidas de prevención y control frente al microorganismo.
MÉTODOS
El estudio es una revisión bibliográfica, llevará a cabo la búsqueda de literatura de fuentes primarias sobre la resistencia a los carbapenémicos de A. baumannii complex en Latinoamérica en el periodo Enero 2016 hasta Abril 2023.
Para la recolección de información se llevó a cabo una búsqueda de artículos publicados antes y durante la pandemia en bases de datos en línea como: Pubmed, Google Académico, Scielo, Biblioteca Virtual en Salud (BVS), Dialnet y Redalyc. Se incluyeron artículos en español e inglés, empleando términos como: "Acinetobacter baumannii"[Mesh] AND Carbapenem-Resistant, "Acinetobacter baumannii"[Mesh] AND COVID-19, "Acinetobacter baumannii"[Mesh] AND Latinoamérica.
Para los criterios de inclusión se utilizarán publicaciones basadas en ensayos clínicos, artículos originales, comunicaciones cortas, que tengan texto completo gratis y los criterios de exclusión se eliminarán los artículos de revisión, además de literatura con más de 10 años de antigüedad.
Para llevar la bibliografía de forma sistémica se empleó una hoja de Excel, recopilando la información del artículo: país, año de publicación, tipo de muestra, servicio y los genes aislados del microorganismo.
Además, se utilizó la prueba t-Student para evaluar el si existe o no diferencias significativas en el porcentaje de resistencia reportado en cada país, en el periodo del 2016 hasta 2021, dependiente de la población analizada por año.
Todos los parámetros mencionados fueron utilizados para la selección de artículos acordes al tema establecido. Al concluir con la selección de artículos, se realizó el análisis y síntesis de la información identificando las similitudes y diferencias entre los estudios, cabe mencionar que toda la información permitirá conocer el impacto del microorganismo en la población y su resistencia epidemiológica en Latinoamérica.
RESULTADOS
En la presente revisión bibliográfica se investigó la resistencia a los carbapenémicos en Acinetobacter baumannii antes y durante la pandemia. Se analizaron 40 artículos científicos y comunicaciones cortas de diferentes bases de datos, los estudios fueron elegidos siguiendo los criterios de inclusión y exclusión y finalmente se seleccionaron 24 artículos que cumplieron con los criterios establecidos.
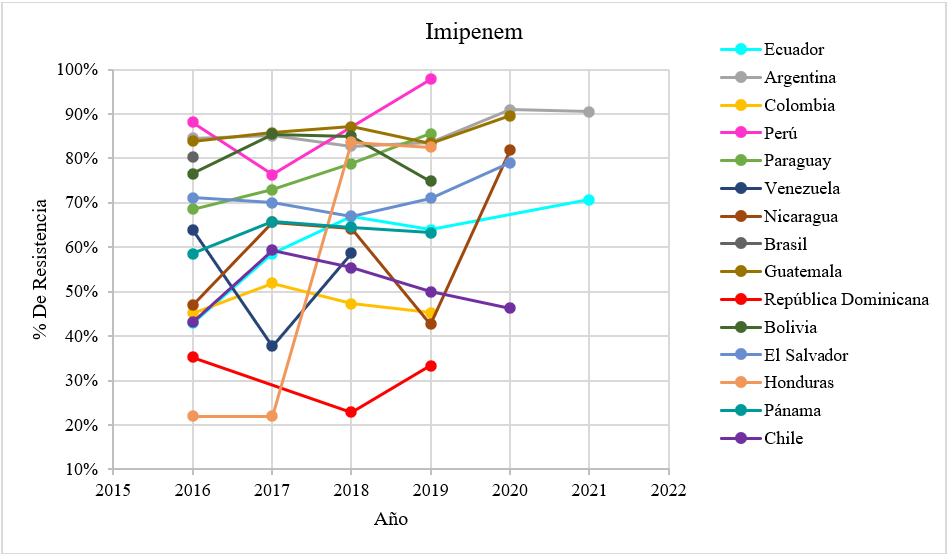
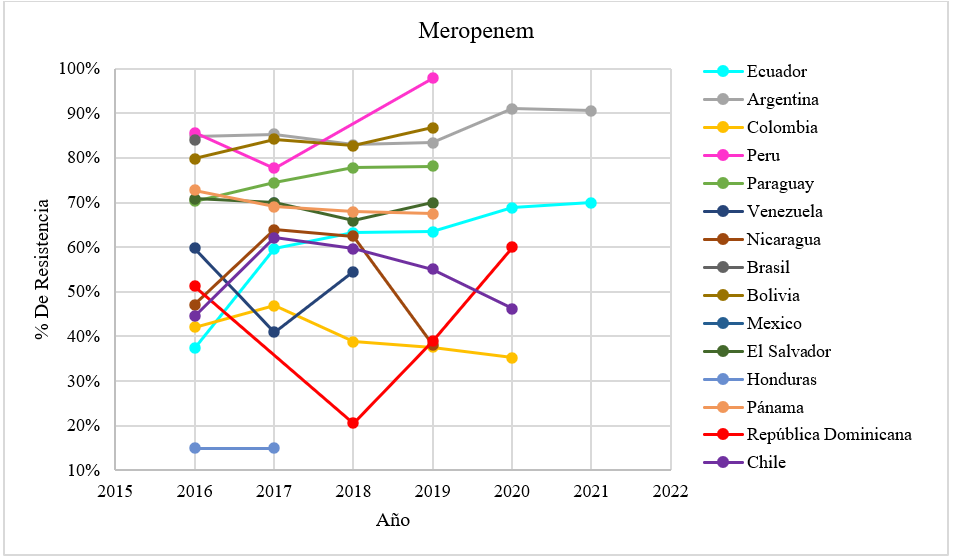
Figura 1. Porcentaje de resistencia a carbapenémicos en países de Latinoamérica
Fuente: Plataforma de Información en Salud para las Américas (PLISA) e Instituto Nacional de Investigación en Salud Pública -INSPI(18,19)
Durante la revisión se estableció la frecuencia de Acinetobacter baumannii complex resistente a los carbapenémicos (Imipenem y Meropenem) en los diferentes países de Latinoamérica antes y durante la pandemia y los genes que confieren esta resistencia.
El porcentaje de resistencia a los carbapenémicos es crucial para determinar la situación en la que se encuentra las resistencias frente al microorganismo, por ello, se ha utilizado datos recopilados de la Plataforma de Información en Salud para las Américas, para confirmar qué países presentan una diferencia significativa, se llevó a cabo la prueba de t-Student, utilizando un nivel de confianza establecido en (p ≤ 0,05) los análisis reflejan que Argentina y la República Dominicana presentaron una resistencia significativa al meropenem, mientras que Honduras mostró una resistencia significativa al imipenem.
La resistencia a imipenem (figura 1) antes y durante la pandemia se ha observado cambios significativos en los países de Latinoamérica, pero se evidencia un riesgo alarmante en Perú y Argentina, donde los informes indican niveles de resistencia superiores al 90 %, esta situación es motivo de preocupación para las entidades de salud, ya que el microorganismo ha desarrollado una alta resistencia y el antibiótico resulta ineficaz en su control.
Por otro lado, durante la pandemia, Guatemala, Nicaragua, El Salvador y Ecuador han presentado niveles de resistencia que oscilan entre el 50 % y el 90 %, lo que indica una resistencia moderada a los antibióticos, esto puede deberse al uso inadecuado de los antimicrobianos o problemas en la implementación de la vigilancia de infecciones.
En el caso de Chile, antes de la pandemia en 2017, se reportó un valor elevado del 59 % de resistencia, el cual resulto en un 46 % durante la pandemia, por otro lado, Honduras experimentó cambios notorios, ya que antes de la pandemia su resistencia se encontró alrededor del 22 %, pero en 2019 alcanzó un pico del 83 %.
Así mismo, en Nicaragua, antes de la pandemia, se mostró una disminución del 42 % en el nivel de resistencia, pero durante la pandemia dicho valor se duplicó, alcanzando el 81 %, en contraste, República Dominica reporta el menor porcentaje de resistencia, siendo inferior al 40 %.(18,19)
De la misma forma, el análisis del perfil de resistencia a meropenem (figura 1) refleja que Perú encabeza la lista de resistencia antes de la pandemia con un valor del 97 % en el 2019, no obstante, durante la pandemia, Argentina ha experimentado un aumento significativo en la resistencia, superando el 90 %, dato que no se había reportado previamente.
Así mismo, Ecuador ha mostrado un incremento gradual de resistencia desde el año 2016, alcanzando el 69 % en el año 2021. Por otra parte, Republica Dominicana presento un valor más bajo de resistencia antes de la pandemia, con un 20 % en el año 2018, sin embargo, durante la pandemia, ducho porcentaje se incrementó, llegando al 60 % de resistencia. Otros países como: Bolivia, Paraguay, El Salvador y Panamá mantuvieron un rango de resistencia del 50-90 % antes de la pandemia.
Además, antes de pandemia, Venezuela mostro una resistencia moderada que abarca el 40-60 %, por otro lado, Honduras se destaca como el país con los niveles más bajos de resistencia en comparación con los demás países estudiados. Sin embargo, en el caso de Colombia y Chile, antes de pandemia se observó una tendencia al aumento en sus valores de resistencia, pero durante la pandemia ambos países presentan tendencia a la disminución mostrando valores del 30-50 % de resistencia.(18,19)
Adicionalmente, en los 24 artículos seleccionados (tabla 1) se menciona los genes que confieren resistencia a carbapenémicos en A. baumannii complex, los genes que mayormente se reportan pertenecen a la familia de las oxacilinas, en los estudios se identificaron: OXA-23, OXA-51, OXA-58, OXA-24, OXA-40, OXA-143, OXA-214, OXA-215, OXA-264, OXA-265, OXA-575, OXA-72, OXA-253, por otro lado, las metalo-beta-lactamasas no son muy frecuentes en Latinoamérica, por ende, no existe muchos aislamientos de estos genes, sin embargo, se reporta la presencia de NDM, VIM, IMP en Colombia, Perú, Cuba, Ecuador y Brasil, además se muestra los diferentes tipos de muestra en donde se ha asilado la bacteria: Aspirado bronquial, hemocultivos, Tejidos blandos, heridas, orina, entre otros.
Para analizar la distribución de los genes que confieren resistencia a los carbapenémicos en Latinoamérica, se elaboró un mapa epidemiológico de los mismos (figura 3) identificando que los países que reportan mayor diversidad de genes de resistencia en A. baumannii son: Brasil, Perú, México.
|
Tabla 1. Reporte de genes que confieren resistencia a carbapenémicos en A. baumannii complex en Latinoamerica |
|
|||||
|
País |
Año |
Tipo de muestra |
Servicio |
Mecanismo de resistencia |
N. de reportes (n=tamaño poblacional) |
|
|
Colombia (20) |
2021 |
Sangre |
Consulta externa |
OXA-23-51 |
10 (n=13) |
|
|
Sangre |
Hospitalizaciones |
OXA-23+VIM |
1 (n=13) |
|
||
|
vías respiratorias |
UCI |
NDM-OXA51 |
2 (n=13) |
|
||
|
Chile (21) |
2022 |
Hemocultivo |
Hospitalizaciones |
OXA-58 |
6 (n=34) |
|
|
Chile (9) |
2020 |
Orina |
Ambulatoria |
OXA-219 |
1 (n=1) |
|
|
Brasil (22) |
2018 |
Sondas nasogástricas |
UCI |
OXA-23 |
41 (n=275) |
|
|
Brasil (8) |
2020 |
Aspirado traqueal |
UCI |
OXA-51 |
100 (n=100) |
|
|
Puntas de catéter |
OXA-23 |
|
||||
|
Brasil (23) |
2018 |
Hemocultivo |
UCI |
OXA-23 |
24 (n=26) |
|
|
Brasil (24) |
2018 |
Aspirado traqueal |
Hospitalizaciones |
OXA-51 |
21 (n=23) |
|
|
OXA-23 |
12 (n=23) |
|
||||
|
Brasil (11) |
2019 |
No mostro |
UCI |
OXA-23 |
104 (n=107) |
|
|
OXA-231 |
2 (n=107) |
|
||||
|
OXA-72 |
1 (n=107) |
|
||||
|
Brasil (15) |
2021 |
Secreciones traqueales, hemocultivos, heridas |
UCI y SALA |
OXA-23 |
10 (n=18) |
|
|
Brasil (25) |
2019 |
Aspirados respiratorios |
Hospitalizaciones |
OXA-58 |
2 (n=2) |
|
|
Brasil (12) |
2018 |
Superficies hospitalarias |
UCI |
OXA-23 |
4 (n=14) |
|
|
|
|
|
|
OXA-72 |
2 (n=14) |
|
|
|
|
|
|
OXA-253 |
1 (n=14) |
|
|
Brasil (26) |
2018 |
Hisopado |
UCI |
OXA-51 |
62 (n=62) |
|
|
OXA-23 |
60 (n=62) |
|
||||
|
VIM-1 |
51 (n=100) |
|
||||
|
Perú (3) |
2019 |
Sangre |
Hospitalizaciones |
NDM-1 |
3 (n=124) |
|
|
Perú (27) |
2021 |
Nasofaríngeas |
Hospitalizaciones |
OXA-52 |
47 (n=225) |
|
|
Perú (2) |
2018 |
Sangre |
Hospitalizaciones |
OXA-51 |
2 |
|
|
Aspirado bronquial |
OXA-24 |
65 (n=80) |
|
|||
|
OXA-143 |
2 (n=80) |
|||||
|
Tejidos blandos |
|
|||||
|
Líquido cefalorraquídeo |
OXA-23 |
11 (n=80) |
|
|||
|
Ecuador (28) |
2018-2022 |
|
Hospitalizaciones |
IMP |
1 (n=19) |
|
|
NDM |
18 (n=19) |
|
||||
|
OXA-58 |
34 (n=1525) |
|
||||
|
OXA-143 |
149 (n=1525) |
|
||||
|
OXA-23 |
411 (n=1525) |
|
||||
|
OXA-24 |
231 (n=1525) |
|
||||
|
OXA-51 |
700 (n=1525) |
|
||||
|
Cuba (29) |
2022 |
Sangre, tracto respiratorio, sitio quirúrgico, |
Hospitalizaciones |
OXA-23 |
94 (n=199) |
|
|
OXA-24 |
39 (n=199) |
|
||||
|
OXA-58 |
14 (n=199) |
|
||||
|
NDM |
22 (n=199) |
|
||||
|
Cuba (30) |
2021 |
Respiratorias |
Hospitalizaciones |
OXA-51 |
37 (n=220) |
|
|
Sangre |
UCI |
OXA-23 |
167 (n=220) |
|
||
|
Catéter |
Neonatología |
OXA-24 |
39 (n=220) |
|
||
|
Uruguay (31) |
2018 |
Frotis faríngeos o rectales |
UCI |
OXA-51 |
78 (n=78) |
|
|
OXA-23 |
62 (n=78) |
|
||||
|
OXA-58 |
3 (n=78) |
|
||||
|
Argentina (10) |
2019 |
Aspirados respiratorios |
Hospitalizaciones |
OXA-23 OXA-51 |
100 (n=100) |
|
|
Paraguay (32) |
2021 |
No muestra |
No muestra |
OXA-23 |
325 (n=346) |
|
|
NDM |
13 (n=346) |
|
||||
|
OXA-58 |
6 (n=346) |
|
||||
|
OXA-51 |
6 (n=346) |
|
||||
|
Bolivia (5) |
2021 |
Hemocultivos |
Hospitalizaciones |
OXA-51 |
191 (n=191) |
|
|
Nicaragua (33) |
2020 |
Sangre |
UCI |
NDM |
10 (n=33) |
|
|
México (13) |
2020 |
Sangre |
Medicina interna |
OXA-214 |
7 (n=24) |
|
|
OXA-215 |
1 (n=24) |
|||||
|
Urgencias |
||||||
|
OXA-264 |
2 (n=24) |
|
||||
|
OXA-265 |
7 (n=24) |
|
||||
|
OXA-575 |
3 (n=24) |
|
||||
|
OXA-214 |
7 (n=24) |
|
||||
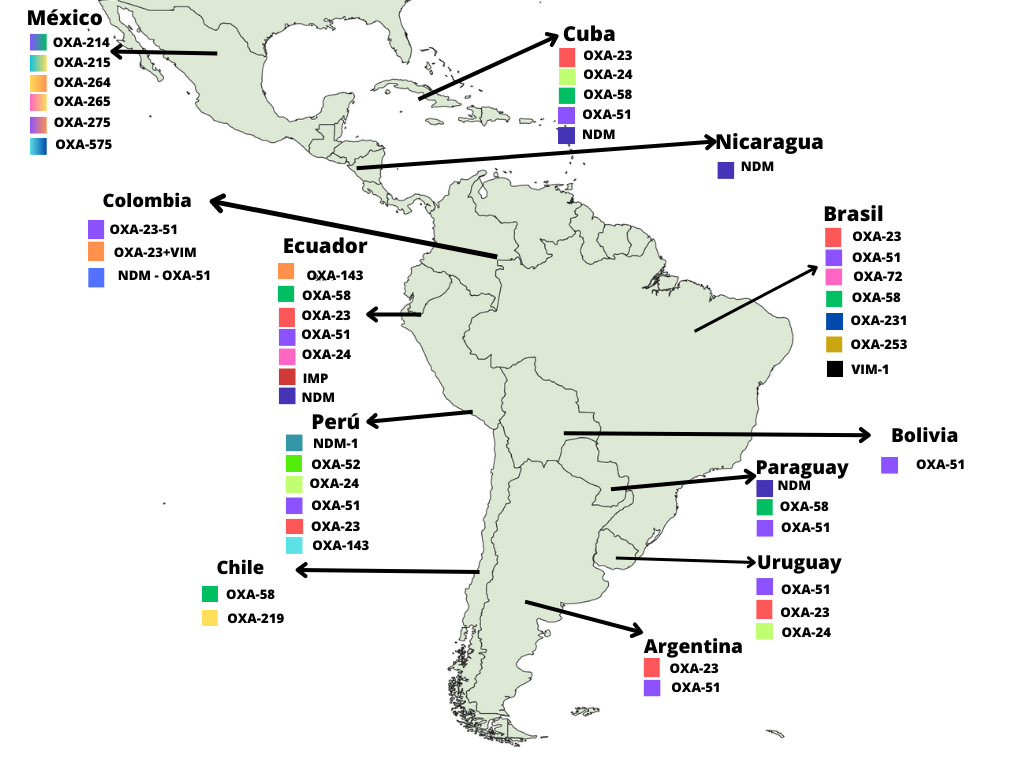
Figura 3. Distribución geográfica de genes de resistencia de A. baumanni en Latinoamérica
DISCUSIÓN
En los últimos años, ha habido una creciente preocupación por las infecciones asociadas a la atención en salud debido a la alta resistencia antimicrobiana que han desarrollado las bacterias, lo cual dificulta la disponibilidad de opciones terapéuticas, en particular A. baumannii ha desarrollado resistencia a los antimicrobianos, lo que representa un desafío significativo en el tratamiento de estas infecciones.(34) Durante la pandemia se ha sugerido utilizar terapia combinada para el tratamiento de los pacientes con infecciones de A. baumanni complex resistente a los carbapenémicos especialmente aquellos que requieren ventilación mecánica.(7)
Uno de los principales mecanismos de resistencia que ha desarrollado A. baumannii es la producción de carbapenemasas de clase D, siendo la más reportada OXA-23, este gen se ha reportado en la mayoría de aislamiento recuperados incluso en muestras de piel y tejidos blandos.(30) En varios países de Latinoamérica, se ha reportado la presencia de este gen, principalmente en Brasil, en pacientes con bacteriemia y meningitis, lo cual se ha asociado con una mayor mortalidad por la presencia de OXA-23.(23,35)
Además, se ha informado la presencia de los genes OXA-72 y OXA-253 en pacientes tratados con métodos invasivos como sonda nasogástrica y hemodiálisis.(12,36) En Perú, es común el reporte de OXA-51 y OXA-24, en aislamientos de A. baumannii complex, especialmente en pacientes pediátricos con diagnóstico de tos ferina, esta población adquiere fácilmente la infección debido a que está asociada con el uso de ventilación mecánica.(2,27)
El gen OXA-58 no es muy frecuente en Latinoamérica, aunque se han reportado aislamientos en Brasil y Chile, no obstante en Chile se reporta el gen OXA-219 proveniente de una cepa ST15, el cual podría contribuir a la resistencia intrínseca del microorganismo.(9,21,25) En México, se ha identificado el gen OXA-214 que se encuentra en el cromosoma de Acinetobacter sp y se han reportado nuevas variantes: OXA-215, OXA-264, OXA-265 y OXA-575 pertenecientes A. haemolyticus, es importante destacar que el gen OXA-575 guarda una alta simlitud del 97,85 % con OXA-214.(13)
En Ecuador, se han reportado aislamientos de A. baumanni complex con los genes de resistencia perteneciente a la familia de las oxacilinas y metalo-beta-lactamasas, que confieren resistencia al microorganismo frente a imipenem y meropenem, antes de la pandemia, la resistencia se encontraba levemente disminuida, no obstante durante la pandemia se ha incrementado significativamente, alcanzando cifras de resistencia del 69 % para meropenem y 70 % para imipenem , además, El Instituto Nacional de Investigación en Salud Publica en su boletín del 2018-2021 reporta la presencia de genes OXA-23, OXA-24, OXA-51, OXA-58, OXA-143 junto con la presencia de las MBLs: IMP y NDM todos los aislamientos correspondientes de diferentes unidades de Salud.(28)
Además, en Colombia se han reportado cepas coproductoras de carbapenemasas: NDM+OXA-51 y VIM+OXA-23, son casos preocupantes, debido a que dos genes actúan simultáneamente en la bacteria produciendo mayor resistencia a los carbapenémicos, cabe resaltar que no solo otorgará resistencia a los carbapenémicos, sino, a una amplia variedad de antibióticos utilizados para controlar las infecciones producidas en los pacientes.(20)
En cuanto a las MBLs no son muy frecuentes en Latinoamérica, pero se ha identificado en Nicaragua, Paraguay y Ecuador aislamientos positivos de NDM, además, en Cuba se ha recuperado aislamientos que muestran incidencia de este gen en 25-28 %.(32,37) En Brasil, se evidencia la aparición de VIM-1 una variante del gen VIM que presenta un ligero cambio en la secuencia de aminoácidos, sin afectar la capacidad de hidrolizar a los antibióticos.(26) Por otro lado, en Ecuador también se reportan aislamientos con genes de tipo IMP.(28) En un estudio realizado en México, se comparó dos técnicas moleculares: PCR y LAMP, siendo esta última la técnica superior en la identificación de los genes que confieren resistencia A. baumannnii complex.(38)
La resistencia a los carbapenémicos es preocupante, en Perú y Argentina, donde se han reportado resistencias que superan el 90 % para imipenem y meropenem, convirtiéndolos en los países con los índices más altos de resistencia para A. baumannnii complex, en cuanto a Paraguay, Guatemala, Honduras, Bolivia, Nicaragua, El Salvador, Ecuador y Panamá su porcentaje de resistencia oscila entre el 60 y 90 %, por último, hay países: Chile, Venezuela, Colombia, República Dominicana donde la resistencia es inferior al 60 % , lo que indica que aún es posible controlar las infecciones causas por la bacteria mediante el uso de carbapenémicos.(18,19)
Los genes más predominantes pertenecen a la familia de las oxacilinas (OXA), que se presentan en todos los países de Latinoamérica, sin embargo, si hay la presencia de MBLs en pocos países, pacientes que se encontraban infectados por A. baumannnii, pueden contraer bacteriemia además de neumonía asociada a la ventilación mecánica, por ende, tienen más probabilidad de sufrir una enfermedad grave, así como, aumentar la resistencia a los carbapenémicos y aumentar su mortalidad del 29-36 %.(6)
El microorganismo se aísla en aspirados respiratorios, es decir, la bacteria tiene afinidad para colonizar las vías respiratorias, sin embargo, existen signos de fiebre o marcadores inflamatorios que serán indicadores de infecciones respiratorias, pero las infecciones en sangre o líquido cefalorraquídeo son poco frecuentes y al conseguir un asilamiento positivo del microorganismo hay que considerar la presencia de los dispositivos médicos a la que estado sometido el paciente en las unidades de salud.(39)
Es crucial implementar estrategias de control de infecciones, promover el uso adecuado de antibióticos y fomentar la investigación continua en el campo de la resistencia a los carbapenémicos. Todas las investigaciones tendrán gran impacto a nivel nacional y regional para mitigar los efectos de la resistencia a los antibióticos en la salud pública.
Limitaciones y Perspectivas Futuras
A lo largo de esta exhaustiva revisión sobre A. baumannnii complex resistente a los carbapenémicos en Latinoamérica, se han identificado ciertas limitaciones que sugieren la necesidad de abordar investigaciones futuras con enfoques metodológicos más estandarizados y con muestras de población más amplias y representativas, además algunos países tenían base de datos restringidas, por ende, no se puede realizar una comparación e identificación epidemiológica sobre el microorganismo, cabe resaltar que la aparición de nuevos datos o investigaciones después de ese punto podría no estar reflejada en la revisión. A pesar de estas limitaciones, esta revisión proporciona una valiosa visión general del problema y resalta la necesidad de futuras investigaciones para abordar este tema y mejorar nuestra comprensión de la resistencia de A. baumannnii complex a los carbapenémicos en Latinoamérica.
Por otro lado, mediante la revisión las futuras investigaciones sobre A. baumannnii complex resistente a los carbapenémicos se deben centrar en los mecanismos de resistencia y en la caracterización molecular de las diferentes cepas que presentan resistencias, con el fin de abrir nuevas vías para el desarrollo de terapias más específicas y dirigidas, además de implementar nuevas medidas de prevención y control en los países que presentan un porcentaje elevado de resistencia a los carbapenémicos.
CONCLUSIONES
En este estudio se han observado cambios significativos en los porcentajes de resistencia a los carbapenémicos durante la pandemia se evidencia un aumento de resistencia en algunos países de Latinoamérica. Se ha encontrado que las carbapenemasas de tipo OXA son las más frecuentes en los distintos países, aunque también se detectan las metalo-beta-lactamasas en menor frecuencia y en menos países.
La revisión resalta la preocupante situación de resistencia a los carbapenémicos en Perú y Argentina, por lo tanto, se debe mantener como prioridad la vigilancia en estos países por la elevada capacidad de resistencia que ha desarrollado el microorganismo en los últimos años, la evolución constante de la bacteria ha llevado a niveles en los cuales los carbapenémicos ya no son una opción terapéutica efectiva para controlarla y es necesario el uso de otras familias de antibióticos, con el fin de establecer un mejor control del microorganismo y evitar problemas en las diferentes unidades de salud.
REFERENCIAS BIBLIOGRÁFICAS
1. Royer S, Amaral de Campos P, Araújo BF, Ferreira ML, Gonçalves IR, William da Fonseca Batistão D, et al. Molecular characterization and clonal dynamics of nosocomial blaOXA-23 producing XDR Acinetobacter baumannii. PLoS ONE 2018;13:1-14. https://doi.org/10.1371/journal.pone.0198643.
2. Levy-Blitchtein S, Roca I, Plasencia-Rebata S, Vicente-Taboada W, Velásquez-Pomar J, Muñoz L, et al. Emergence and spread of carbapenem-resistant Acinetobacter baumannii international clones II and III in Lima, Peru article. Emerging Microbes and Infections 2018;7. https://doi.org/10.1038/s41426-018-0127-9.
3. Rocha C, Bernal M, Canal E, Rios P, Meza R, Lopez M, et al. First report of New Delhi metallo-β-lactamase carbapenemase–producing acinetobacter baumannii in Peru. American Journal of Tropical Medicine and Hygiene 2019;100:529-31. https://doi.org/10.4269/ajtmh.18-0802.
4. OMS. La OMS publica lista de bacterias para las que se necesitan con urgencia nuevos antibióticos. Organización mundial de la salud 2017:1-5.
5. Книрель ЮА, Шнейдер ММ, Попова АВ, Касимова АА, Сенченкова СН, Шашков АС, et al. Расщепление по различным механизмам капсульных полисахаридов Acinetobacter baumannii фаговыми деполимеразами. Биохимия 2020;85:663-71. https://doi.org/10.31857/s032097252005005x.
6. Vijayakumar S, Biswas I, Veeraraghavan B. Accurate identification of clinically important Acinetobacter spp.: an update. Future Science OA 2019;5. https://doi.org/10.2144/fsoa-2018-0127.
7. Shinohara D, Silvia M, Martínez H, Altafini D, Costa B, Helisandra N, et al. Brote de Acinetobacter baumannii endémico resistente a carbapenem en una unidad de cuidados intensivos específica para la enfermedad por coronavirus 2019 (COVID-19). Control de Infecciones Hospitalarias Epidemiologicas 2022;9:1-3. https://doi.org/10.1017/hielo.2020.1335.pr.
8. Polotto M, Casella T, Tolentino FM, Mataruco MM, Porto NKM, Binhardi MFB, et al. Investigation of carbapenemases and aminoglycoside modifying enzymes of Acinetobacter baumannii isolates recovered from patients admitted to intensive care units in a tertiary-care hospital in Brazil. Revista da Sociedade Brasileira de Medicina Tropical 2020;53:0-2. https://doi.org/10.1590/0037-8682-0094-2019.
9. Cifuentes S, Moura Q, Cardoso B, Esposito F, Cerdeira L, Álvarez E, et al. Genomic features of a carbapenem-resistant OXA-219-positive acinetobacter baumannii of international ST15 (CC15) from a patient with community-onset urinary tract infection in Chilean Patagonia. Journal of Global Antimicrobial Resistance 2020;22:756-8. https://doi.org/10.1016/j.jgar.2020.07.011.
10. H. Rodríguez C, Nastro M, A. Flores S, Rodriguez M, Spinozzi M, Bruni G, et al. Molecular epidemiology of carbapenem-resistant isolates of Acinetobacter baumannii in Argentina. Revista Argentina de Microbiologia 2019;51:247-50. https://doi.org/10.1016/j.ram.2017.12.004.
11. Tavares LCB, De Vasconcellos FM, De Sousa WV, Rocchetti TT, Mondelli AL, Ferreira AM, et al. Emergence and persistence of high-risk clones among MDR and XDR A. baumanniiat a Brazilian teaching hospital. Frontiers in Microbiology 2019;10. https://doi.org/10.3389/fmicb.2018.02898.
12. Rocha IV, Xavier DE, Almeida KRH de, Oliveira SR de, Leal NC. Multidrug-resistant Acinetobacter baumannii clones persist on hospital inanimate surfaces. Brazilian Journal of Infectious Diseases 2018;22:438-41. https://doi.org/10.1016/j.bjid.2018.08.004.
13. Bello-López E, Rocha-Gracia R del C, Castro-Jaimes S, Cevallos MÁ, Vargas-Cruz M, Verdugo-Yocupicio R, et al. Antibiotic resistance mechanisms in Acinetobacter spp. strains isolated from patients in a paediatric hospital in Mexico. Journal of Global Antimicrobial Resistance 2020;23:120-9. https://doi.org/10.1016/j.jgar.2020.08.014.
14. Khuntayaporn P, Thirapanmethee K, Kanathum P, Chitsombat K, Chomnawang MT. Comparative study of phenotypic-based detection assays for carbapenemase-producing Acinetobacter baumannii with a proposed algorithm in resource-limited settings. PLoS ONE 2021;16:1-12. https://doi.org/10.1371/journal.pone.0259686.
15. Ribeiro EA, Gales AC, de Oliveira APS, Coelho DD, de Oliveira RA, Pfrimer IAH, et al. Molecular epidemiology and drug resistance of acinetobacter baumannii isolated from a regional hospital in the Brazilian Amazon region. Revista da Sociedade Brasileira de Medicina Tropical 2020;54:1-5. https://doi.org/10.1590/0037-8682-0087-2020.
16. Carretto E. Evaluación multicéntrica del ensayo Xpert Carba-R para la detección de genes de carbapenemasas en aislados de gramnegativos. JOURNAL OF CLINICAL MICROBIOLOGY 2018;56-8:1-8. https://doi.org/10.1128%2FJCM.00272-18.
17. Li Y, Yang X, Zhao W. Emerging Microtechnologies and Automated Systems for Rapid Bacterial Identification and Antibiotic Susceptibility Testing. SLAS Technology 2017;22:585-608. https://doi.org/10.1177/2472630317727519.
18. Data WHO. Pause View : Original por antibiótico - Mapa s. f.:3-7.
19. CENTRO DE REFERENCIA NACIONAL DE RESISTENCIA A LOS ANTIMICROBIANO ; Perfiles de susceptibilidad antimicrobiana 2021.
20. Guerra M, Ruíz F, Arzuza L, Maestre R. Caracterización de bacilos gramnegativos multi-resistentes, aislados en pacientes hospitalizados en instituciones de salud de Barranquilla (Colombia). Revista chilena de infectología 2021;38:189-96. http://dx.doi.org/10.4067/S0716-10182021000200189.
21. Brito BP, Wozniak A. Análisis Genómico de Carbapenem-ResistentesAcinetobacter baumanniiCepas recuperadas de hospitales chilenos revelan linajes específicos de América del Sur y múltiples rutas para la adquisición de genes de resistencia a antibióticos 2022;10. https://doi.org/10.1128/espectro.02463-22.
22. Da Silva K, Maciel W, Croda J, Cayô R, Ramos A, Sales R, et al. Una alta tasa de mortalidad asociada con Acinetobacter baumannii ST79 y ST25 resistentes a múltiples fármacos que portan OXA-23 en una unidad de cuidados intensivos brasileña. PLoS ONE 2018;13:1-17. https://dx.doi.org/10.1371/journal.pone.0209367.
23. Schuertz KF, Tuon FF, Palmeiro JK, Conte D, Telles JPM, Trevisoli LE, et al. Bacteremia and meningitis caused by OXA-23-producing Acinetobacter baumannii – molecular characterization and susceptibility testing for alternative antibiotics. Brazilian Journal of Microbiology 2018;49:199-204. https://doi.org/10.1016/j.bjm.2018.04.002.
24. Royer S, Amaral de Campos P, Araújo BF, Ferreira ML, Gonçalves IR, William da Fonseca Batistão D, et al. Molecular characterization and clonal dynamics of nosocomial blaOXA-23 producing XDR Acinetobacter baumannii. PLoS ONE 2018;13:1-14. https://doi.org/10.1371/journal.pone.0198643.
25. Matos AP, Cayô R, Almeida LGP, Streling AP, Nodari CS, Martins WMBS, et al. Genetic Characterization of Plasmid-Borne bla OXA-58 in Distinct Acinetobacter Species. mSphere 2019;4:1-8. https://doi.org/10.1128/msphere.00376-19.
26. França RO, Costa PS, Milanez GL, Bomfim MRQ, Gonçalves R, Farias LM, et al. Molecular association of pathogenicity and resistance to multiple antimicrobials in Acinetobacter baumannii strains recovered from patients with diverse infectious diseases. Jornal Brasileiro de Patologia e Medicina Laboratorial 2018;54:288-95. https://doi.org/10.5935/1676-2444.20180049.
27. Peña-Tuesta I, del Valle-Vargas C, Petrozzi-Helasvuo V, Aguilar-Luis MA, Carrillo-Ng H, Silva-Caso W, et al. Community acquired Acinetobacter baumannii in pediatric patients under 1 year old with a clinical diagnosis of whooping cough in Lima, Peru. BMC Research Notes 2021;14:1-7. https://doi.org/10.1186/s13104-021-05826-y.
28. Instituto Nacional de Investigación en Salud Pública Centro de Referencia Nacional de Resistencia Antimicrobiana. Vigilancia de BLEE y Carbapenemasas en Ecuador período 2018-2021 2022:1-6.
29. Quiñones Pérez D, Aung MS, Carmona Cartaya Y, González Molina MK, Pereda Novales N, Kobayashi N. Clonal diversity of Acinetobacter clinical isolates producing NDM-type carbapenemase in Cuba, 2013–19. IJID Regions 2022;5:93-6. https://doi.org/10.1016/j.ijregi.2022.08.008.
30. Quiñones D, Carvajal I, Perez Y, Hart M, Perez J, Garcia S, et al. High prevalence of blaOXA-23 in Acinetobacter spp. and detection ofblaNDM-1 in A.soli in Cuba: Report from National Surveillance Program (2010-2012). New Microbes and New Infections 2015;7:52-6. https://doi.org/10.1016/j.nmni.2015.06.002.
31. Bado I, Ezdra R, Delgado J, Gaudio M, Gutiérrez C, Cordeiro NF, et al. Molecular characterization of carbapenem-resistant acinetobacter baumannii in the intensive care unit of Uruguay’s University hospital identifies the first rmtC gene in the species. Microbial Drug Resistance 2018;24:1012-9. https://doi.org/10.1089/mdr.2017.0300.
32. Melgarejo-Touchet N, Brítez CM, Busignani S, Falcón M, López E, Laconich M, et al. Caracterización molecular de carbapenemasas en bacilos gramnegativos circulantes en hospitales de Paraguay. Primer cuatrimestre 2021 TT - Molecular characterization of carbapenemases in Gram-negative bacilli circulating in hospitals of Paraguay. First qu. Mem Inst Invest Cienc Salud (Impr) 2021;19:49-58. http://dx.doi.org/10.18004/mem.iics/1812-9528/2021.019.02.49.
33. Dretler AW, Avila J, Sandoval Lira L, Rener MG, Burger-Calderon R, Hargita MN, et al. High rates of New Delhi metallo-β-lactamase carbapenemase genes in multi-drug resistant gram-negative bacteria in Nicaragua. American Journal of Tropical Medicine and Hygiene 2020;102:384-7. https://doi.org/10.4269/ajtmh.19-0561.
34. Melgarejo-Touchet N, Brítez CM, Busignani S, Falcón M, López E, Laconich M, et al. Caracterización molecular de carbapenemasas en bacilos gramnegativos circulantes en hospitales de Paraguay. Primer cuatrimestre 2021 TT - Molecular characterization of carbapenemases in Gram-negative bacilli circulating in hospitals of Paraguay. First qu. Mem Inst Invest Cienc Salud (Impr) 2021;19:49-58.
35. Carrizo PC. Impact of an intervention on the surface of cellular telephones in a hospital in Salta. Data and Metadata 2022;1:42-42. https://doi.org/10.56294/dm202280.
36. Da Silva K, Maciel W, Croda J, Cayô R, Ramos A, Sales R, et al. Una alta tasa de mortalidad asociada con Acinetobacter baumannii ST79 y ST25 resistentes a múltiples fármacos que portan OXA-23 en una unidad de cuidados intensivos brasileña. PLoS ONE 2018;13:1-17. https://dx.doi.org/10.1371/journal.pone.0209367.
37. Quiñones Pérez D, Aung MS, Carmona Cartaya Y, González Molina MK, Pereda Novales N, Kobayashi N. Clonal diversity of Acinetobacter clinical isolates producing NDM-type carbapenemase in Cuba, 2013–19. IJID Regions 2022;5:93-6. https://doi.org/10.1016/j.ijregi.2022.08.008.
38. Garciglia-Mercado C, Gaxiola-Robles R, Ascencio F, Silva-Sánchez J, Estrada-García T, Gómez-Anduro G. Development of a LAMP method for detection of carbapenem-resistant Acinetobacter baumannii during a hospital outbreak. Journal of Infection in Developing Countries 2020;14:494-501. https://doi.org/10.3855/jidc.11692.
39. Bartal C, Rolston KVI, Nesher L. Carbapenem-resistant Acinetobacter baumannii: Colonization, Infection and Current Treatment Options. Infectious Diseases and Therapy 2022;11:683-94. https://doi.org/10.1007/s40121-022-00597-w.
FINANCIACIÓN
Sin financiación externa.
CONFLICTOS DE INTERESES
Los autores declaran no tener conflictos de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Christian Ivan Manobanda Nata, Evelyn Katherine Jaramillo Ruales.
Investigación: Christian Ivan Manobanda Nata, Evelyn Katherine Jaramillo Ruales.
Metodología: Christian Ivan Manobanda Nata, Evelyn Katherine Jaramillo Ruales.
Redacción – borrador original: Christian Ivan Manobanda Nata, Evelyn Katherine Jaramillo Ruales.
Redacción – revisión y edición: Christian Ivan Manobanda Nata, Evelyn Katherine Jaramillo Ruales.