REVISIÓN BIBLIOGRÁFICA
Métodos directos e indirectos empleados para el diagnóstico de la enfermedad de Chagas en fase aguda y crónica
Direct and indirect methods used for the diagnosis of the Chagas disease in acute and chronic phase
Nayeli Lisbeth Piloso Bazurto1 ![]() , Gabriela Paola Valenzuela Sánchez1
, Gabriela Paola Valenzuela Sánchez1 ![]() *
*
1Universidad Técnica de Ambato. Facultad de Ciencias de la Salud, Carrera de Laboratorio Clínico. Ambato, Ecuador.
Citar como: Piloso Bazurto NL, Valenzuela Sánchez GP. Métodos directos e indirectos empleados para el diagnóstico de la enfermedad de Chagas en fase aguda y crónica. Salud Cienc. Tecnol. 2022;2:152. https://doi.org/10.56294/saludcyt2022152
Recibido: 19-11-2022 Revisado: 01-12-2022 Aceptado: 15-12-2022 Publicado: 16-12-2022
Editor: Lic. Mabel Cecilia Bonardi
RESUMEN
La enfermedad de Chagas o también denominada tripanosomiasis americana es aquella infección parasitaria ocasionada por el Trypanosoma cruzi, éste es un protozoo sanguíneo flagelado que se reproduce normalmente en los tejidos. Dicha enfermedad comprende una fase aguda que se caracteriza por ser asintomática en la mayoría de los casos y una fase crónica que, en el caso de presentar síntomas, afectan principalmente al sistema digestivo, sistema nervioso y corazón. Se realizó una revisión bibliográfica con el objetivo de dar a conocer los principales métodos diagnósticos directos e indirectos empleados tanto en la fase aguda como en la fase crónica de la enfermedad de Chagas. Sin embargo, el diagnóstico de dicha enfermedad muestra ciertas limitaciones, debido a la baja sensibilidad de los métodos indirectos por la cantidad mínima de parásitos en sangre y la baja especificidad de las técnicas parasitológicas. Es por ello que la OMS recomienda que se realicen dos pruebas en paralelo de principios distintos o que utilicen antígenos para establecer un diagnóstico adecuado de dicha enfermedad. A pesar de contar con varios métodos diagnósticos no existe una prueba específica para diagnosticar dicha patología ya que la efectividad del diagnóstico depende del antígeno que se utilice y de la fase en la que se encuentre la enfermedad.
Palabras clave: Enfermedad de Chagas; Trypanosoma Cruzi; Diagnóstico.
ABSTRACT
Chagas disease or American trypanosomiasis is an infection caused by Trypanosoma Cruzi. This flagellated blood parasite reproduces in tissues and organs. Chagas disease presents two phases. The acute phase can be asymptomatic and the chronic phase that is characterised by symptoms that could affect not only the digestive and nervous system but the heart. This review aims to depict the main diagnostic direct and indirect methods of Chagas disease which have been applied to acute and chronic phases respectively. However, Chagas disease diagnosis does have some limitations: low sensitivity of indirect methods, related to low blood parasite concentration, and low specificity of parasitological methods. Therefore, the WHO recommends that two tests should be performed in parallel on different principles or using different antigens to establish a proper diagnosis of the disease. Although there are several diagnostic methods, there is no specific test to diagnose this pathology, as the effectiveness of the diagnosis depends on the antigen used and the stage of the disease.
Keywords: Chagas Disease; Trypanosoma Cruzi; Diagnosis.
INTRODUCCIÓN
La tripanosomiasis americana o enfermedad de Chagas es una zoonosis crónica hemática e hística causada por el Trypanosoma cruzi, el cual es un protozoo sanguíneo flagelado que se reproduce normalmente en los tejidos. Dicho parásito se encuentra circulando entre animales domésticos, silvestres, insectos triatominos y el ser humano. Generalmente la trnsmición de dicho parásito se da de manera vectorial es decir, que el triatomino o chinche vector se infecta al picar al humano o animal cuando este chupa la sangre contaminada con parásitos de T.cruzi y una vez que el insecto nuevamente se alimente de sangre, este expulsa los parásitos de T. cruzi en las heces que luego son depositadas en un nuevo huésped. Sin embargo, también existen otras formas de transmisión, como: congénita, trasplante de órganos, transfusiones sanguíneas o por la ingesta de algún producto contaminado con heces del vector.(1,2)
A nivel mundial se calcula que la enfermedad de Chagas afecta entre 6 y 7 millones de personas, y causa alrededor de 10 mil muertes por año. Por otro lado, debido al flujo migratorio se ha favorecido la transmisión por T.cruzi en todos los continentes, siendo Estados Unidos y Europa las zonas con mayor número de casos reportados.(3)
En el 2010 la OMS indicó que alrededor de 6 millones de personas se encontraban infectadas por T. cruzi en los 21 países que conforman Latinoamerica. La mayoría de casos reportados corresponden a países pertenecientes al Cono Sur (Argentina, Chile, Uruguay y Paraguay) y a la comunidad andina (Bolivia, Colombia, Ecuador y Perú).(3)
Desde el 2013 al 2019, se han registrado en el Sistema de Vigilancia Epidemiológica (SIVE) del Ministerio de Salud Pública de Ecuador 439 casos confirmados de la enfermedad de Chagas, distribuidos en 20 de las 24 provincias del país.(4)
Las provincias que reportan el mayor número de casos de enfermedad de Chagas son El Oro, Guayas y Loja. En cambio, si bien en otras provincias del Ecuador también se han reportado menor número casos (de 1 a 40 casos por provincia) de dicha patología.(4)
Anualmente solo el 1 % de las personas infectadas por T.cruzi reciben diagnóstico y tratamiento adecuado, debido a ciertos factores como:
ausencia frecuente de sintomatología o, en algunos casos, los síntomas son muy leves.
Falta de conocimiento por parte del personal de salud.
Falta de accesibilidad al diagnóstico dado que esta enfermedad se desarrolla en zonas rurales y de escasos recursos.
Falta de atención relativa a enfermedades regionales por parte de los sistemas de salud, entre otros. (5,6)
Para el diagnóstico de la enfermedad de Chagas se emplean métodos directos e indirectos, dependiendo de la fase en la que se encuentra la enfermedad. No obstante, existe una gran cantidad de falsos negativos o positivos principalmente por la presencia de reactividad cruzada con antígenos de la misma familia Trypanosomatidae. Además, existen otros factores asociados a falsos positivos y negativos a saber: la fase de la patología en la que se realiza el diagnóstico y la variabilidad genética de este parásito.(7)
El objetivo de esta revisión bibliográfica es identificar los métodos diagnósticos directos e indirectos empleados en la enfermedad de Chagas, así como su utilidad tanto en la fase aguda como en la fase crónica de la patología. A su vez, se busca proporcionar información a la población en general y sobre todo, al personal de salud con el fin de proveerles el conocimiento adecuado en lo que refiere a los métodos diagnósticos mayormente utilizados para detectar esta enfermedad.
DESARROLLO
T. cruzi posee 3 principales estadíos parasitarios, las formas flegeladas (epimastigote y tripomastigote) y la forma no flagelada (amastigote). La forma de epimastigote se encuentra proliferando en el vector para posteriormente diferenciarse a tripomastigote metacíclico el cual tiene la capacidad de generar la infección en el huésped.(8)
El vector se alimenta de la sangre infectada con tripomastigotes sanguíneos, que al ser ingeridos se diferencian en epimastigotes (forma replicativa pero no infectiva para el humano). Este proceso ocurre en el intestino medio del vector, seguidamente en el intestino posterior dichos parásitos se diferencian en tripomastigotes metacíclicos (forma no replicativa pero infectiva para el humano) los cuales son liberados en las heces del vector tras la picadura producida por este insecto en el huésped. De esta manera, permite el ingreso de las heces contaminadas al organismo a través de lesiones cutáneas o al rascarse la herida provocada por la picadura. Una vez que el parásito se encuentra dentro del organismo del huésped, este se diferencia en amastigote (forma replicativa intracelular). A partir de esta etapa puede presentarse la sintomatología y, por ende, un posible diagnóstico debido a que los amastigotes son los responsables de ocasionar daño a nivel tisular y, por lo tanto, se desencadena una respuesta inmunológica y sistémica. Los parásitos una vez que se han multiplicado pasan nuevamente a su estadío infectivo (tripomastigotes) para posteriormente lisar la célula parasitada, acceder así al torrente sanguíneo e invadir órganos y tejidos (Figura 1).(9,10)
Los tripomastigotes se encuentran en elevadas cantidades durante la fase aguda de la enfermedad de Chagas, pero disminuyen significativamente cuando el huésped empieza a generar anticuerpos.(9)
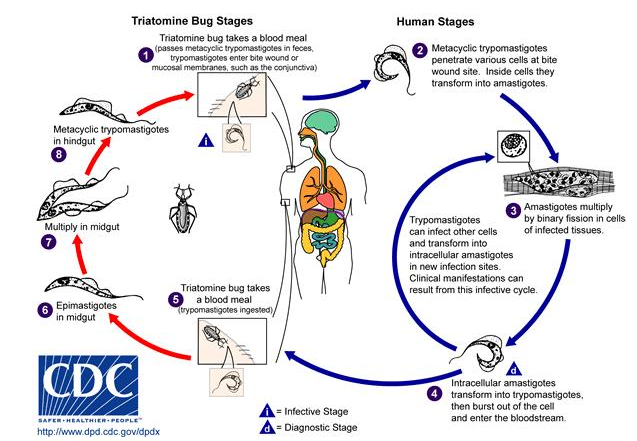
Figura 1. Ciclo biológico de Trypanosoma cruzi. Fue extraído de “Tripanosomiasis americana” y elaborado por Centers for Disease Control and Prevention.(11)
FASES DE LA ENFERMEDAD
Fase aguda
Se define como la etapa inicial de la enfermedad y suele durar de 30 a 90 días. Se caracteriza por una elevada parasitemia la cual se puede detectar mediante métodos directos de laboratorio. Por otra parte, es notable la presencia de invasión tisular multiparenquimatosa. Sin embargo, esta fase frecuentemente pasa desapercibida para el paciente debido a que la sintomatología suele confundirse con un cuadro gripal o ser completamente asintomática, ya que son pocos los casos en los que aparecen lesiones cutáneas indicando el sitio de inoculación.(12)
Los tripomastigotes metacíclicos ingresan a través de la piel lesionada, donde posteriormente, el flujo celular aumentará hacia el sitio de la lesión debido al proceso inflamatorio que se desencadena por la picadura. Los tripomastigotes se diferencian en amastigotes en el citoplasma de los macrófagos - células inicialmente parasitadas en su mayoría-. Posteriormente se forma el “chagoma de inoculación” como resultado de la proliferación de tripomastigotes en los macrófagos hasta llegar a lisarlos. Cuando la infección por parte de los tripomastigotes ocurre en la mucosa ocular se produce el signo de Romaña, característico de esta enfermedad.(13,14)
Una vez que los parásitos se dispersan por el torrente sanguíneo y linfa, estos invadirán tejidos. Los amastigotes se reproducirán dentro de las células y las destruirán, produciendo lo que se conoce como colonización parasitaria en todos los órganos y tejidos, que será reemplazada por una reacción inflamatoria. Por otra parte, los infiltrados inflamatorios rara vez se encuentran en relación con los conglomerados de amastigotes rotos. Esto se debe a que los responsables de la inflamación no son los parásitos en sí, sino sus fracciones subcelulares. La enfermedad se torna letal al producirse una respuesta inflamatoria severa. Por el contrario, si se supera el cuadro inflamatorio el paciente se recupera gracias a la respuesta del sistema inmunitario específica y a la reducción de parásitos hísticos y circulantes.(14,15)
Dentro de las manifestaciones clínicas de la enfermedad se encuentran la cefalea, mialgia y el signo de Romaña cuando la infección se da por vía conjuntiva ocular. Dicho signo se caracteriza por la presencia de edema bipalpebral unilateral indoloro, el cual suele desaparecer después de 2 o 3 semanas. Otras de las manifestaciones clínicas son la presencia del síndrome febril, hepatomegalia, miocarditis, edema y el chagoma de inoculación presente cuando la afección ocurre en la piel.(16)
Fase latente
Esta fase comienza entre 8 a 10 semanas posteriores a la fase aguda, con la presencia o no de sintomatología en dicha fase. Cabe aclarar que en la fase latente el paciente no presenta síntomas permitiéndole realizar sus actividades cotidianas con normalidad. Del mismo modo, las radiografías torácicas y electrocardiogramas se observan normales, sin embargo, las pruebas serológicas asociadas a esta enfermedad resultan positivas. Alrededor del 70 % de los casos no presentan daño en órganos diana y continúan asintomáticos el resto de su vida lo que se conoce como forma indeterminada.(17,18)
En lo que refiere al ciclo vital del parásito, durante esta fase los amastigotes intracelulares se encuentran en tejidos infectados principalmente en el músculo esquelético y cardíaco. Las personas pertenecientes a las zonas endémicas donde se mantiene la transmisión vectorial fungen como reservorio de la infección de T.cruzi permitiendo mantener el ciclo vital del parásito.(14)
Fase crónica
Se suele desarrollar entre 10 a 30 años posteriores a la infección inicial y se caracteriza por la persistencia de la infección parasitaria, aún habiendose superado la fase aguda clínicamente, es decir con la correspondiente remisión de signos y síntomas presentados en dicha fase. En esta etapa, el parásito suele presentarse en el torrente sanguíneo en muy bajas concentración por lo que es compleja su detección mediante métodos directos. Por esta razón, se utilizan métodos serológicos o indirectos.(12,18)
MÉTODOS DE DIAGNÓSTICO
Métodos directos
Estos métodos son empleados para comprobar la presencia del parásito a través de la observación directa del tripomastigote metacíclico en la muestra de sangre para el diagnóstico durante la fase aguda de la enfermedad, especialmente cuando el paciente está en estado febril y el nivel de parasitemia es elevado.(18)
Entre los principales métodos directos se encuentran:
Examen Microscópico directo en sangre fresca:
Para la realización de esta prueba se toma 1 gota de sangre periférica, sangre de cordón umbilical o de líquido cefalorraquídeo. Dicha muestra se analiza al microscopio con los objetivos 10X y 40X. Esta prueba se realiza con el fin de detectar a los tripanosomas por su movilidad vigorosa entre los eritrocitos.(20,21,22)
Examen Microscópico en gota gruesa de sangre
En este método se colecta una muestra de sangre sin anticoagulante. Luego, se colocan de 3 a 4 gotas las cuales se extienden en forma de capa uniforme y gruesa sobre un portaobjetos y posteriormente, se deja secar. Finalmente, se realiza la tinción Giemsa. El objetivo de esta prueba es observar a los tripomastoges metaciclícos fijados, así como su morfología característica, en forma alargada en S o C, con un núcleo azul claro.(20,21,22)
Método de Strout (Concentración de sangre por centrifugación)
En esta prueba se extraen de 2 a 3 ml de sangre en un tubo sin anticoagulante por flebotomía, el cual se deja coagular por 2 a 4 horas a una temperatura de 24 a 28 °C. Luego la retracción del coágulo se obtiene el suero y se centrifuga a una velocidad de 1500 RVM por 3 min con la finalidad de eliminar los eritrocitos restantes. Se centrifuga nuevamente a una mayor velocidad (3500 a 4000 RVM) por 5 min para que los parásitos se concentren en el sedimento. Por último, se elimina el sobrenadante y se examina el sedimento en un portaobjetos para observar al parásito o realizar un extendido para su posterior tinción. Investigaciones previas indican que este método tiene una sensibilidad del 80 a 90 %, no obstante, también se menciona que se requiere de personal altamente capacitado para la interpretación de los resultados.(20,22,23)
Microhematocrito
En este método se recolecta una muestra de sangre en un microhematocrito heparinizado o un capilar, la cual se centrifuga a 8000-12000 RPVM y se observa al microscopio la interfase entre los eritrocitos y el plasma (la capa de glóbulos blancos). La observación puede realizarse con extendidos y tinción Giemsa o por montaje directo en fresco con el fin de buscar tripomastigotes metaciclícos.(18,20)
Según autores si la observación es realizada por personal experto, la sensibilidad de esta prueba puede ser hasta de un 85 %.(20,24)
Reacción en cadena de la polimerasa o PCR
La finalidad de esta técnica es obtener varias copias de un fragmento de ADN a partir de una pequeña muestra de sangre. En particular, la PCR se basa en amplificar copias del ADN del parásito usando cualquiera de los siguientes marcadores moleculares: el kinetoplasto (kADN), el ADN de la subunidad II del gen mitocondrial de la citocromo oxidasa y la secuencia repetida de ADN satélite, así como tambíen, de los genes del ARN ribosomal.(19,20,21)
En otras investigaciones se menciona que este método presenta una gran variabilidad en los resultados debido a los diferentes kits desarrollados por las diversas marcas presentes en el mercado. Consecuentemente, otros autores indican que la sensibilidad de dicho método puede llegar hasta un 79,5 % en fase aguda y un 26,2 % en la fase crónica con una especificidad del 100 %.(25)
MÉTODOS INDIRECTOS
Tienen por objeto evidenciar la presencia de anticuerpos de tipo Ig G anti T.cruzi en muestras de: suero, liquido cefalorraquideo, humores del ojo, entre otras. De esta manera, contribuyen al diagnóstico, dan seguimiento a la respuesta inmunológica del individuo infectado frente a terapias, recaídas, así como también determinan la curación serológica en pacientes inmunocomprometidos.(26)
Entre los principales métodos indirectos se encuentran:
IFI (inmunofluorescencia indirecta)
Este método se basa en la reacción antígeno/anticuerpo en donde se genera un producto coloreado a través de una sustancia fluorescente. La lectura se realiza mediante un microscopio de luz ultravioleta.(27)
Los anticuerpos que se encuentran en el suero del paciente infectado con T.cruzi, se colocan sobre una lámina que contiene formas de epimastigotes de T.cruzi que son revelados mediante anticuerpos anti-inmunoglobulina humana adheridos a fluoresceína. Dicha prueba se considera reactiva cuando los títulos son iguales o mayores a 1:32. Por otro lado, se puede generar falsos positivos debido una reactividad cruzada con otros parásitos como Trypanosoma rangeli o Leishmania spp.(18,20)
Investigaciones previas han reportado que la sensibilidad y especificidad de este método es del 98,5 % y 85,4 %, respectivamente.(28)
HAI (hemoaglutinación indirecta)
Esta técnica se basa en detectar la presencia de anticuerpos específicos aglutinantes anti T.cruzi en el suero de pacientes que padezcan la enfermedad de Chagas. Las formas de epimastigotes de T. cruzi son fijados a la superficie de los hematíes tanados con ácido tánico los cuales tienen la capacidad de absorber los antígenos parasitarios (epimastigotes) con el fin de sensibilizar a los eritrocitos. Ante la presencia de anticuerpos anti T.cruzi, se producirá una reacción antígeno/anticuerpo que da como resultado la aglutinación de los hematíes, cuando la prueba es positiva. Los falsos positivos pueden generarse por la presencia de anticuerpos heterófilos. (18) Tras la recopilación bibliográfica de varios autores estos indican que dicho método posee tanto una sensibilidad como una especificidad del 99 %.(29)
ELISA (ensayos inmunoenzimáticos)
Este método indica la presencia de anticuerpos de tipo Ig G por colorimetría. Dichos anticuerpos se encuentran unidos a una enzima (fosfatasa alcalina o peroxidasa) que en presencia de su sustrato generará un producto coloreado.(19)
Los antígenos a utilizar pueden ser: totales, recombinantes, péptidos sintéticos o purificados a partir de cepas de T.cruzi. Dichos antígenos se fijan a una placa de plástico para luego incubarse junto con el suero del paciente infectado con T. cruzi favoreciendo la unión antígeno/anticuerpo. Posteriormente se añade el conjugado (anticuerpos de tipo Ig G anti- humano unidos a fosfatasa alcalina o peroxidasa), se realizan los lavados correspondientes y, finalmente, se añade el sustrato de la enzima utilizada el cual presenta un cromógeno. En los casos positivos se emitirá una coloración ocasionada por la reacción enzimática medida por densidad óptica.(24) Según investigaciones previas se ha evidenciado que este método tiene una sensibilidad del 96 % y una especificidad del 97 %.(29)
Generalmente se utilizan los métodos directos durante la fase aguda de la enfermedad mientras que los métodos indirectos se utilizan durante la fase crónica de la misma. Sin embargo, estos últimos pueden arrojar tanto falsos negativos como positivos o discordantes, es decir, pacientes que no son positivos a todas las pruebas. Cabe destacar que los métodos indirectos solo indican la presencia de anticuerpos contra el parásito y no dan información acerca de la presencia activa del mismo.(9)
PRUEBAS RÁPIDAS
Las pruebas rápidas para el diagnóstico de la enfermedad de Chagas comparten el mismo principio de ser inmunoensayos cromatográficos cualitativos de flujo lateral, cuya finalidad es detectar anticuerpos de tipo Ig G anti T.cruzi en plasma o suero humano utilizando antígenos recombinantes o péptidos sintéticos. Este tipo de pruebas exhiben una sensibilidad y especificidad que va del 92 al 100 % según lo reportado en investigaciones previas. Por otro lado, también se menciona que este tipo de test se recomiendan para la vigilancia y el cribado de dicha patología, considerando que los resultados deben ser confirmados con pruebas convencionales como las que se han mencionado anteriormente.(28,30)
Abordaje para diagnosticar infección por T. Cruzi -fases aguda y crónica-
Un diagnóstico robusto se basa en información clínica, epidemiológica y de laboratorio. En particular, para el diagnóstico de la infección por T. cruzi se propone un algoritmo según la fase que se encuentre transitando el paciente. En lo que refiere a la fase aguda, se recomienda utilizar métodos parasitológicos directos en paralelo.
Si dichas pruebas no confirmaran la presencia del parásito deberán repetirse dentro del periodo semanal o hasta descartar la sospecha clínica. Por otra parte, se recomienda aplicar métodos serológicos antigénicos, como ELISA en sus diferentes versiones, de resultar negativas las pruebas parasitológicas.
En caso de obtener resultados negativos a partir del primer muestreo, se toma una segunda muestra aplicandosé nuevamente métodos serológicos antigénicos luego de 20-25 días (Figura 2).
Respecto a la fase crónica, dado que la parasitemia en esta fase resulta inconsistente y baja se proponen métodos serológicos para diagnosticar la infección. Se recomienda específicamente el tamizaje con una prueba rápida o bien, un ELISA con anticuerpos totales debido a su alta sensibilidad.
De obtener resultados negativos en las pruebas antedichas, se informa y brinda recomendaciones al paciente. De continuar la sospecha del caso, se pediría una nueva prueba.
Por otro lado, si las pruebas previamente comentadas resultan positivas o indeterminadas se recomienda su confirmación mediante el uso de otro método indirecto o bien, utilizando el mismo ELISA en una versión antigénica diferente a la de la primera prueba. Si en esta instancia, se obtiene un resultado negativo se propone una tercera prueba indirecta -IFI- (Figura 3).(20)
Algoritmos para la detección diagnóstica de la infección por Trypanosoma cruzi

Figura 2. Algoritmo para el diagnóstico de Chagas en fase aguda. Adaptado desde “Protocolo para la vigilancia en salud pública de Chagas”, Ministerio de la Protección Social de Colombia.(20)
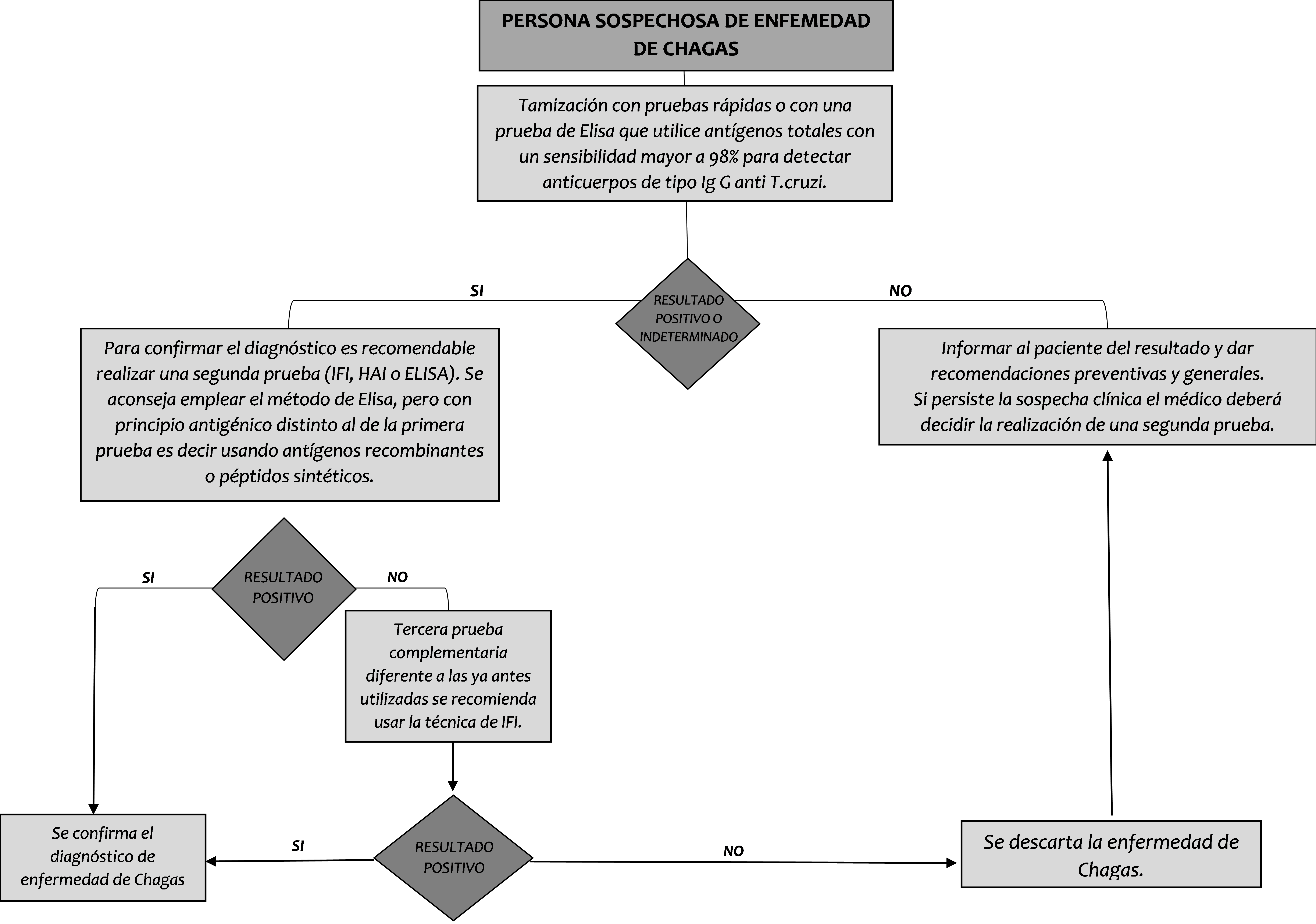
Figura 3. Algoritmo para el diagnóstico de Chagas en fase crónica. Fue extraído de “Protocolo para la vigilancia en salud pública de Chagas” y elaborado por Ministerio de la Protección Social de Colombia.(20)
CONCLUSIONES
Para el diagnóstico de la enfermedad de Chagas es importante tener en cuenta la fase en la que se encuentra el paciente con el fin de aplicar el método diagnóstico correcto. Esto se debe a que, como ya se ha mencionado, en la fase aguda es recomendable aplicar métodos directos dada la elevada parasitemia que suele presentar el paciente.
Por otro lado, en la fase crónica se recomienda emplear métodos indirectos los cuales se encargan de medir los anticuerpos generados por el paciente. La elección de este tipo de métodos por sobre los directos radica en que la probabilidad de hallar parásitos en sangre en esta fase es escasa, dificultando el diagnóstico mediante la utilización de métodos directos.
En lo que respecta a la fase aguda, el diagnóstico es complicado debido a la ausencia de sintomatología en la mayoría de los casos. No obstante, el método con mayor sensibilidad (85 %) reportada por varios autores es el Microhematocrito siempre y cuando la técnica sea realizada por personal experimentado.
Cabe destacar que, si bien la PCR es un método altamente específico, los resultados de dicho método presentan una gran variabilidad principalmente por la heterogeneidad de la técnica lo cual disminuye su sensibilidad.
Basado en la sensibilidad de cada método reportado y tras la recopilación bibliografíca realizada para la elaboración del presente artículo se concluye, que para la fase crónica se recomienda utilizar el método HAI (hemoaglutinación indirecta) o IFI (inmunofluorescencia indirecta) ya que cuenta con una sensibilidad del 99 % y 98,5 % respectivamente. A pesar de contar con una sensibilidad superior a la PCR, suelen presentar una desventaja considerable: la lectura e interpretación de resultados depende de la experiencia del personal que lo realiza. A raíz de esto, ciertos autores recomiendan emplear métodos que utilicen antígenos de secreción-excreción del parásito como es el método de ELISA (ensayos inmunoenzimáticos) considerando que dicho método cuenta con una sensibilidad de 96 % según lo reportado.
La especificidad y sensibilidad es uno de los principales problemas para el diagnóstico de la enfermedad de Chagas. En consecuencia, la Organización Mundial de la Salud (OMS) recomienda: para confirmar un caso agudo se empleen pruebas parasitológicas sobre todo el microhematocrito ya que tiene una mayor sensibilidad y para confirmar un caso crónico, se combinen dos pruebas serológicas que pueden ser ELISA, IFI o HAI y una tercera prueba para detectar anticuerpos contra T. cruzi como lo es el método de ELISA con variación antigénica.
Por último, cabe mencionar que las pruebas rápidas para el diagnóstico de la enfermedad de Chagas son de gran utilidad debido a que se pueden realizar en centros de atención primaria y el resultado se puede obtener en menos de 1 hora. A más de lo antedicho, se convierten en una alternativa altamente relevante cuando no es posible realizar pruebas serológicas en un laboratorio sobre todo en zonas de bajos recursos económicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de Salud y Protección Social, Federación Médica Colombiana. Enfermedad de Chagas. Cientifico-Médica; 2013. https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/TH/Memorias_chagas.pdf
2. Ramsey J, Monreal L, Ortiz-Panozo E, Navarro S, Sánchez González G, Bravo-Ramírez I. Síntesis sobre políticas de salud. https://insp.mx/assets/documents/webinars/2021/CRISP_Chagas_1nov_2.pdf
3. Molina I, Salvador F, Sánchez-Montalvá A. Actualización en enfermedad de Chagas. Enfermedades Infecciosas y Microbiología Clínica 2016; 34(2):132-8. https://doi.org/10.1016/j.eimc.2015.12.008
4. Torres REO, Jaramillo KMP, González IA, Noboa MFO. Diseño y validación de cuestionario de conocimientos, actitudes y prácticas de la enfermedad de Chagas. Boletín de Malariología y Salud Ambiental 2021;61:443-51. https://doi.org/10.52808/bmsa.7e5.613.009.
5. Valero Rando R, Rodríguez Soto AL, Lafuente Gines M, Pérez Lafuente N, Domínguez Berdejo S, Navarro Egea M. Enfermedad de Chagas. Revista Sanitaria de Investigación. 2021. https://revistasanitariadeinvestigacion.com/enfermedad-de-chagas/.
6. Organización Panamericana de la Salud. Guía para el diagnóstico y el tratamiento de la enfermedad de Chagas. 2018. https://iris.paho.org/bitstream/handle/10665.2/49653/9789275320433_spa.pdf
7. Domínguez JL, Ligonio AR, Mendoza AC, Díaz M del CM, Cruz VAR, Monteon AL. El diagnóstico para la enfermedad de Chagas: a más de 110 años de su descubrimiento. Kuxulkab’ 2021;27(58):31–9. https://doi.org/10.19136/kuxulkab.a27n58.3850
8. InfoChagas. Ciclo de vida del parásito - COALICIÓN CHAGAS. 2022. https://www.infochagas.org/ciclo-de-vida-del-parasito.
9. Bao LNH, Pino GB. Enfermedad de Chagas / Chagas disease. Ciencia & Conciencia 2020;3:28.
10. Murillo-Godínez G. Enfermedad de Chagas (tripanosomiasis americana). Med Int Mex. 2018;34(6):959-970. https://doi.org/10.24245/mim.v34i6.2217.
11. Centers for Disease Control and Prevention. Tripanosomiasis americana. 2021. https://www.cdc.gov/dpdx/trypanosomiasisamerican/index.html
12. Palmezano Díaz JM, Plazas Rey LK, Rivera Castillo KE, Rueda Rojas VP. Enfermedad de chagas: realidad de una patología frecuente en Santander, Colombia. Méd.UIS 2015;28(1):81-90.
13. Rivero GI. Enfermedad de chagas. Rev Med Cos Cen. 2016;73(619):297-301.
14. Lidani KCF, Andrade FA, Bavia L, Damasceno FS, Beltrame MH, Messias-Reason IJ, et al. Chagas Disease: From Discovery to a Worldwide Health Problem. Frontiers in Public Health 2019;7:166. https://doi.org/10.3389/fpubh.2019.00166
15.Esteban A. Trypanosomaspp. En: Alina H, Margarita V, Jorge S. Microbiología y Parasitología Médicas. Tomo III. 18aed. La Habana: Edictorial Ciencias Médicas; 2001. Pág. 49 –67.
16. INSPI. (2020). Manual De Vigilancia Y Control De La Enfermedad De Chagas En El Ecuador. Docslib. https://docslib.org/doc/11500910/manual-de-vigilancia-y-control-de-la-enfermedad-de-chagas-en-el-ecuador#pfb
17. Organización Mundial de la Salud (OMS). Control de la enfermedad de Chagas. Who Library. http://apps.who.int/iris/bitstream/handle/10665/38610/924320811_spa.pdf;jsessionid=378D3ED4BEBA2D57E9E240DF55E16755?sequence=1
18. Manzullo HFJL. Síntesis de la Guía de Diagnóstico y Tratamiento de Pacientes con Enfermedad de Chagas. 2006. http://iah.salud.gob.ar/doc/Documento96.pdf
19. Ribeiro V, Dias N, Paiva T, Hagström-Bex L, Nitz N, Pratesi R, et al. Current trends in the pharmacological management of Chagas disease. International Journal for Parasitology: Drugs and Drug Resistance 2020;12:7-17. https://doi.org/10.1016/j.ijpddr.2019.11.004
20. Ministerio de la Protección Social de Colombia. Protocolo para la vigilancia en salud pública de Chagas. Subdirección de Vigilancia y Control en Salud Pública Protocolo de vigilancia y control de Chagas. https://www.minsalud.gov.co/Documents/Salud%20P%C3%BAblica/Ola%20invernal/Protocolo%20Chagas.pdf
21. López Nicolás MM. Enfermedad de Chagas en Europa. 2019. http://147.96.70.122/Web/TFG/TFG/Memoria/MARTA%20MARIA%20LOPEZ%20NICOLAS.pdf
22. Moya Cruz MA, Ruiz Valle NS, Sánchez Díaz OA. Diagnóstico microbiológico de las enfermedades infecciosas. Instituto Politécnico de la Salud “Luis Felipe Moncada”; 2019. https://core.ac.uk/download/pdf/250409808.pdf
23. Balouz V, Agüero F, Buscaglia CA. Chapter One - Chagas Disease Diagnostic Applications: Present Knowledge and Future Steps. En: Rollinson D, Stothard JR, editores. Advances in Parasitology, vol. 97, Academic Press; 2017, p. 1-45. https://doi.org/10.1016/bs.apar.2016.10.001.
24. Riera C. Diagnóstico de laboratorio de la enfermedad de Chagas. SEQC; 2019. https://www.seqc.es/download/tema/7/3322/1691691345/1217704/cms/tema-7-diagnostico-de-laboratorio-de-la-enfermedad-de-chagas.pdf
25. Ferrer E, Lares M, Viettri M, Medina M. Comparación entre técnicas inmunológicas y moleculares para el diagnóstico de la enfermedad de Chagas. Enfermedades Infecciosas y Microbiología Clínica. 2013;31(5):277–82. https://doi.org/10.1016/j.eimce.2021.11.002.
26. Martínez I, Cervantes-Landín A, Espinoza B. Diagnóstico molecular de la enfermedad de Chagas. Gaceta Médica de México 2013;149(3):363–5.
27. De Villasante Fuentes M, Pastor PH. El diagnóstico de la enfermedad de Chagas. Actualización en Medicina de Familia 2015;11:141-5.
28. Flores-Chávez M, Cruz I, Rodríguez M, Nieto J, Franco E, Gárate T, et al. Comparación de técnicas serológicas convencionales y no convencionales para el diagnóstico de la enfermedad de Chagas importada en España. Enfermedades Infecciosas y Microbiología Clínica 2010;28(5):284–93. https://doi.org/10.1016/j.eimc.2009.07.005
29. Cannova DC, Aguilar Cruz M, Pacheco M, Simons MI, Medina M. Validación del inmuno ensayo enzimático (ELISA) y hemoaglutinación indirecta (HAI) para el serodiagnóstico de la Enfermedad de Chagas. Salus 2002;6:4-9.
30. Eguez Soliz KE. Evaluación de la eficacia de las pruebas inmunocromatográficas (STAT-PAK E INBIOS) aplicadas en paralelo, respecto al protocolo convencional (HAI-ELISA) para el diagnóstico de chagas. Laboratorio departamental de referencia de Chuquisca, Marzo a Mayo de 2014. Master’s Thesis. Universidad Andina Simón Bolívar, 2014.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
No existen.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Nayeli Piloso.
Investigación: Nayeli Piloso.
Metodología: Gabriela Valenzuela.
Administración del proyecto: Gabriela Valenzuela.
Supervisión: Gabriela Valenzuela.
Validación: Gabriela Valenzuela.
Visualización: Gabriela Valenzuela.
Redacción – borrador original: Nayeli Piloso, Gabriela Valenzuela.
Redacción – revisión y edición: Nayeli Piloso, Gabriela Valenzuela.