doi: 10.56294/saludcyt2024.1016
REVISIÓN
Non-alcoholic fatty liver and periodontal disease in the adult population: Overview of systematic reviews
Enfermedad periodontal e hígado graso no alcohólico en población adulta. resumen de revisiones sistemáticas
Héctor Fuentes-Barría1,2 ![]() *, Blanca Klahn-Acuña2 *, Denisse Sepúlveda-Toro2 *, Najarett Galaz-Cáceres2 *, Raúl Aguilera-Eguía3
*, Blanca Klahn-Acuña2 *, Denisse Sepúlveda-Toro2 *, Najarett Galaz-Cáceres2 *, Raúl Aguilera-Eguía3 ![]() *, Miguel Alarcón-Rivera4,5
*, Miguel Alarcón-Rivera4,5 ![]() *
*
1Universidad Arturo Prat. Iquique, Chile.
2Universidad Andres Bello. Concepción, Chile.
3Departamento de Salud Pública, Facultad de Medicina, Universidad Católica de la Santísima Concepción. Concepción, Chile.
4Escuela de Ciencias del Deporte y Actividad Física, Facultad de Salud, Universidad Santo Tomás. Talca, Chile.
5Facultad de medicina, Universidad Católica del Maule, Chile.
Citar como: Fuentes-Barría H, Klahn-Acuña B, Sepúlveda-Toro D, Galaz-Cáceres N, Aguilera-Eguía R, Alarcón-Rivera M. Non-alcoholic fatty liver and periodontal disease in the adult population: Overview of systematic reviews. Salud, Ciencia y Tecnología. 2024; 4:.1016. https://doi.org/10.56294/saludcyt2024.1016
Enviado: 23-02-2024 Revisado: 18-05-2024 Aceptado: 09-10-2024 Publicado: 10-10-2024
Editor: Dr.
William Castillo-González ![]()
Autor para la correspondencia: Héctor Fuentes-Barría *
ABSTRACT
Introduction: periodontal disease is a chronic inflammatory condition affecting the periodontal supporting tissues. In addition to dental loss, it has been associated with various metabolic disorders, including obesity, diabetes, dyslipidemia, and non-alcoholic fatty liver disease (NAFLD). This study aimed to analyze the effects of periodontal disease on the prevention and treatment of NAFLD in the adult population.
Method: an electronic search of systematic reviews published between 2019 and 2024 was conducted in the Medline, Scopus, and Web of Science databases, as well as in the Epistemonikos meta-search engine. The search strategy was “Non-alcoholic Fatty Liver Disease AND Periodontitis”. A total of 47 articles were identified, of which three systematic reviews with meta-analyses were analyzed.
Results: the results indicated a potential association between periodontal disease and NAFLD, with an odds ratio (OR) of 1,48 (95 % CI: 1,15 to 1,89; I² = 92 %) and 1,91 (95 % CI: 1,21 to 3,02; I² = 95 %). However, this link has not been definitively proven, as heterogeneity decreases and the number of patients increases, resulting in an OR of 1,04 (95 % CI: 0,97 to 1,12; I² = 58 %).
Conclusion: it is suggested that systemic inflammation and pro-inflammatory markers may play a significant role in the pathophysiology of both conditions. Nonetheless, further studies are needed to clarify this relationship and explore the common metabolic parameters.
Keywords: Non-Alcoholic Fatty Liver Disease; Periodontitis, Periodontal Diseases; Porphyromonas Gingivalis; Quality of Life.
RESUMEN
Introducción: la enfermedad periodontal es una afección inflamatoria crónica que afecta los tejidos de soporte periodontal. Además de la pérdida dentaria, se ha asociado con varios trastornos metabólicos, incluyendo obesidad, diabetes, dislipidemia y hígado graso no alcohólico (HGNA). Este estudio tuvo como objetivo analizar los efectos de la enfermedad periodontal sobre la prevención y tratamiento del HGNA en la población adulta.
Método: se realizó una búsqueda electrónica de revisiones sistemáticas publicadas entre 2019 y 2024 en las bases de datos Medline, Scopus y Web of Science, así como en el metabuscador Epistemonikos. La estrategia de búsqueda fue “Non-alcoholic Fatty Liver Disease AND Periodontitis”. Se encontraron 47 artículos, de los cuales se analizaron tres revisiones sistemáticas con metaanálisis.
Resultados: los resultados indicaron una posible relación entre la enfermedad periodontal y el HGNA, con un odds ratio (OR) de 1,48 (IC 95 %: 1,15 a 1,89; I² = 92 %) y 1,91 (IC 95 %: 1,21 a 3,02; I² = 95 %). Sin embargo, este vínculo no se ha demostrado de manera definitiva, al disminuir la heterogeneidad y aumentar el número de pacientes, resultando en un OR de 1,04 (IC 95 %: 0,97 a 1,12; I² = 58 %).
Conclusión: se sugiere que la inflamación sistémica y los marcadores proinflamatorios podrían desempeñar un papel importante en la fisiopatología de ambas condiciones. No obstante, se necesitan más estudios para clarificar esta relación y explorar los parámetros metabólicos comunes.
Palabras clave: Enfermedad del Hígado Graso No-Alcohólico; Periodontitis; Enfermedades Periodontales; Porphyromonas Gingivalis; Calidad de Vida.
INTRODUCCIÓN
La enfermedad periodontal es una afección inflamatoria crónica que compromete los tejidos de soporte de los dientes y no solo puede llevar a la pérdida dentaria, sino que también se ha asociado con varios trastornos metabólicos, como la obesidad, la diabetes, la dislipidemia y las enfermedades cardiovasculares.(1,2) Recientemente, ha surgido evidencia que sugiere una posible influencia negativa de la periodontitis en la salud hepática, particularmente en la fisiopatología del HGNA.(1,3)
El HGNA es una enfermedad sistémica que requiere un enfoque multidisciplinario para su manejo efectivo. Dado el gran número de pacientes afectados, es esencial la colaboración entre diversas especialidades médicas, como gastroenterólogos, hepatólogos, médicos de familia, dentistas, nutricionistas y farmacéuticos.(4,5) Esta cooperación es crucial para proporcionar una atención integral que aborde las múltiples facetas de la enfermedad.
La conexión entre la periodontitis y el HGNA se basa en la hipótesis de que la inflamación sistémica inducida por la infección periodontal podría contribuir a la acumulación de grasa en el hígado. En particular, se ha postulado que la bacteria Porphyromonas gingivalis, presente en la periodontitis, puede ingresar al torrente sanguíneo a través de encías inflamadas y llegar al hígado, desencadenando una respuesta inflamatoria que agrava la acumulación de grasa hepática.(6,7) Además, ciertas cepas bacterianas periodontales, como las fimbrias de tipo II, han mostrado una mayor capacidad invasiva, potenciando la patogenicidad de otros microorganismos orales como Aggregatibacter actinomycetemcomitans y modulando la respuesta inflamatoria del huésped a nivel hepático.(8,9)
Dado el papel central del hígado en el metabolismo, la síntesis de proteínas, la desintoxicación y la regulación de los niveles de glucosa y lípidos en la sangre, la salud hepática es fundamental para el mantenimiento de la homeostasis.(10) La comprensión de las interacciones entre la enfermedad periodontal y el HGNA abre la puerta al desarrollo de nuevas estrategias terapéuticas y preventivas. Estas podrían no solo reducir la carga bacteriana periodontal, mejorando la salud oral, sino también proteger contra la progresión del HGNA, ofreciendo un enfoque integral para la salud general del paciente.(11,12)
Por estas razones, esta revisión tiene como objetivo analizar los efectos de la enfermedad periodontal en la prevención y tratamiento del HGNA en la población adulta, con el fin de proporcionar una base para futuras estrategias de manejo clínico que integren la salud oral y hepática.
MÉTODO
Diseño
Este resumen de revisiones sistemáticas fue basado en el ‘’Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)’’.(13)
Criterios de elegibilidad
La elegibilidad de los estudios incluyó la metodología del acrónimo P.I.C.O (participantes, intervención, comparación y outcome de interés), considerando los siguientes criterios de inclusión:
P: Adultos de entre 19 a 79 años con diagnóstico de enfermedad periodontal.
I: Profundidad de sondaje.
C: No aplica
O: Riesgo de HGNA, gravedad del cuadro clínico y efectos adversos.
Adicionalmente, solo se incluyeron revisiones sistemáticas con metaanálisis de estudios clínicos aleatorizados y/o observacionales, descartando cualquier otro diseño metodológico de investigación.
Fuentes de datos y búsqueda
Se realizó una búsqueda electrónica de revisiones sistemáticas entre los años 2019 a 2024 en la base de datos Medline por medio de PubMed (https://pubmed.ncbi.nlm.nih.gov/), Scopus (https://www.scopus.com/home.uri) y la Web of Science (https://clarivate.com/login/), además del metabuscador Epistemonikos (https://www.epistemonikos.org/es). La búsqueda se realizó inicialmente en marzo y se actualizó en agosto del 2024. La estrategia fue construida con base en los términos Medical Subject Headings (MeSH): “Non-alcoholic Fatty Liver Disease’’ y “Periodontitis’’ en conjunto con el operador booleano ‘’AND” de modo tal que se utilizó para todas búsquedas; ‘’Non-alcoholic Fatty Liver Disease AND Periodontitis’’ en conjunto con los filtros metodológicos; ‘’Review’’ en Scopus, ‘’Review article’’ en la Web of Science y ‘’Systematic Reviews’’ tanto en Medline/Pubmed como el metabuscador Epistemonikos.
Selección de estudios y recopilación de datos
Los títulos, resúmenes y textos completos de los artículos seleccionados fueron revisados de forma independiente por dos investigadores, siendo los desacuerdos con respecto a la inclusión de un artículo se decidió por un tercer revisor supervisor quien actuó como árbitro. El proceso de extracción y síntesis de datos se centró en la siguiente información: autor principal, título, diseño de estudio, año de publicación, población analizada, objetivo de estudio, resultados de la profundidad del sondaje, relación HGNA y enfermedad periodontal, heterogeneidad del metaanálisis y conclusiones de los estudios. Adicionalmente se contactó a los autores correspondientes si algunos datos no estaban disponibles o eran poco claros.
Evaluación de calidad metodológica
Los estudios contenidos en el presente documento fueron sometidos a evaluación de riesgo de sesgo utilizando la herramienta de evaluación metodológica denominada “Asssesing the methodological Quality of Systematic review: The development measurement Tool to assess Systematic Review-2 (AMSTAR-2)’’.(14) Esta herramienta está compuesta por 16 ítems diseñados para medir la calidad metodológica y la fiabilidad de las revisiones sistemáticas. Cada uno de estos ítems recibe una puntuación de 1 si se cumple el criterio específico, o de 0 si no se cumple, si no está claro, o si no es aplicable. Definiendo de esta forma si el artículo posee una calidad metodológica baja (≤ 8 puntos), media (≤ 12 puntos) o alta (> 12 puntos), siendo esta valoración realizada de forma independiente por dos investigadores que en caso de desacuerdos recurrieron a un tercer revisor para generar consenso.
RESULTADOS
Estrategia de Búsqueda
En la figura 1 se observa el resultado de la búsqueda electrónica, donde se recuperaron 47 registros, siendo eliminados 16 por duplicado, para que después del cribado realizado en la lectura de título y resumen se eliminaron otros 19 artículos por no considerarse relevantes para el objetivo de estudio, resultandos 12 escritos potencialmente elegibles. Los 12 artículos de interés se sometieron a una lectura a texto completo, donde se excluyeron siete revisiones por no realizar metaanálisis(4,15,16,17,18,19,20) y otros dos por no analizar el resultado de interés para esta revisión,(21,22) siendo los tres artículos restantes incluidos para su análisis cualitativo.(1,12,23) (Material complementario 1)
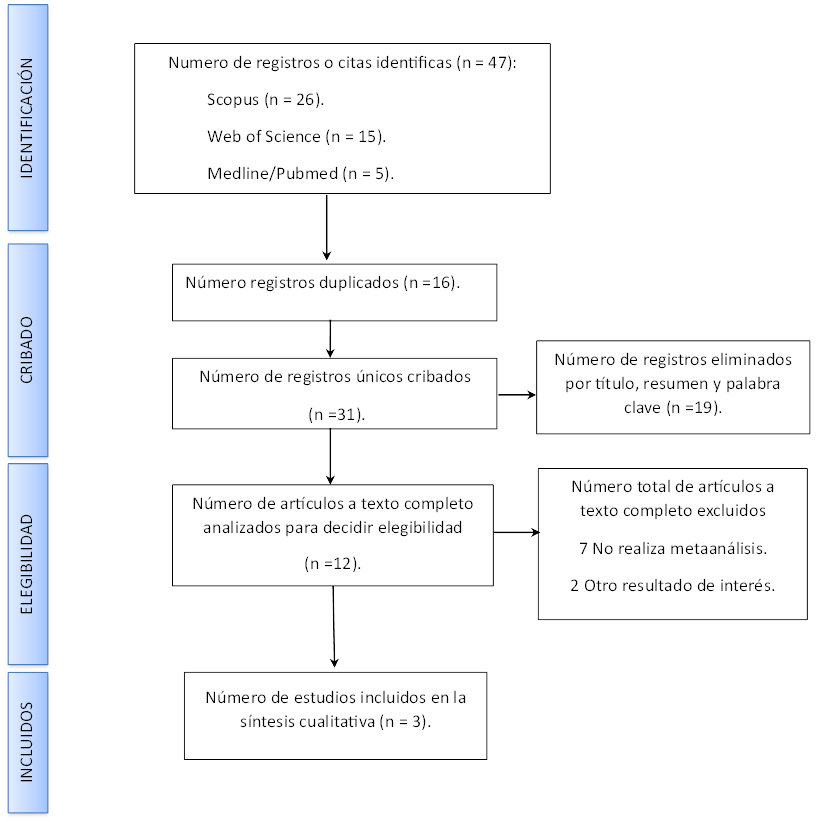
Figura 1. Flujograma de búsqueda
Resultados de interés principal
En la tabla 1 se muestran los principales hallazgos de las revisiones analizadas, donde:
Wijarnpreecha et al.(1) Luego de analizar a 27703 pacientes con un rango etario de entre 19 a 79 años, reporta una correlación entre HGNA y la enfermedad periodontal (Odds Ratio [OR] = 1,48, intervalo de confianza [IC] del 95 %: 1,15 a 1,89, p = 0,002), siendo estos hallazgos caracterizados por una alta heterogeneidad (X2 = 48 %; I2 = 98 %, p <0,001).
Xu et al.(12) Tras analizar a 192815 pacientes de entre 36 a 50 años no encontró asociación entre HGNA y la enfermedad periodontal (OR = 1,04, IC 95 :0,97 a 1,12), siendo la heterogeneidad de estos resultados considerablemente significativas (X2 = 14,3, I2 = 58 %, p = 0,03).
Aguiar et al.(23) Al observar 28152 pacientes de entre 20 a 50 años mostro una alta probabilidad de presentar enfermedad periodontal relacionada a HGNA (OR = 1,91, IC 95 %: 1,21 a 3,02), siendo la heterogeneidad de estos hallazgos alta (X2 = 80,8 %, I2 = 95 %, p <0,001).
|
Tabla 1. Características principales de las revisiones sistemáticas con metaanálisis analizadas |
|||
|
Autor principal |
Wijarnpreecha(1) |
Xu(12) |
Aguiar(23) |
|
Objetivo |
Evaluar la relación entre enfermedad periodontal e HGNA. |
Sintetizar la evidencia sobre la asociación entre enfermedad periodontal e HGNA. |
Evaluar la asociación entre el HGNA y la enfermedad periodontal. |
|
N° de pacientes analizados |
27703 |
192815 |
28152 |
|
Rango etario (años) |
19 a 79 |
36 a 50 |
20 a 50 |
|
Profundidad de sondaje (mm) |
> 3,5 a 4 |
> 3 |
>4 |
|
Relación HGNA / Enfermedad periodontal |
Odds ratio = 1,48 (IC 95 % = 1,15 a 1,89) |
Odds ratio = 1,04 (IC 95 % = 0,97 a 1,12) |
Odds ratio = 1,91 (IC 95 % = 1,21 a 3,02) |
|
Heterogeneidad |
X2 = 48,1 % I2 = 92 % p <0,001 |
X2 = 14,3 I2 = 58 % p = 0,03 |
X2 = 80,8 % I2 = 95 % p <0,001 |
|
Conclusión |
Existe una asociación significativa entre la enfermedad periodontal e HGNA, cuya asociación perdió importancia al ajustar parámetros metabólicos. |
La evidencia actual no logra demostrar un vínculo entre la periodontitis e HGNA. |
Existen pocos estudios con metodología adecuada para producir evidencia sólida sobre la relación causal entre el HGNA y la enfermedad periodontal. |
|
Fuente: Basado en los trabajos de Wijarnpreecha et al,(1) Xu et al,(12) y Aguiar et al.(23) |
|||
Evaluación metodológica
En la tabla 2 se aprecia la valoración metodológica de los tres estudios analizados según la herramienta AMSTAR-2, donde:
Los tres estudios analizados,(1,12,23) definieron claramente su pregunta de investigación y criterios de inclusión utilizando el acrónimo P.I.C.O. (ítem 1). Sin embargo, ninguno de ellos especificó una declaración explícita sobre la realización o el registro de un protocolo previo al estudio (ítem 2). Asimismo, todos los estudios justificaron adecuadamente la elección de los diseños de estudio incluidos (ítem 3).
En cuanto a la búsqueda de información, los tres estudios(1, 12, 23) utilizaron al menos dos bases de datos relevantes, siguiendo una estrategia con restricciones justificadas (ítem 4). No obstante, dos estudios(12, 23) no llevaron a cabo la selección y extracción de datos por duplicado (ítem 5 e ítem 6).
Respecto a la elegibilidad, ninguno de los artículos analizados(1,12,23) proporcionó una lista completa y justificación de los estudios evaluados por texto completo que fueron excluidos de la revisión (ítem 7). A pesar de esto, todos los estudios describieron exhaustivamente los estudios analizados y aplicaron técnicas satisfactorias para evaluar el riesgo de sesgo en los estudios incluidos en sus revisiones (ítem 8 y 9). No obstante, ninguno reporto las fuentes de financiación de los estudios analizados (ítem 10).
Todos los estudios(1,12,23) realizaron un metaanálisis utilizando métodos apropiados para la combinación estadística de los resultados (ítem 11), evaluando e interpretando adecuadamente el impacto potencial del riesgo de sesgo sobre los resultados del metaanálisis. También proporcionaron explicaciones satisfactorias sobre la heterogeneidad observada, consideraron la magnitud del sesgo de publicación, e informaron cualquier fuente potencial de conflicto de interés (ítem 12, ítem 13, ítem 14, ítem 15, ítem 16).
En general, los estudios evaluados presentan una calidad metodológica media(1,23) y alta(12), lo que sugiere un bajo riesgo de sesgo tanto para la subestimación como para la sobreestimación de sus hallazgos.
|
Tabla 2. Evaluación y valoración metodológica de los estudios incluidos |
|||||||||||||||||
|
Dimensiones AMSTAR-2 |
|||||||||||||||||
|
Autor principal |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
Total |
|
Wijarnpreecha(1) |
S |
N |
S |
S |
S |
S |
N |
S |
S |
N |
S |
S |
S |
S |
S |
S |
13 |
|
Xu (12) |
S |
N |
S |
S |
N |
N |
N |
S |
S |
N |
S |
S |
S |
S |
S |
S |
11 |
|
Aguiar (23) |
S |
N |
S |
S |
N |
N |
N |
S |
S |
N |
S |
S |
S |
S |
S |
S |
11 |
|
Fuente: Basado en AMSTAR-2.(14) |
|||||||||||||||||
DISCUSIÓN
El presente resumen de revisiones sistemáticas analizó los efectos de la enfermedad periodontal en la prevención y tratamiento del HGNA en la población adulta. Se observó una asociación entre la enfermedad periodontal y el HGNA, aunque su impacto está limitado por la alta heterogeneidad y la escasa cantidad de estudios primarios incluidos en las tres revisiones sistemáticas analizadas.(1,12,23)
La prevalencia del HGNA se estima en alrededor del 25 %, con mayores reportes en regiones como el Medio Oriente y Sudamérica, donde está fuertemente asociado con comorbilidades como la obesidad, diabetes mellitus tipo 2, hiperlipidemia, hipertensión y síndrome metabólico, lo que subraya la carga de esta enfermedad en poblaciones de alto riesgo.(5) A pesar de esto, la relación entre la enfermedad periodontal y el HGNA ha despertado un interés creciente en la comunidad científica debido a su posible impacto en la salud sistémica.(1,12,23) Estudios recientes sugieren que la inflamación sistémica atribuida tradicionalmente a marcadores proinflamatorios como el TNF-α, IL-1 e IL-6 podría desempeñar un papel significativo en la fisiopatología del HGNA, afectando en forma bidireccional a parámetros metabólicos clave comunes en comorbilidades crónicas como la enfermedad periodontal, resistencia a la insulina, dislipidemia e HGNA.(24,25,26) Por tanto, el manejo preventivo de estas patologías es un eslabón importante para la mejora de la calidad de vida a través de la adquisición de hábitos saludables como la buena higiene dental, la cual podría actuar como elemento controlador de la inflamación gingival ocasionada por el proceso fermentativo de los azúcares bucales.(27,28,29,30)
Siguiendo esta línea argumental, los resultados obtenidos de las revisiones sistemáticas analizadas muestran que, de los tres estudios incluidos en el análisis cualitativo, dos encontraron una asociación significativa entre la periodontitis y el HGNA(1,23), mientras que el tercero no logró demostrar una relación clara entre ambas condiciones.(12) Esta discrepancia puede atribuirse, en parte, a la estrecha relación entre la periodontitis y Porphyromonas gingivalis (P. gingivalis), uno de los patógenos más frecuentemente detectados en la enfermedad periodontal, especialmente cuando está vinculada al HGNA como comorbilidad.(3,6,7,15,26,31) Por otro lado, las diferencias observadas en los diseños de los estudios, las poblaciones analizadas y la heterogeneidad de las revisiones podrían reflejar una influencia multifactorial. Estas diferencias incluyen la variabilidad en las definiciones y métodos de diagnóstico de la enfermedad periodontal, así como en la gravedad del HGNA y en factores demográficos y geográficos que no fueron controlados de manera uniforme. Además, la inclusión de estudios con diferentes metodologías y la falta de uniformidad en la medición de resultados clínicos podrían haber contribuido a la variabilidad observada.(1,12,23) Esto subraya la necesidad de criterios de elegibilidad más rígidos y uniformes para futuros estudios, que puedan reducir la sobrestimación o subestimación del impacto de factores como la higiene dental deficiente y otros hábitos no saludables.
Desde una perspectiva clínica, la relación entre la enfermedad periodontal y el HGNA podría tener implicaciones importantes para la práctica diaria. Integrar el manejo de la periodontitis con estrategias de tratamiento para el HGNA podría mejorar los resultados en pacientes con ambas condiciones.(1,2,4,12,15,16,17,18,19,20,23) Las estrategias terapéuticas y preventivas actuales, como la promoción de la higiene dental y el control de factores de riesgo metabólicos, podrían ser ajustadas para abordar ambas condiciones simultáneamente, potencialmente reduciendo la carga de ambas enfermedades en la población.
En términos de futuras investigaciones, es crucial que los estudios exploren no solo la correlación entre estas dos condiciones, sino también los mecanismos subyacentes que podrían estar involucrados, como la alteración del microbioma oral y su impacto en el eje oral-gut-liver, una hipótesis emergente que podría ofrecer nuevas perspectivas en el manejo integral de ambas condiciones.(1,3) Además, se recomienda la realización de estudios longitudinales que sigan a pacientes con periodontitis y HGNA a lo largo del tiempo para evaluar la progresión de ambas condiciones y la eficacia de intervenciones integradas.
La calidad metodológica de los estudios revisados, evaluada con la herramienta AMSTAR-2, varía de media a alta, lo que sugiere que, a pesar de las limitaciones ya mencionadas, los resultados de estos estudios son relativamente confiables.(1,12,23) No obstante, es crucial que futuras investigaciones consideren el control riguroso de posibles factores de confusión y utilicen diseños de estudio más robustos para clarificar la relación causal entre la enfermedad periodontal y el HGNA.
Finalmente, la naturaleza inflamatoria crónica de la periodontitis podría actuar como un factor desencadenante de inflamación sistémica, contribuyendo a la progresión del HGNA. Las implicaciones para la salud pública de estos hallazgos son significativas; las políticas de salud pública podrían considerar la integración de estrategias de prevención y manejo que aborden tanto la enfermedad periodontal como el HGNA.
CONCLUSIONES
La evidencia actual sugiere una posible relación entre la enfermedad periodontal y el HGNA, indicando que la inflamación sistémica y los marcadores proinflamatorios podrían desempeñar un papel crucial en la fisiopatología de ambas condiciones. Sin embargo, la escasez de estudios incluidos y su alta heterogeneidad subrayan la necesidad de investigaciones adicionales más robustas que exploren a fondo esta relación, considerando los diversos parámetros metabólicos que son comunes a ambas patologías, cuya compresión es fundamental para el desarrollo de estrategias de manejo integradas que aborden de manera efectiva tanto la periodontitis como el HGNA.
REFERENCIAS BIBLIOGRÁFICAS
1. Wijarnpreecha K, Panjawatanan P, Cheungpasitporn W, et al. The Association between Periodontitis and Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-analysis. J Gastrointestin Liver Dis. 2020;29(2):211-217. doi:10.15403/jgld-841.
2. Shin H-S. Association between periodontal status and non-alcoholic fatty liver disease in a Korean adult population: A nationwide cross-sectional study. J Periodontol. 2020;91:524–532. https://doi.org/10.1002/JPER.19-0291
3. Yoneda M, Kobayashi T, Iwaki M, Nogami A, Saito S, Nakajima A. Nonalcoholic Fatty Liver Disease as a Systemic Disease and the Need for Multidisciplinary Care. Gut Liver. 2023;17(6):843-852. doi:10.5009/gnl220545
4. Kuraji R, Sekino S, Kapila Y, Numabe Y. Periodontal disease-related nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: An emerging concept of oral-liver axis. Periodontol 2000. 2021;87(1):204-240. doi:10.1111/prd.12387
5. Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73-84. doi:10.1002/hep.28431
6. Akinkugbe AA, Barritt AS, Cai J, et al. Periodontitis and prevalence of elevated aminotransferases in the Hispanic Community Health Study/Study of Latinos. J Periodontol. 2018;89(8):949-958. doi:10.1002/JPER.17-0579
7. Caetano VDS, de Andrade RSB, França LFC, et al. Food restriction reduces hepatic alterations associated with experimental periodontitis. J Periodontol. 2022;93(1):156-165. doi:10.1002/JPER.20-0772
8. Yao C, Lan D, Li X, Wang Y, Qi S. Porphyromonas gingivalis triggers inflammation in hepatocyte depend on ferroptosis via activating the NF-κB signaling pathway. Oral Dis. 2024;30(3):1680-1694. doi:10.1111/odi.14537
9. Nagasaki A, Sakamoto S, Arai T, et al. Elimination of Porphyromonas gingivalis inhibits liver fibrosis and inflammation in NASH. J Clin Periodontol. 2021;48(10):1367-1378. doi:10.1111/jcpe.13523
10. Liu L, Geng Y, Xiong C. Impact of Porphyromonas gingivalis-odontogenic infection on the pathogenesis of non-alcoholic fatty liver disease. Ann Med. 2023;55(2):2255825. doi:10.1080/07853890.2023.2255825
11. Kuraji R, Shiba T, Dong TS, Numabe Y, Kapila YL. Periodontal treatment and microbiome-targeted therapy in management of periodontitis-related nonalcoholic fatty liver disease with oral and gut dysbiosis. World J Gastroenterol. 2023;29(6):967-996. doi:10.3748/wjg.v29.i6.967
12. Xu F, Tang J. Is There An Association Between Periodontitis And Non-Alcoholic Fatty Liver Disease? A Systematic Review and Meta-Analysis. Community Dent Health. 2023;40(1):47-52. doi:10.1922/CDH_00180Xu06
13. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372:n71. Disponible en: https://doi.org/10.1136/bmj.n71.
14. Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR-2: herramienta de evaluación crítica de revisiones sistemáticas de estudios de intervenciones de salud. BMJ. 2017;358:j4008.
15. Alakhali MS, Al-Maweri SA, Al-Shamiri HM, Al-Haddad K, Halboub E. The potential association between periodontitis and non-alcoholic fatty liver disease: a systematic review. Clin Oral Investig. 2018;22(9):2965-2974. doi:10.1007/s00784-018-2726-1
16. Thalla S, R K, A K. Increasing Risk Factors for Non-Alcoholic Fatty Liver Disease; an Insight into Chronic Periodontitis and Insulin Resistance. Endocr Metab Immune Disord Drug Targets. 2022;22(8):807-814. doi:10.2174/1871530322666220104095534
17. Kobayashi T, Iwaki M, Nogami A, et al. Involvement of Periodontal Disease in the Pathogenesis and Exacerbation of Nonalcoholic Fatty Liver Disease/Nonalcoholic Steatohepatitis: A Review. Nutrients. 2023;15(5):1269. doi:10.3390/nu15051269
18. Kuraji R, Shiba T, Dong TS, Numabe Y, Kapila YL. Periodontal treatment and microbiome-targeted therapy in management of periodontitis-related nonalcoholic fatty liver disease with oral and gut dysbiosis. World J Gastroenterol. 2023;29(6):967-996. doi:10.3748/wjg.v29.i6.967
19. Hatasa M, Yoshida S, Takahashi H, et al. Relationship between NAFLD and Periodontal Disease from the View of Clinical and Basic Research, and Immunological Response. Int J Mol Sci. 2021;22(7):3728. doi:10.3390/ijms22073728
20. Liu L, Geng Y, Xiong C. Impact of Porphyromonas gingivalis-odontogenic infection on the pathogenesis of non-alcoholic fatty liver disease. Ann Med. 2023;55(2):2255825. doi:10.1080/07853890.2023.2255825
21. Mei EH, Yao C, Chen YN, Nan SX, Qi SC. Multifunctional role of oral bacteria in the progression of non-alcoholic fatty liver disease. World J Hepatol. 2024;16(5):688-702. doi:10.4254/wjh.v16.i5.688
22. Albuquerque-Souza E, Sahingur SE. Periodontitis, chronic liver diseases, and the emerging oral-gut-liver axis. Periodontol 2000. 2022;89(1):125-141. doi:10.1111/prd.12427
23. Aguiar ILS, Santos-Lins LS, Brasil-Oliveira R, Cotrim HP, Lins-Kusterer L. Non-alcoholic fatty liver disease and periodontal disease: A systematic review and meta-analysis of cross-sectional studies. Arab J Gastroenterol. 2023;24(4):198-203. doi:10.1016/j.ajg.2023.09.005
24. Reis C, DA Costa AV, Guimarães JT, et al. Clinical improvement following therapy for periodontitis: Association with a decrease in IL-1 and IL-6. Exp Ther Med. 2014;8(1):323-327. doi:10.3892/etm.2014.1724
25. Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015;15(1):30-44. doi:10.1038/nri3785
26. Kim JY, Park YM, Lee GN, et al. Association between toothbrushing and non-alcoholic fatty liver disease. PLoS One. 2021;16(5):e0243686. doi:10.1371/journal.pone.0243686
27. Cardoso EM, Reis C, Manzanares-Céspedes MC. Chronic periodontitis, inflammatory cytokines, and interrelationship with other chronic diseases. Postgrad Med. 2018;130(1):98-104. doi:10.1080/00325481.2018.1396876
28. Butt K, Butt R, Sharma P. The burden of periodontal disease. Dental Update. 2019;46(10):907–13
29. Manuzza MA, Brito G, Echegaray NS, López LB. Glycemic index and glycemic load: their value in treatment and prevention of noncommunicable chronic diseases. Diaeta. 2018;36(162):29-38.
30. Orlandi M, Muñoz Aguilera E, Marletta D, Petrie A, Suvan J, D’Aiuto F. Impact of the treatment of periodontitis on systemic health and quality of life: A systematic review. J Clin Periodontol. 2022;49 Suppl 24:314-327. doi:10.1111/jcpe.13554
31. Kim JY, Lee GN, Song HC, Park YM, Ahn YB, Han K, et al. Association between Fatty Liver Index and Periodontitis: the Korea National Health and Nutrition Examination Survey. Sci Rep. 2020;10(1):3805.
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Denisse Sepúlveda-Toro y Najarett Galaz-Cáceres.
Curación de datos: Héctor Fuentes-Barría.
Análisis formal: Héctor Fuentes-Barría y Blanca Klahn-Acuña.
Investigación: Denisse Sepúlveda-Toro, Najarett Galaz-Cáceres, Blanca Klahn-Acuña y Héctor Fuentes-Barría.
Metodología: Héctor Fuentes-Barría y Raúl Aguilera-Eguía.
Administración del proyecto: Blanca Klahn-Acuña y Héctor Fuentes-Barría.
Recursos: Héctor Fuentes-Barría, Miguel Alarcón-Rivera
Software: Héctor Fuentes-Barría, Miguel Alarcón-Rivera
Supervisión: Héctor Fuentes-Barría y Blanca Klahn-Acuña.
Validación: Raúl Aguilera-Eguía y Miguel Alarcón-Rivera.
Visualización: Raúl Aguilera-Eguía, Miguel Alarcón-Rivera.
Redacción – borrador original: Héctor Fuentes-Barría, Blanca Klahn-Acuña, Raúl Aguilera-Eguía, Miguel Alarcón-Rivera.
Redacción – revisión y edición: Héctor Fuentes-Barría, Blanca Klahn-Acuña, Raúl Aguilera-Eguía, Miguel Alarcón-Rivera.
MATERIAL COMPLEMENTARIO 1
Número de registros únicos cribados
1. Simpson TC, Clarkson JE, Worthington HV, et al. Treatment of periodontitis for glycaemic control in people with diabetes mellitus. Cochrane Database Syst Rev. 2022;4(4):CD004714. doi:10.1002/14651858.CD004714.pub4
2. Tomeno W, Imajo K, Takayanagi T, et al. Complications of Non-Alcoholic Fatty Liver Disease in Extrahepatic Organs. Diagnostics (Basel). 2020;10(11):912. doi:10.3390/diagnostics10110912
3. Krznarić J, Vince A. The Role of Non-Alcoholic Fatty Liver Disease in Infections. Life (Basel). 2022;12(12):2052. doi:10.3390/life12122052
4. Boeckmans J, Rombaut M, Demuyser T, Declerck B, Piérard D, Rogiers V, De Kock J, Waumans L, Magerman K, Cartuyvels R, Rummens JL, Rodrigues RM, Vanhaecke T. Infections at the nexus of metabolic-associated fatty liver disease. Arch Toxicol. 2021;95(7):2235-2253. doi: 10.1007/s00204-021-03069-1.
5. Sun Y, Yin Y, Yang S, Ai D, Qin H, Xia X, Xu X, Song J. Lipotoxicity: The missing link between diabetes and periodontitis? J Periodontal Res. 2024;59(3):431-445. doi: 10.1111/jre.13242.
6. Li C, Yu R, Ding Y. Association between Porphyromonas Gingivalis and systemic diseases: Focus on T cells-mediated adaptive immunity. Front Cell Infect Microbiol. 2022;12:1026457. doi: 10.3389/fcimb.2022.1026457.
7. Mady M, ALOtaibi RA, ALJohani RA, Almutair SH, Msaud JM, AlBarakati JA, et al. The Effect of Periodontal Disease on Quality of Life: Literature Review. Ann Dent Spec. 2022;10(2):124-6. https://doi.org/10.51847/LyO7bISMil
8. Korbecki J, Szatkowska I, Kupnicka P, Żwierełło W, Barczak K, Poziomkowska-Gęsicka I, Wójcik J, Chlubek D, Baranowska-Bosiacka I. The Importance of CXCL1 in the Physiological State and in Noncancer Diseases of the Oral Cavity and Abdominal Organs. Int J Mol Sci. 2022;23(13):7151. doi: 10.3390/ijms23137151.
9. Zenobia C, Darveau RP. Does Oral Endotoxin Contribute to Systemic Inflammation?. Front Oral Health. 2022;3:911420. doi:10.3389/froh.2022.911420
10.Eiser AR. Environmental, Metabolic, and Nutritional Factors Concerning Dementia in African American and Hispanic American Populations. Am J Med. 2024:S0002-9343(24)00402-9. doi: 10.1016/j.amjmed.2024.06.023.
11.Tan J, Taitz J, Nanan R, Grau G, Macia L. Dysbiotic Gut Microbiota-Derived Metabolites and Their Role in Non-Communicable Diseases. Int J Mol Sci. 2023;24(20):15256. doi: 10.3390/ijms242015256.
12.Chen RX, Zheng LC, Li LL, Li Y, Yan FH. Mechanism of obesity affecting periodontal tissue regeneration and therapeutic strategies. Zhonghua Kou Qiang Yi Xue Za Zhi. 2023;58(7):688-693. Chinese. doi: 10.3760/cma.j.cn112144-20230318-00097
13.Yoneda M, Kobayashi T, Iwaki M, Nogami A, Saito S, Nakajima A. Nonalcoholic Fatty Liver Disease as a Systemic Disease and the Need for Multidisciplinary Care. Gut Liver. 2023;17(6):843-852. doi: 10.5009/gnl220545.
14.Vella S, Petrie J R. Macrovascular disease: pathogenesis and risk assessment. Medicine (United Kingdom). 2022; 50(11): 683 – 690. doi:10.1016/j.mpmed.2022.08.014
15.Ezhilarasan D. Deciphering the toxicological role of Porphyromonas gingivalis derived endotoxins in liver diseases. Environ Toxicol Pharmacol. 2021:103755. doi: 10.1016/j.etap.2021.103755.
16.Lei Y, Li S, He M, Ao Z, Wang J, Wu Q, Wang Q. Oral Pathogenic Bacteria and the Oral-Gut-Liver Axis: A New Understanding of Chronic Liver Diseases. Diagnostics (Basel). 2023;13(21):3324. doi: 10.3390/diagnostics13213324.
17.Mainas G, Nibali L, Ide M, Mahmeed WA, Al-Rasadi K, Al-Alawi K, Banach M, Banerjee Y, Ceriello A, Cesur M, Cosentino F, Firenze A, Galia M, Goh SY, Janež A, Kalra S, Kapoor N, Kempler P, Lessan N, Lotufo P, Papanas N, Rizvi AA, Sahebkar A, Santos RD, Stoian AP, Toth PP, Viswanathan V, Rizzo M; CArdiometabolic Panel of International Experts on Syndemic COVID-19 (CAPISCO). Associations between Periodontitis, COVID-19, and Cardiometabolic Complications: Molecular Mechanisms and Clinical Evidence. Metabolites. 2022 Dec 26;13(1):40. doi: 10.3390/metabo13010040.
18.Baima, G., Ribaldone, D.G., Muwalla, M. et al. Can Periodontitis Affect the Health and Disease of the Digestive System? A Comprehensive Review of Epidemiological Evidence and Biological Mechanisms. Current Oral Health Reports. 2021. 8, 96–106. doi: 10.1007/s40496-021-00302-9
19.Rosato V, Masarone M, Dallio M, Federico A, Aglitti A, Persico M. NAFLD and Extra-Hepatic Comorbidities: Current Evidence on a Multi-Organ Metabolic Syndrome. Int J Environ Res Public Health. 2019;16(18):3415.. doi:10.3390/ijerph16183415
20.Aguiar ILS, Santos-Lins LS, Brasil-Oliveira R, Cotrim HP, Lins-Kusterer L. Non-alcoholic fatty liver disease and periodontal disease: A systematic review and meta-analysis of cross-sectional studies. Arab J Gastroenterol. 2023;24(4):198-203. doi: 10.1016/j.ajg.2023.09.005.
21.Xu F, Tang J. Is There An Association Between Periodontitis And Non-Alcoholic Fatty Liver Disease? A Systematic Review and Meta-Analysis. Community Dent Health. 2023 Feb 28;40(1):47-52. doi: 10.1922/CDH_00180Xu06.
22.Alakhali MS, Al-Maweri SA, Al-Shamiri HM, Al-Haddad K, Halboub E. The potential association between periodontitis and non-alcoholic fatty liver disease: a systematic review. Clin Oral Investig. 2018;22(9):2965-2974. doi: 10.1007/s00784-018-2726-1.
23.Wijarnpreecha K, Panjawatanan P, Cheungpasitporn W, Lukens FJ, Harnois DM, Pungpapong S, Ungprasert P. The Association between Periodontitis and Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-analysis. J Gastrointestin Liver Dis. 2020 ;29(2):211-217. doi: 10.15403/jgld-841.
24.Mei EH, Yao C, Chen YN, Nan SX, Qi SC. Multifunctional role of oral bacteria in the progression of non-alcoholic fatty liver disease. World J Hepatol. 2024;16(5):688-702. doi:10.4254/wjh.v16.i5.688
25.Liu L, Geng Y, Xiong C. Impact of Porphyromonas gingivalis-odontogenic infection on the pathogenesis of non-alcoholic fatty liver disease. Ann Med. 2023;55(2):2255825. doi: 10.1080/07853890.2023.2255825.
26.Thalla S, R K, A K. Increasing Risk Factors for Non-Alcoholic Fatty Liver Disease; an Insight into Chronic Periodontitis and Insulin Resistance. Endocr Metab Immune Disord Drug Targets. 2022;22(8):807-814. doi: 10.2174/1871530322666220104095534.
27.Kobayashi T, Iwaki M, Nogami A, et al. Involvement of Periodontal Disease in the Pathogenesis and Exacerbation of Nonalcoholic Fatty Liver Disease/Nonalcoholic Steatohepatitis: A Review. Nutrients. 2023;15(5):1269. doi:10.3390/nu15051269
28.Kuraji R, Shiba T, Dong TS, Numabe Y, Kapila YL. Periodontal treatment and microbiome-targeted therapy in management of periodontitis-related nonalcoholic fatty liver disease with oral and gut dysbiosis. World J Gastroenterol. 2023;29(6):967-996. doi: 10.3748/wjg.v29.i6.967.
29.Albuquerque-Souza E, Sahingur SE. Periodontitis, chronic liver diseases, and the emerging oral-gut-liver axis. Periodontol 2000. 2022;89(1):125-141. doi: 10.1111/prd.12427.
30.Kuraji R, Sekino S, Kapila Y, Numabe Y. Periodontal disease-related nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: An emerging concept of oral-liver axis. Periodontol 2000. 2021;87(1):204-240. doi: 10.1111/prd.12387.
31.Hatasa M, Yoshida S, Takahashi H, et al. Relationship between NAFLD and Periodontal Disease from the View of Clinical and Basic Research, and Immunological Response. Int J Mol Sci. 2021;22(7):3728. Published 2021 Apr 2. doi:10.3390/ijms22073728
Número total de registros eliminados por título, resumen y palabras clave
1. Simpson TC, Clarkson JE, Worthington HV, et al. Treatment of periodontitis for glycaemic control in people with diabetes mellitus. Cochrane Database Syst Rev. 2022;4(4):CD004714. doi:10.1002/14651858.CD004714. (No aborda NAFLD ni la asociación con la enfermedad periodontal).
2. Tomeno W, Imajo K, Takayanagi T, et al. Complications of Non-Alcoholic Fatty Liver Disease in Extrahepatic Organs. Diagnostics (Basel). 2020;10(11):912. doi:10.3390/diagnostics10110912 (Aunque se refiere a NAFLD, no menciona la enfermedad periodontal).
3. Krznarić J, Vince A. The Role of Non-Alcoholic Fatty Liver Disease in Infections. Life (Basel). 2022;12(12):2052. doi:10.3390/life12122052 (No menciona la enfermedad periodontal).
4. Boeckmans J, Rombaut M, Demuyser T, Declerck B, Piérard D, Rogiers V, De Kock J, Waumans L, Magerman K, Cartuyvels R, Rummens JL, Rodrigues RM, Vanhaecke T. Infections at the nexus of metabolic-associated fatty liver disease. Arch Toxicol. 2021;95(7):2235-2253. doi: 10.1007/s00204-021-03069-1. (No menciona la enfermedad periodontal).
5. Sun Y, Yin Y, Yang S, Ai D, Qin H, Xia X, Xu X, Song J. Lipotoxicity: The missing link between diabetes and periodontitis? J Periodontal Res. 2024;59(3):431-445. doi: 10.1111/jre.13242. (No aborda NAFLD).
6. Li C, Yu R, Ding Y. Association between Porphyromonas Gingivalis and systemic diseases: Focus on T cells-mediated adaptive immunity. Front Cell Infect Microbiol. 2022;12:1026457. doi: 10.3389/fcimb.2022.1026457. (No aborda NAFLD).
7. Mady M, ALOtaibi RA, ALJohani RA, Almutair SH, Msaud JM, AlBarakati JA, et al. The Effect of Periodontal Disease on Quality of Life: Literature Review. Ann Dent Spec. 2022;10(2):124-6. https://doi.org/10.51847/LyO7bISMil. (No menciona NAFLD).
8. Korbecki J, Szatkowska I, Kupnicka P, Żwierełło W, Barczak K, Poziomkowska-Gęsicka I, Wójcik J, Chlubek D, Baranowska-Bosiacka I. The Importance of CXCL1 in the Physiological State and in Noncancer Diseases of the Oral Cavity and Abdominal Organs. Int J Mol Sci. 2022;23(13):7151. doi: 10.3390/ijms23137151. (No menciona la asociación con NAFLD).
9. Zenobia C, Darveau RP. Does Oral Endotoxin Contribute to Systemic Inflammation?. Front Oral Health. 2022;3:911420. doi:10.3389/froh.2022.911420 (No específico para NAFLD y enfermedad periodontal).
10.Eiser AR. Environmental, Metabolic, and Nutritional Factors Concerning Dementia in African American and Hispanic American Populations. Am J Med. 2024:S0002-9343(24)00402-9. doi: 10.1016/j.amjmed.2024.06.023. (No relevante para NAFLD ni enfermedad periodontal).
11.Tan J, Taitz J, Nanan R, Grau G, Macia L. Dysbiotic Gut Microbiota-Derived Metabolites and Their Role in Non-Communicable Diseases. Int J Mol Sci. 2023;24(20):15256. doi: 10.3390/ijms242015256. (No específico para NAFLD y enfermedad periodontal).
12.Chen RX, Zheng LC, Li LL, Li Y, Yan FH. Mechanism of obesity affecting periodontal tissue regeneration and therapeutic strategies. Zhonghua Kou Qiang Yi Xue Za Zhi. 2023;58(7):688-693. Chinese. doi: 10.3760/cma.j.cn112144-20230318-00097 (No aborda NAFLD).
13.Yoneda M, Kobayashi T, Iwaki M, Nogami A, Saito S, Nakajima A. Nonalcoholic Fatty Liver Disease as a Systemic Disease and the Need for Multidisciplinary Care. Gut Liver. 2023;17(6):843-852. doi: 10.5009/gnl220545. (No menciona enfermedad periodontal).
14.Vella S, Petrie J R. Macrovascular disease: pathogenesis and risk assessment. Medicine (United Kingdom). 2022; 50(11): 683 – 690. doi:10.1016/j.mpmed.2022.08.014 (No aborda la asociación específica con NAFLD y enfermedad periodontal).
15.Ezhilarasan D. Deciphering the toxicological role of Porphyromonas gingivalis derived endotoxins in liver diseases. Environ Toxicol Pharmacol. 2021:103755. doi: 10.1016/j.etap.2021.103755. (No específico para NAFLD y enfermedad periodontal).
16.Lei Y, Li S, He M, Ao Z, Wang J, Wu Q, Wang Q. Oral Pathogenic Bacteria and the Oral-Gut-Liver Axis: A New Understanding of Chronic Liver Diseases. Diagnostics (Basel). 2023;13(21):3324. doi: 10.3390/diagnostics13213324. (Aunque relacionado, no es específico para NAFLD y enfermedad periodontal).
17.Mainas G, Nibali L, Ide M, Mahmeed WA, Al-Rasadi K, Al-Alawi K, Banach M, Banerjee Y, Ceriello A, Cesur M, Cosentino F, Firenze A, Galia M, Goh SY, Janež A, Kalra S, Kapoor N, Kempler P, Lessan N, Lotufo P, Papanas N, Rizvi AA, Sahebkar A, Santos RD, Stoian AP, Toth PP, Viswanathan V, Rizzo M; CArdiometabolic Panel of International Experts on Syndemic COVID-19 (CAPISCO). Associations between Periodontitis, COVID-19, and Cardiometabolic Complications: Molecular Mechanisms and Clinical Evidence. Metabolites. 2022;13(1):40. doi: 10.3390/metabo13010040. (No aborda NAFLD).
18.Baima, G., Ribaldone, D.G., Muwalla, M. et al. Can Periodontitis Affect the Health and Disease of the Digestive System? A Comprehensive Review of Epidemiological Evidence and Biological Mechanisms. Current Oral Health Reports. 2021. 8, 96–106. doi: 10.1007/s40496-021-00302-9 (No aborda específicamente NAFLD).
19.Rosato V, Masarone M, Dallio M, Federico A, Aglitti A, Persico M. NAFLD and Extra-Hepatic Comorbidities: Current Evidence on a Multi-Organ Metabolic Syndrome. Int J Environ Res Public Health. 2019;16(18):3415.. doi:10.3390/ijerph16183415 (No menciona la enfermedad periodontal).
Número total de artículos a texto completo excluidos y su razón:
1. Alakhali MS, Al-Maweri SA, Al-Shamiri HM, Al-Haddad K, Halboub E. The potential association between periodontitis and non-alcoholic fatty liver disease: a systematic review. Clin Oral Investig. 2018;22(9):2965-2974. doi: 10.1007/s00784-018-2726-1. (No realiza metaanálisis).
2. Thalla S, R K, A K. Increasing Risk Factors for Non-Alcoholic Fatty Liver Disease; an Insight into Chronic Periodontitis and Insulin Resistance. Endocr Metab Immune Disord Drug Targets. 2022;22(8):807-814. doi: 10.2174/1871530322666220104095534. (No realiza metaanálisis).
3. Kobayashi T, Iwaki M, Nogami A, et al. Involvement of Periodontal Disease in the Pathogenesis and Exacerbation of Nonalcoholic Fatty Liver Disease/Nonalcoholic Steatohepatitis: A Review. Nutrients. 2023;15(5):1269. doi:10.3390/nu15051269 (No realiza metaanálisis).
4. Kuraji R, Shiba T, Dong TS, Numabe Y, Kapila YL. Periodontal treatment and microbiome-targeted therapy in management of periodontitis-related nonalcoholic fatty liver disease with oral and gut dysbiosis. World J Gastroenterol. 2023;29(6):967-996. doi: 10.3748/wjg.v29.i6.967. (No realiza metaanálisis).
5. Kuraji R, Sekino S, Kapila Y, Numabe Y. Periodontal disease-related nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: An emerging concept of oral-liver axis. Periodontol 2000. 2021;87(1):204-240. doi:10.1111/prd.12387 (No realiza metaanálisis).
6. Hatasa M, Yoshida S, Takahashi H, et al. Relationship between NAFLD and Periodontal Disease from the View of Clinical and Basic Research, and Immunological Response. Int J Mol Sci. 2021;22(7):3728. doi:10.3390/ijms22073728 (No realiza metaanálisis).
7. Liu L, Geng Y, Xiong C. Impact of Porphyromonas gingivalis-odontogenic infection on the pathogenesis of non-alcoholic fatty liver disease. Ann Med. 2023;55(2):2255825. doi: 10.1080/07853890.2023.2255825 (Aunque relacionado, no es específico para enfermedad periodontal, además, tampoco realiza metaanálisis).
8. Mei EH, Yao C, Chen YN, Nan SX, Qi SC. Multifunctional role of oral bacteria in the progression of non-alcoholic fatty liver disease. World J Hepatol. 2024;16(5):688-702. doi:10.4254/wjh.v16.i5.688 (Aunque relacionado, no es específico para enfermedad periodontal).
9. Albuquerque-Souza E, Sahingur SE. Periodontitis, chronic liver diseases, and the emerging oral-gut-liver axis. Periodontol 2000. 2022 Jun;89(1):125-141. doi: 10.1111/prd.12427. (Aunque relacionado, no es específico para NAFLD).
Número de artículos a texto completo incluidos en la síntesis cualitativa
1. Wijarnpreecha K, Panjawatanan P, Cheungpasitporn W, et al. The Association between Periodontitis and Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-analysis. J Gastrointestin Liver Dis. 2020;29(2):211-217. doi:10.15403/jgld-841.
2. Xu F, Tang J. Is There An Association Between Periodontitis And Non-Alcoholic Fatty Liver Disease? A Systematic Review and Meta-Analysis. Community Dent Health. 2023;40(1):47-52. doi:10.1922/CDH_00180Xu06
3. Aguiar ILS, Santos-Lins LS, Brasil-Oliveira R, Cotrim HP, Lins-Kusterer L. Non-alcoholic fatty liver disease and periodontal disease: A systematic review and meta-analysis of cross-sectional studies. Arab J Gastroenterol. 2023;24(4):198-203. doi:10.1016/j.ajg.2023.09.005