ARTÍCULO ORIGINAL
Primer reporte de Coccidiosis renal fatal en un Biguá (Phalacrocorax brasilianus) en coinfección con nematodes de Argentina
First report of fatal renal coccidiosis in a Biguá (Phalacrocorax brasilianus) in coinfection with nematodes from Argentina
Sergio Ivan Garijo1 ![]() *, María Cecilia Netri1
*, María Cecilia Netri1 ![]() *, Javier Origlia1
*, Javier Origlia1 ![]() *, Nancy Arias1
*, Nancy Arias1 ![]() *, Hugo Lopez Faray1
*, Hugo Lopez Faray1 ![]() *, Norberto Fabian Lopez1
*, Norberto Fabian Lopez1
![]() *, Maria Florencia
Unzaga1
*, Maria Florencia
Unzaga1![]() *, Miguel Victor Piscopo1
*, Miguel Victor Piscopo1![]() *
*
1Universidad Nacional de La Plata, Facultad de Ciencias Veterinarias, Catedra de Patología de Aves y Pilíferos. Buenos Aires, Argentina.
Citar como: Garijo SI, Netri MC, Origlia J, Arias N, Lopez Faray H, Lopez NF, Unzaga MF, Piscopo MV. Primer reporte de Coccidiosis renal fatal en un Biguá (Phalacrocorax brasilianus) en coinfección con nematodes de Argentina. Salud Cienc. Tecnol. 2022;2:181. https://doi.org/10.56294/saludcyt2022181
Enviado: 27-11-2022 Revisado: 16-12-2022 Aceptado: 28-12-2022 Publicado: 29-12-2022
Editor: Lic.
Mabel Cecilia Bonardi ![]()
RESUMEN
Un espécimen de biguá (Phalacrocorax brasilianus) estando bajo condiciones de manejo clínico, luego de ser rescatado en estado de debilidad, experimentó una marcada mejoría general para luego sufrir un cambio abrupto hacia una evolución desfavorable hasta desenlace fatal en el curso de pocas horas debido a una falla renal aguda. El análisis de resultados de los estudios clínicos y de los hallazgos histopatológicos post mortem demostraron la presencia de una gran carga de nematodes gastrointestinales y de severa afección renal por Eimeriorinos. Estos últimos resultaron ser los causales de un extensivo daño renal suficiente para causar la falla renal aguda y considerarse la causa primaria de muerte. A lo largo de este trabajo se obtuvo una visión general de la patogenia y manifestaciones clínicas de la coccidiosis renal aviar, escasamente documentadas anteriormente. Este hallazgo coccidial nunca antes reportado en esta especie implica una alta probabilidad de registro de una nueva especie de Eimeria.
Palabras clave: Phalacrocorax (Nannopterum) Brasilianus; Parásitos Aviares; Coccidiosis Renal; Nematodes.
ABSTRACT
After being rescued from a state of weakness, a biguá (Phalacrocorax brasilianus) specimen under clinical management conditions underwent a remarkable general improvement before abruptly deteriorating until dying within a few hours as a result of acute renal failure. Clinical analysis and post-mortem histopathological findings demonstrated the presence of a large burden of gastrointestinal nematodes and severe renal involvement by Eimeriorina representatives. These latter were found to be the cause of extensive kidney damage sufficient to cause acute renal failure and to be considered the primary cause of death. Throughout this work, we obtained an overview of the pathogenesis and clinical manifestations of avian renal coccidiosis, which had been poorly documented previously. This coccidial finding, never before reported in this species, implies a high probability of recording a new species of Eimeria.
Keywords: Phalacrocorax (Nannopterum) Brasilianus; Avian Parasites; Renal Coccidiosis; Nematodes.
INTRODUCCIÓN
El Biguá o Cormorán neotropical, Phalacrocorax brasilianus (Gmelin, 1789) (Nannopterum brasilianus, Kennedy-Spencer 2014) (Suliformes: Phalacrocoracidae) es un ave costera ampliamente distribuida en el continente americano desde el sur de Estados Unidos hasta Tierra del Fuego en Argentina.(1)
Sus poblaciones son consideradas residentes, ya que no se desplazan a grandes distancias, y debido a su dieta básicamente piscívora es inusual encontrarlos lejos de cuerpos de agua.(1,2)
Es un ave frecuentemente observada en ríos, lagunas y humedales, así como también en la costa marítima tanto en Buenos Aires como en el resto de Sudamérica.(3,4)
Sin embargo, se ha publicado poca y aislada información sobre las parasitosis en esta especie, y estos escasos trabajos refieren fundamentalmente a parásitos metazoarios.(5,6,7) De esta manera, hasta hoy permanece un insuficiente nivel de conocimientos acerca de los protozoos parásitos de estas aves.
Las coccidiosis entéricas producidas por Eimerias e Isosporas están entre las más comunes afecciones protozoáricas de la avifauna silvestre y doméstica. Sin embargo, el desarrollo de estos coccidianos en localizaciones extraintestinales y distintas del sistema reticuloendotelial o leucocitos en sangre circulante solo se ha documentado con especies del género Eimeria. Estos reportes de Eiméridos en localizaciones extraintestinales se relacionan principalmente con Anseriformes y otros hospedadores aviares silvestres de entornos acuáticos(8,9,10,11,12,13) con solo algunas excepciones.(14) Más aún, debido a que la mayoría de reportes de estas parasitosis en avifauna silvestre se basan en especímenes encontrados muertos, son aún más escasos los detalles sobre la signología durante el curso del cuadro clínico.
En el presente trabajo se describen tanto la evolución clínica como los hallazgos post mortem en un biguá silvestre naturalmente infectado por coccidiosis renal y nematodes.
MÉTODOS
Un ejemplar de Phalacrocorax brasilianus (Kennedy-Spencer 2014) fue encontrado por rescatistas en plena zona urbana, en el partido de Lanús, Provincia de Buenos Aires (34°42′S, 58°24′O) a una distancia aproximada de al menos 6 km del área costera más cercana en Octubre 2019.
Su estado de debilidad permitió ser capturado y trasladado por los rescatistas hasta el centro de atención. En la inspección clínica al momento de la recepción se observó plumaje mojado, postrado en el fondo del cesto transporte, hipotermia, alerta pero poco responsivo y levemente deshidratado.
Se administraron 3 mg/kg de Dexametasona y complejo vitamínico del Grupo B. A continuación, se inició rehidratación oral con solución rehidratante comercial de uso humano (Gatorade). El individuo se estabilizó dos horas después del inicio del tratamiento recuperando la postura y actitud, y posteriormente se inició la administración de fórmula recuperadora en pasta para caninos (Royal Canin Recovery) a través de sondaje esofágico.
Cuatro horas después, el individuo comenzó a alimentarse por sus propios medios -ingesta de pequeños peces (Odontesthes sp.) de consumo humano adquiridos en comercio local- además de iniciar deposiciones con abundantes uratos concentrados y escasa porción fecal, todos ellos signos de evolución favorable.
Se observó presencia de ectoparásitos Phthiraptera, por lo que se aplicó spray de Fipronil. Las siguientes 24 horas sostuvo una evolución favorable con significativa mejoría de estado general y apetito, aumentó la frecuencia y volumen de deposiciones y se tomaron muestras de heces para coproparasitología.
En la mañana del tercer día, regurgitó egagrópila formada por nematodes anisákidos compactados con escamas y otros restos de peces, luego de lo cual, inició una rápida pendiente de desmejoramiento. Desde entonces perdió nuevamente el apetito e ingresó gradualmente en estado letárgico, hasta caer de la percha en estado comatoso solo 8 horas después de evacuar la egagrópila. Se alojó entonces bajo lámpara infrarroja y se colocó vía intraósea.
Se obtuvo muestra de sangre periférica para extendidos y determinación de Hematocrito. Se administraron fluidos durante 6 horas con mejorías transitorias ante la administración de bolos de Glucosa 25 %, sin lograr estabilización ni diuresis hasta paro cardiorrespiratorio final.
Durante los intentos de estabilización se administró Solución de Ringer Lactato en infusión intraósea continua, Furosemida 1 mg/kg, Metoclopramida 2mg/kg, Dexametasona 3 mg/kg y en dos oportunidades se administró, por sondaje esofágico, papillas de pescado con solución electrolítica rehidratante,(15,16,17) las cuales fueron más tarde regurgitadas. Los signos dominantes fueron: anuria, letargia, postración, desconexiones temporales del sensorio y respiración lenta y superficial. Todos los signos antedichos se asocian con falla renal y desbalance metabólico grave.
Las muestras fecales, luego del examen directo en montaje húmedo, se analizaron mediante técnicas de flotación en soluciones de Sheather y de Sulfato de Zinc al 33,6 %, además de sedimentación en agua jabonosa al 1 % (Trematodes).
Por otra parte, se realizaron las correspondientes tinciones a los extendidos de sangre, a saber: tinción hematológica rápida (Color Fast –Biopack) y tinción de Giemsa.
A partir de la necropsia realizada, se tomaron muestras de esófago, proventrículo/ventrículo, intestinos, hígado, páncreas, corazón, laringe, tráquea, siringe, bronquio, pulmones, riñones, cloaca, musculo y bazo, las cuales se fijaron en Formol al 10 % y posteriormente, se realizó la tinción con Hematoxilina y Eosina (H&E) correspondiente a cada muestra.
Luego de la observación de alteraciones renales se tiñeron cortes adicionales de este órgano con ácido peryódico de Schiff (PAS). Finalmente, si bien se intentó la extracción de ADN coccidial a partir de tejido renal con el fin de realizar estudios moleculares, los intentos resultaron infructuosos debido a la larga permanencia de estos cortes en formol.
RESULTADOS
El Hematocrito fue de 39,7 % y en el análisis de los extendidos de sangre periférica no se encontraron hemoparásitos. En particular, los extendidos obtenidos de la capa de leucocitos del tubo de hematocrito (tinción de Giemsa) resultaron negativos.
Las muestras fecales, procesadas por las técnicas antes mencionadas, comprobaron la presencia de abundante cantidad de huevos de Contracaecum sp., escasos huevos de capiláridos y abundante cantidad de ooquistes no esporulados de coccidios. En los montajes húmedos directos (sin procesamiento de concentración) se observó, además, una gran cantidad de cilindros urinarios con presencia de contenido hemático (Figura 1).
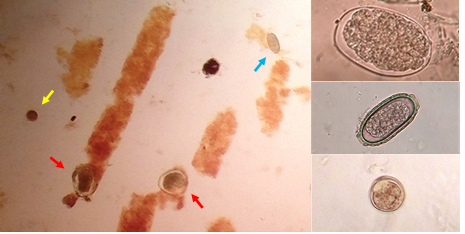
Figura 1. Fotomicrografías de análisis coprológicos. A la izquierda: imagen de examen directo en montaje húmedo; se observa un Ooquiste (Flecha amarilla), dos huevos de Contracaecum sp. (Flechas rojas) y un huevo de capilárido (Flecha. Azul). A la derecha: imágenes ampliadas de los tres hallazgos presentes en las muestras.
Dado que todas las muestras de heces y tejidos fueron conservadas inicialmente en soluciones formoladas para su posterior procesamiento, desafortunadamente, no fue posible más tarde inducir la esporulación de ooquistes para su correcta identificación de género.
Hallazgos de necropsia
El espécimen no presentó lesiones cutáneas ni musculares. Las alteraciones dominantes a la apertura de la cavidad celómica fueron la presencia de moderada cantidad de líquido pericárdico seroso ligeramente turbio, hepatomegalia más marcada en lóbulo derecho, vesícula biliar con moderada repleción y una notable distensión gástrica global, ya que una característica de la Familia Phalacrocoracidae es la ausencia de división externamente visible entre proventrículo y ventrículo.(18)
Luego de retirados el corazón y el aparato digestivo, se observaron tanto las alteraciones renales como la presencia de áreas congestivas en ambos pulmones. Los riñones presentaron agrandamiento, superficie irregular, bordes laterales algo redondeados y decoloración general con presencia de áreas focales francamente pálidas (Figura 2).
Durante la apertura del tubo gastrointestinal se comprobó que en el proventrículo-ventrículo la gran distensión se debía a una enorme carga de vermes Contracaecum sp., ocupando casi la totalidad del órgano junto con restos de peces no digeridos. La gran mayoría de estos vermes se encontraban libres en la luz del órgano, y luego de lavado bajo chorro de grifo se observó que los vermes adheridos a la pared solo estaban presentes en la región de glándulas proventriculares. En el análisis de los contenidos de todas las secciones del tracto gastrointestinal no se recuperaron capiláridos adultos.
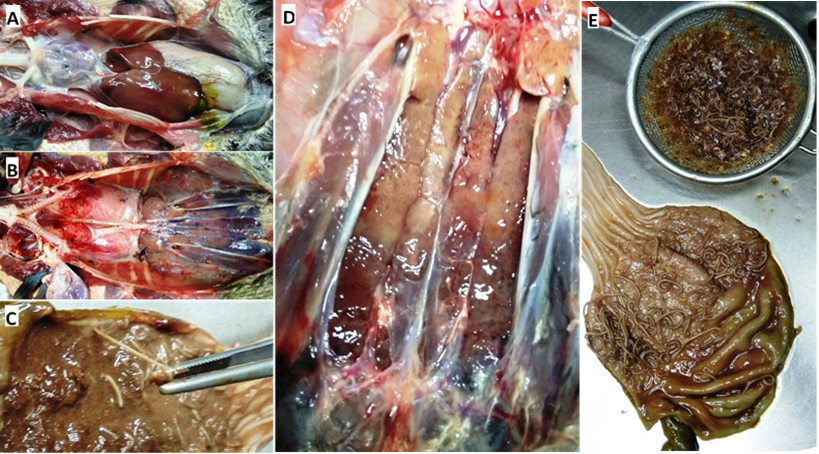
Figura 2. Hallazgos macroscópicos más relevantes. A- Aspecto general a la apertura de la cavidad celómica. B- Vista luego de remover el corazón y el tubo digestivo, obsérvese la coloración de los pulmones y riñones. C- Detalle de la sujeción de vermes a la mucosa proventricular. D- Aspecto de los riñones in situ durante la necropsia. E- Aspecto del estómago y esófago abiertos mostrando los vermes anclados a la mucosa luego del lavado bajo el grifo, así como los contenidos recuperados de su cavidad.
Hallazgos histopatológicos
Las alteraciones tisulares más importantes se encontraron en los cortes de tejido renal, y mostraron varias similitudes con las descriptas por Yabsley(19) y Abollo et al.(11)
Se observó una severa y extensiva nefrosis caracterizada por degeneración del epitelio de los túbulos contorneados, comenzando con vacuolización en la región basal de las células y desplazamiento de los núcleos hacia el borde apical, reduciendo inicialmente la luz del túbulo, y terminando con el desprendimiento de las células epiteliales de su membrana basal, colapsando éstas hacia la luz tubular y provocando su obliteración.
De igual forma se observó distensión del espacio de Bowman, marcada en ciertos sectores de los cortes, y extravasación sanguínea alrededor de algunos vasos intralobulillares. Distensión de túbulos colectores mostrando, algunos de ellos, oclusión total de la luz con grandes acúmulos de ooquistes, además de material proteináceo y detritus celulares. Presencia de túbulos extremadamente distendidos en forma de grandes masas, conservando intacta la membrana basal, sin embargo, sus células epiteliales se observaron marcadamente agrandadas repletas de los estadios multiplicativos de Eimeria. Varios túbulos se observaron con tamaños similares pero repletos de ooquistes mientras que en otros coexistieron diferentes estadios de desarrollo incluyendo ooquistes.
Resultó realmente dificultoso encontrar áreas con túbulos renales sin cambios en sus cubiertas epiteliales, y cuando estaban presentes, se hallaron comprimidos por desplazamiento mecánico debido a la distensión de aquellos alterados a su alrededor. A pesar de los cambios en la arquitectura normal del tejido comentados, se observó escasa o nula infiltración inflamatoria del intersticio intertubular, posiblemente debido a que las membranas basales de dichos túbulos no habían sufrido disrupción, lo cual ocasionaría derrames del contenido tubular hacia el tejido conectivo adyacente con la consecuente respuesta inflamatoria (Figura 3).
Dado que el propósito del presente trabajo no es la descripción detallada de las lesiones histopatológicas específicas de cada aparato o sistema, sino el análisis de las alteraciones asociadas a la coccidiosis renal y sus manifestaciones clínicas. No obstante, se hace oportuno mencionar someramente las alteraciones en otros órganos que pudieran ser relevantes para establecer el estatus sanitario inmunológico en el cual tuvo lugar el cuadro clínico fatal.
En el tejido pulmonar se observaron microtrombos en algunos vasos sanguíneos, edema perivascular y ligera congestión en el lecho capilar. En las secciones de aparato gástrico destacó la distensión de la luz de múltiples glándulas proventriculares profundas debido a la presencia de Contracaecum en su interior, con hemorragias y ulceraciones en la superficie luminal de la mucosa. En intestino delgado se hallaron capiláridos alojados en el espesor de la mucosa, algunos de ellos conteniendo huevos, ruptura y acortamiento de las vellosidades, necrosis epitelial de las mismas y necrosis en la cubierta epitelial de las criptas con acumulo de detritus necróticos en su interior, con moderado infiltrado inflamatorio en conectivo adyacente (Figura 4).
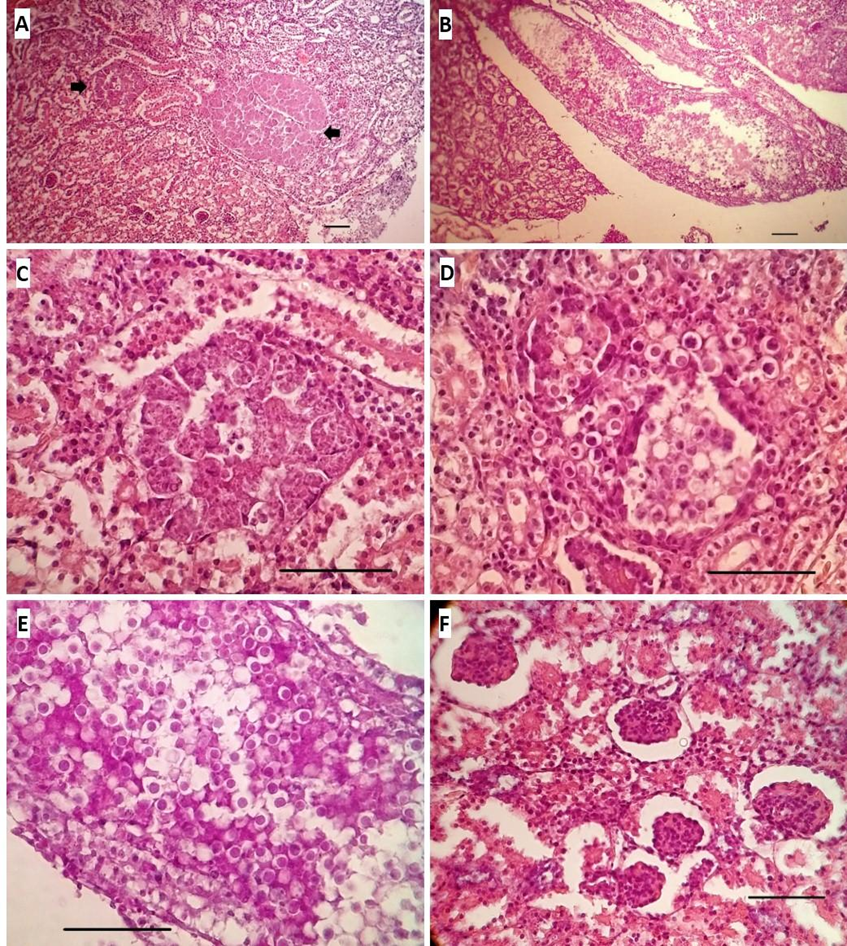
Figura 3. A- pérdida generalizada de la disposición normal de los epitelios tubulares y el colapso de la luz en mayoría de ellos; las flechas señalan sectores grandes masas con estadios multiplicativos coccidiales (H&E 10x). B- Sección longitudinal de un túbulo colector principal muy distendido por la presencia de grandes cantidades de ooquistes, detritus celulares y uratos (PAS 10x). C-Sector de A con mayor aumento en el que observa un túbulo distendido con sus células epiteliales albergando múltiples merontes y gamontes (H&E 40x). D- Sección transversa de varios túbulos contiguos repletos de ooquistes ocluyendo la luz (H&E 40x). E- Mayor magnificación del sector medio del tubo colector (mostrado en B).Se muestra lo que podría considerarse como un “embolo” de ooquistes ocluyendo el canal tubular (PAS 40x). F- Detalle de la importante distensión de espacios de Bowman; obsérvese la expansión de algunos túbulos y la resultante compresión de otros cercanos (PAS 40x). Barra = 50 µ.
Por último, en los cortes de hígado se observó ligera hiperplasia de células de Kupffer alrededor de algunas vénulas centrolobulillares, y presencia de focos aislados de decoloración acidofílica con pérdida de detalles citoplásmicos y nucleares de las láminas de hepatocitos, en la zona media entre áreas portales y venas centrolobulillares.
El resto de los órganos muestreados presentaron pocos o ningún cambio significativo para el caso.
DISCUSIÓN
Si bien fallaron los intentos de aplicar técnicas moleculares y no fue posible la esporulación de ooquistes para la identificación de género o incluso especie del coccidio asociado al caso clínico, en base al actual estatus del conocimiento sobre las coccidiosis aviares, podemos inferir que estamos en presencia de una Eimeria sp. dado el tamaño y características de los ooquistes y que tanto las fases multiplicativas asexuales como las sexuales se completan en el mismo huésped. El único diagnóstico diferencial que se impone como coccidiosis
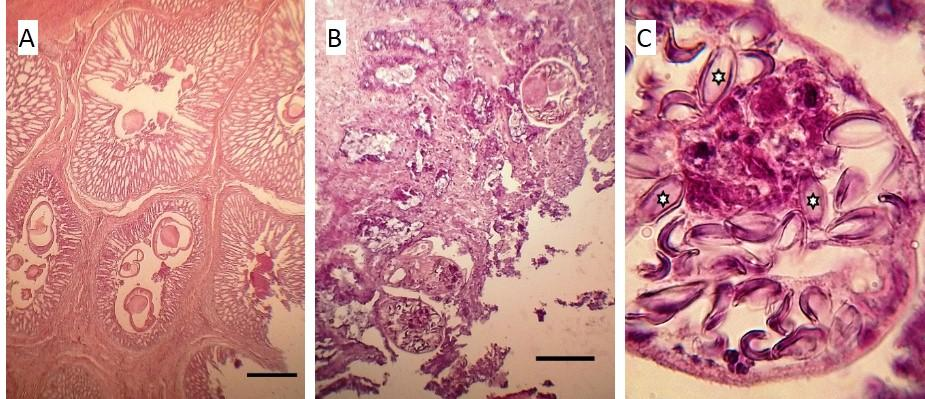
Figura 4. A- Corte de espesor completo de la mucosa proventricular, con la capa muscular en la esquina superior izquierda y la luz del órgano en la inferior derecha, resaltando la masiva ocupación de las glándulas proventriculares con vermes Concaracaecum (H&E 10x). B- Sección de espesor completo de la mucosa del intestino delgado evidenciando la disrupción de las vellosidades y la presencia de Capiláridos en la base de las mismas (H&E 10x). C- Detalle del contenido de huevos elípticos de doble pared característicos de Capillaria sp., en tres de los cuales (estrellas) se observan sus típicos tapones polares - verme en la parte inferior de B- (H&E Oil 100x). Barra = 100 µ.
extraintestinal es el grupo de Isospóridos formalmente llamados Atoxoplasma, sin embargo, sus estadios multiplicativos fuera del intestino solo ocurren en células fagocíticas del sistema reticuloendotelial y leucocitos sanguíneos,(20) lo cual no fue observado en este caso, sumado a que solo se reportan principalmente en paseriformes. A la luz de la evidencia previamente comentada, el único género posible sería Eimeria en este caso.
Adicionalmente a lo expuesto en el párrafo anterior, a partir del descubrimiento de Eimeria truncata,(21) la primera descripción de coccidiosis renal, los reportes de coccidiosis renal en cormoranes que anteceden al presente trabajo fueron producidos por especies de Eimeria.
Un aspecto sobre estos parásitos que ha sido ampliamente discutido, es cuál es su potencial patógeno real, lo cual sigue siendo controversial en fauna silvestre debido fundamentalmente a que suele ser un hallazgo incidental en aves muertas por otras causas o que simplemente no se logró establecer esta coccidiosis como causa primaria de muerte.
Sin embargo, en este caso, la presentación clínica sobreaguda y evolución asociada a los hallazgos histopatológicos presentados, demuestran la capacidad patogénica y letal de esta coccidiosis. Así como pudo confirmarse la presencia de una alta carga de nematodes, también está claro que estos son un hallazgo frecuente en cormoranes y otras aves costeras que no suelen mostrar signo clínico alguno.
Por otra parte, los mismos vermes ya estaban allí probablemente desde hacía semanas o meses y, aun así, el ave mostró vigor, alerta y un apetito voraz 24 horas antes del abrupto cambio de estado determinado por la falla renal aguda. Es posible que para aves conteniendo un cierto número de merontes renales y con cierta tasa de gametogonia y cadencia de maduración de ooquistes, sea fisiológicamente tolerable por debajo de determinado umbral.
En caso de superarse dicho umbral de maduración y eliminación de ooquistes debido a cambios en el estatus inmune, es esperable observar variabilidad en los niveles de impacto sobre la función renal y la homeostasis general.
Más aún, con una importante cantidad de masas crecientes de merontes y gamontes diseminadas en el tejido renal comprimiendo el parénquima circundante, si estas se “sincronizan” por algún evento de estrés orgánico o cambios significativos en su entorno provocando masiva maduración y descarga de ooquistes, se espera la obliteración mecánica del sistema tubular renal debida a estos, así como a la gran cantidad de detritus celulares y material proteináceo resultantes del desprendimiento del epitelio de los túbulos hacia la luz de los mismos.
En consecuencia, se produce un aumento de la presión intratubular proximal a estas obstrucciones, así como en los espacios glomerulares de Bowman, resultando en una dramática reducción del filtrado renal normal y redundando en pérdida de la homeostasis. Lo antedicho se evidencia a lo largo de los hallazgos presentados en este reporte.
Respecto al Eimérido hallado en este trabajo, debido a la carencia de reportes de coccidiosis renal en Sudamérica, a que P. brasilianus no es una especie migrante y solo se desplaza entre áreas costeras cercanas entre sí, y a la ausencia de reportes sobre coccidiosis renal en esta especie, es altamente probable que este sea el hallazgo de una nueva especie de Eimeria.
Serán necesarias futuras investigaciones para confirmar el estatus de nueva especie de Eimeria, así como para determinar su distribución y su impacto sobre las poblaciones de cormoranes y quizás de otras aves costeras.
REFERENCIAS BIBLIOGRÁFICAS
1. Frere E, Quintana F, Gandini P. Cormoranes de la costa patagónica: estado poblacional, ecología y conservación. El hornero 2005;20:35-52.
2. Conde-Tinco MA, Iannacone J. Bioecología del Phalacrocorax brasilianus (Gmelin, 1789)(Pelecaniformes: Phalacrocoracidae) en Sudamérica. The Biologist 2013;11:151-66. https://doi.org/10.24039/rtb2013111439.
3. Darrieu CA, Camperi AR, Piloni G, Bogado NR. Lista actualizada de las aves de la provincia de Buenos Aires. Buenos Aires: Fundación de Historia Natural «Félix de Azara»; 2013.
4. Iannacone J, Atasi M, Bocanegra T, Camacho M, Montes A, Santos S, et al. Diversidad de aves en el humedal Pantanos de Villa, Lima, Perú: periodo 2004-2007. Biota Neotrop 2010;10:295-304. https://doi.org/10.1590/S1676-06032010000200031.
5. Garbin L, Mattiucci S, Paoletti M, González-Acuña D, Nascetti G. Genetic and morphological evidences for the existence of a new species of Contracaecum (Nematoda: Anisakidae) parasite of Phalacrocorax brasilianus (Gmelin) from Chile and its genetic relationships with congeners from fish-eating birds. J Parasitol 2011;97:476-92. https://doi.org/10.1645/GE-2450.1.
6. Biolé FG, Guagliardo SE, Mancini MA, Tanzola RD, Salinas V, Morra G. Primer registro de Contracaecum australe (Nematoda: Anisakidae) en Phalacrocorax brasilianus (Aves: Phalacrocoracidae) de la región central de Argentina. BioScriba 2012;5:1-11.
7. González-Acuña D, Llanos-Soto S, Oyarzún-Ruiz P, Kinsella JM, Barrientos C, Thomas R, et al. Parasites of the Neotropic cormorant Nannopterum (Phalacrocorax) brasilianus (Aves, Phalacrocoracidae) in Chile. Rev Bras Parasitol Vet 2020;29:e003920. https://doi.org/10.1590/S1984-29612020049.
8. Wobeser G. Renal coccidiosis in mallard and pintail ducks. J Wildl Dis 1974;10:249-55. https://doi.org/10.7589/0090-3558-10.3.249.
9. Oksanen A. Mortality associated with renal coccidiosis in juvenile wild greylag geese (Anser anser anser). J Wildl Dis 1994;30:554-6. https://doi.org/10.7589/0090-3558-30.4.554.
10. Rossin A, Malizia AI. Relationship between helminth parasites and demographic attributes of a population of the subterranean rodent Ctenomys talarum (Rodentla: Octodontidae). J Parasitol 2002;88:1268-70. https://doi.org/10.1645/0022-3395(2002)088[1268:RBHPAD]2.0.CO;2.
11. Abollo E, Pascual S. Renal coccidiosis in the European cormorant Phalacrocorax aristotelis aristotelis from the Galician coast. Journal of the Marine Biological Association of the United Kingdom 2005;85:1017-9. https://doi.org/10.1017/S0025315405012075.
12. Atkinson CT, Thomas NJ, Hunter DB, editores. Parasitic Diseases of Wild Birds. Oxford, UK: Wiley-Blackwell; 2008. https://doi.org/10.1002/9780813804620.
13. Yabsley MJ, Gibbs SEJ. Description and phylogeny of a new species of Eimeria from double-crested cormorants (Phalacrocorax auritus) near Fort Gaines, Georgia. J Parasitol 2006;92:385-8. https://doi.org/10.1645/GE-592R.1.
14. Jankovsky JM, Brand M, Gerhold RW. Identification of a Novel Renal Coccidian (Apicomplexa: Eimeriidae) from the Great-Horned Owl ( Bubo virginianus ), USA. J Wildl Dis 2017;53:368-71. https://doi.org/10.7589/2016-06-132.
15. Beynon PH, Forbes NA, Harcourt-Brown NH. BSAVA manual of raptors, pigeons and waterfowl. Cheltenham, Gloucestershire: British Small Animal Veterinary Association; 1996.
16. Tully TN, Dorrestein GM, Jones AK. Handbook of avian medicine. 2nd ed. Edinburgh: Elsevier/Saunders; 2009.
17. Hawkins MG, Guzman DS-M, Beaufrère H, Lennox AM, Carpenter JW. Chapter 5 - Birds. En: Carpenter JW, Marion CJ, editores. Exotic Animal Formulary (Fifth Edition), W.B. Saunders; 2018, p. 167-375. https://doi.org/10.1016/B978-0-323-44450-7.00005-9.
18. Dziala-Szczepanczyk E, Wilczynska I. Morphology and morphometric analysis of selected elements of digestive tract in great cormorant Phalacrocorax carbo sinensis. Electronic Journal of Polish Agricultural Universities Series Biology 2010;13:25.
19. Yabsley MJ, Gottdenker NL, Fischer JR. Description of a new Eimeria sp. and associated lesions in the kidneys of double-crested cormorants (Phalocrocorax auritus). J Parasitol 2002;88:1230-3. https://doi.org/10.1645/0022-3395(2002)088[1230:DOANES]2.0.CO;2.
20. Barta JR, Schrenzel MD, Carreno R, Rideout BA. The Genus Atoxoplasma (Garnham 1950) as a Junior Objective Synonym of the Genus Isospora (Schneider 1881) Species Infecting Birds and Resurrection of Cystoisospora (Frenkel 1977) as the Correct Genus for Isospora Species Infecting Mammals. Journal of Parasitology 2005;91:726-7. https://doi.org/10.1645/GE-3341.1.
21. Railliet A, Lucet A. Une nouvelle maladie parasitaire de l’oie domestique, determinée par des coccidies. CR Soc Biol (Paris) 1890;42:293-4.
AGRADECIMIENTOS
Queremos agradecer a Erika Badura, de la Cátedra de Patología de Aves y Pilíferos, Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata, por su entusiasta colaboración técnica en la elaboración de las preparaciones histológicas del presente trabajo.
FINANCIAMIENTO
Los autores no tienen financiamiento ni intereses económicos relevantes que declarar.
CONFLICTO DE INTERESES
Los autores no tienen conflictos de intereses para declarar que sean relevantes para el contenido de este artículo.
CONTRIBUCIONES DE AUTORÍA
Conceptualización: Sergio Ivan Garijo.
Redacción original y elaboración de imágenes: Sergio Ivan Garijo.
Revisión de redacción y edición: Sergio Ivan Garijo, Javier Origlia.
Técnicas moleculares: Javier Origlia.
Análisis de muestras histopatológicas: María Cecilia Netri, Nancy Arias, Hugo Lopez Faray, Norberto Fabian Lopez.
Supervisión: Norberto Fabian Lopez, Miguel Victor Piscopo.
Redacción – borrador original: Sergio Ivan Garijo.
Redacción – revisión y edición: Sergio Ivan Garijo, María Cecilia Netri, Javier Origlia, Nancy Arias, Hugo Lopez Faray, Norberto Fabian Lopez, Maria Florencia Unzaga, Miguel Victor Piscopo.